实验五混合碱的测定
- 格式:doc
- 大小:53.50 KB
- 文档页数:4


混合碱的分析
一.实验目的与要求:
①掌握双指示剂法测定混合碱的原理。
②掌握用双指示剂法测定混合碱的实验操作及准确判断双指示剂终点颜色的变化。
③掌握移液管的操作方法。
④了解双指示剂的使用,学会混合碱组分的分析判断。
二.实验原理:
反应式:
V1:Na2CO3+ HCl = NaCl + NaHCO3
NaOH + HCl = NaCl + H2O
V2:NaHCO3 + HCl = NaCl + CO2↑ + H2O
三.实验仪器与试剂:
仪器:移液管、烧杯、量筒、酸式滴定管、锥形瓶。
试剂: HCl标准溶液、甲基橙指示剂、酚酞指示剂、混合碱试样。
四.操作步骤:
用吸量管吸取2.00ml混合碱于锥形瓶,加蒸馏水20.00ml,加酚酞2滴,以0.1mol/LHCl标定液标定至红色刚好变为无色,记下V1HCl,再加入甲基橙2滴,继续用HCl标液滴定至由黄色恰好变为橙色,记下V2HCl,平行测三次。
要求总碱度的相对平均偏差不大于0.3%。
五.数据记录与处理:
计算公式:
六、注意事项:
混合碱由Na2CO3和NaOH组成时,酚酞指示剂可多加几滴,否则因滴定不完全使NaOH的测定结果偏低,Na2CO3的测定结果偏高。
近终点时,一定要充分摇匀,以防形成CO2的过饱和溶液而使终点提前到达。


混合碱的分析实验报告
实验目的,通过实验分析混合碱的成分及其浓度。
实验原理,混合碱是由两种或两种以上的碱混合而成的物质,通常包括氢氧化钠、氢氧化钾等。
本实验通过酸碱中和反应,利用滴定法测定混合碱中各种碱的浓度。
实验步骤:
1. 取一定量的混合碱溶液,用酚酞指示剂滴定至中性。
2. 用已知浓度的盐酸标定溶液对混合碱进行滴定,记录滴定所需的标定溶液体积。
3. 计算混合碱中各种碱的浓度。
实验数据:
1. 滴定混合碱所需的盐酸标定溶液体积为20.5mL。
2. 已知盐酸标定溶液的浓度为0.1mol/L。
实验结果:
根据滴定所需的盐酸标定溶液体积和标定溶液的浓度,可以计算出混合碱中各种碱的浓度。
实验结论:
通过本次实验,成功分析出混合碱中各种碱的浓度,为进一步研究混合碱的性质和应用提供了重要数据支持。
实验注意事项:
1. 实验操作过程中要注意安全,避免溶液溅出造成伤害。
2. 实验中使用的玻璃仪器要干净无杂质,以保证实验结果的准确性。
实验展望:
本次实验只是初步分析了混合碱的成分及浓度,后续可以通过更多的实验方法和手段,深入研究混合碱的性质和应用,为工业生产和科研提供更多的参考依据。
总结:
混合碱的分析实验为我们提供了一种简单而有效的方法,可以准确分析出混合碱中各种碱的成分及浓度,为相关研究和应用提供了重要的数据支持。
希望通过今后的实验研究,能够更深入地了解混合碱的性质和应用,为相关领域的发展做出更大的贡献。
以上就是本次混合碱的分析实验报告,谢谢阅读。

混合碱中碳酸钠和碳酸氢钠含量的测定实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1.了解双指示剂法测定混合碱的原理;2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3) ↓酚酞指示剂 红色↓HCl 溶液滴定(V 1mL )无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3)↓溴甲酚绿-二甲基黄指示剂(混合指示剂) 绿色↓HCl 溶液滴定(V 2mL )亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132⨯⨯-=⨯⨯=s s m V V HCl c NaHCO m V HCl c CO Na又 Na 2O+CO 2=Na 2CO 3 n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl 所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl1000))((21%212⨯+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解−−→−−−−→−−−→−移 2.试样溶液的测定及数据处理[已知c(HCl)= mol·L -1]。


实验五双指示剂法测定混合碱中各组分的含量一、实验目的1、学会用双指示剂法测定混合碱的原理和方法;2、进一步熟练滴定操作技术和正确判断滴定终点。
二、实验原理混合碱系指Na2CO3与NaOH或Na2CO3与NaHCO3的混合物,可采用“双指示剂”法测定其组成及各组分含量。
若混合碱是Na2CO3与NaOH的混合物,用HCl标准溶液进行滴定时首先发生如下的反应:HCl + NaOH ═ NaCl + H2OHCl + Na2CO3═ NaHCO3 + NaCl当NaOH完全被中和,而Na2CO3被中和至NaHCO3时,即达到第一个化学计量点,此时溶液的pH为8.3,故选酚酞作指示剂,用HCl标准溶液滴定至溶液刚好由红色褪至无色。
设用去标准酸溶液V1ml。
继续用盐酸标准溶液滴定,发生如下反应:HCl + NaHCO3═ NaCl + H2O + CO2↑当此反应恰好进行完时,即达到第二个化学计量点,此时溶液的pH为3.89,故选甲基橙作指示剂,用HCl标准溶液滴定至溶液刚好由橙黄变为橙红色。
设用去标准溶液V2ml。
由反应式可知:在Na2CO3与NaOH共存情况下,用双指示剂滴定时,V1>V2,且Na2CO3消耗标准酸的体积为2V2,NaOH消耗标准酸的体积为(V1-V2)。
根据标准酸的浓度和所消耗的体积,可算出混合碱中Na2CO3和NaOH的百分含量。
若混合碱是Na2CO3与NaHCO3的混合物,以上述同样方法进行滴定,则V1<V2,且Na2CO3消耗标准酸的体积为2V1,NaHCO3消耗标准酸的体积为(V2-V1)。
由以上讨论可知,若混合碱是未知组分的试样,则可根据V1与V2的数据,确定试样由何种碱所组成,从而算出试样中各组分的百分含量。
三、实验仪器与试剂酸式滴定管(25ml ),锥形瓶,洗耳球,移液管(25ml 、20ml ),容量瓶(100ml );0.1mol·L -1HCl 标准溶液,待测混合碱溶液,甲基橙指示剂,酚酞指示剂。

混合碱的测定
一、实验目的
1、掌握双指示剂法测定NaOH 和Na2CO3 混合物中各组分的原理和方法
2、掌握掌握移液管和容量瓶的使用方法
二、实验原理(略)
三、仪器与试剂
四、实验步骤
1、从公用试剂瓶中准确移取20ml 混合碱溶液至100ml容量瓶中,定容;
2、准确移取定容后的溶液20ml 三份于三个锥形瓶中;
3、各加酚酞指示剂1滴,以HCl 标准溶液滴定至溶液无色,记录体积V1;
4、再分别各加甲基橙指示剂1~2 滴,继续以HCl 标准溶液滴定至溶液由
黄→橙,记录第二步消耗HCl体积为V2。
附:注意事项
1、试样溶液不应久置于空气中,因此做完一份,再移取另一份,共做三份;
2、移液管移取不同浓度的碱液,注意润洗,润洗前要吸干移液管中残余水
分;
3、滴定分两步进行,第一步滴定至红色恰好消失,计量点前滴定不应过快,
第一步消耗HCl的体积为V1;
4、第二步滴定很快会到达终点,要慢速,接近计量点时大力振摇,第二步
消耗HCl体积为V2;
5、做完实验,待教老师签字后,到掉HCl,装入配好的Na2S2O4。
五、数据处理及计算结果
1 2 3
C HCl(mol/L)
V1(ml)
V2(ml)
Na2CO3%(w/v)
RSD%(Na2 CO3 )
V1+ V2(ml)
总碱量%(w/v)
RSD% (总碱量)
注:总碱量以NaOH计
计算公式:
六、讨论(略)
七、思考题
P451、3、4。

混合碱中碳酸钠和碳酸氢钠含量的测定实验五、混合碱中碳酸钠和碳酸氢钠含量的测定⼀、实验⽬的1.了解双指⽰剂法测定混合碱的原理;2.理解混合碱中各组分的测定⽅法以及相关计算。
⼆、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3)↓酚酞指⽰剂红⾊↓HCl 溶液滴定(V 1mL )⽆⾊(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3) ↓溴甲酚绿-⼆甲基黄指⽰剂(混合指⽰剂) 绿⾊↓HCl 溶液滴定(V 2mL )亮黄⾊(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132??-==s s m V V HCl c NaHCO m V HCl c CO Na⼜ Na 2O+CO 2=Na 2CO 3n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl 所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl 1000))((21%212?+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解??→→→?移2.试样溶液的测定及数据处理[已知c(HCl)= mol·L -1]。
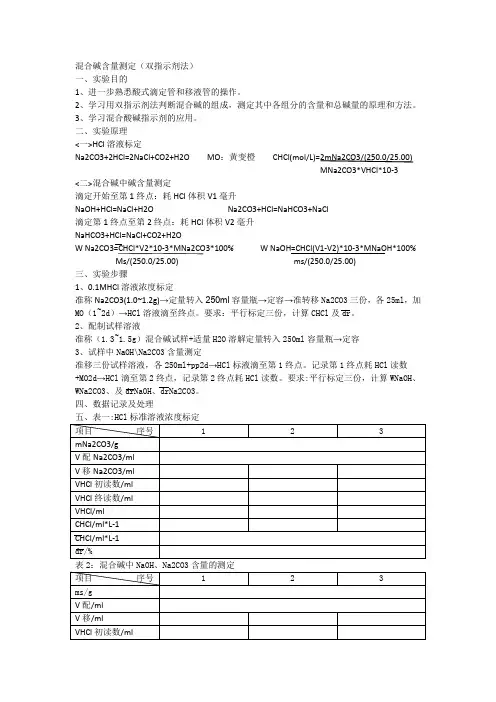
混合碱含量测定(双指示剂法)一、实验目的1、进一步熟悉酸式滴定管和移液管的操作。
2、学习用双指示剂法判断混合碱的组成,测定其中各组分的含量和总碱量的原理和方法。
3、学习混合酸碱指示剂的应用。
二、实验原理<一>HCl溶液标定Na2CO3+2HCl=2NaCl+CO2+H2O MO:黄变橙CHCl(mol/L)=2mNa2CO3/(250.0/25.00)MNa2CO3*VHCl*10-3<二>混合碱中碱含量测定滴定开始至第1终点:耗HCl体积V1毫升NaOH+HCl=NaCl+H2O Na2CO3+HCl=NaHCO3+NaCl滴定第1终点至第2终点:耗HCl体积V2毫升NaHCO3+HCl=NaCl+CO2+H2OW Na2CO3=CHCl*V2*10-3*MNa2CO3*100% W NaOH=CHCl(V1-V2)*10-3*MNaOH*100% Ms/(250.0/25.00) ms/(250.0/25.00)三、实验步骤1、0.1MHCl溶液浓度标定准称Na2CO3(1.0~1.2g)→定量转入250ml容量瓶→定容→准转移Na2CO3三份,各25ml,加MO(1~2d)→HCl溶液滴至终点。
要求:平行标定三份,计算CHCl及dr。
2、配制试样溶液准称(1.3~1.5g)混合碱试样+适量H2O溶解定量转入250ml容量瓶→定容3、试样中NaOH\Na2CO3含量测定准移三份试样溶液,各250ml+pp2d→HCl标液滴至第1终点。
记录第1终点耗HCl读数+MO2d→HCl滴至第2终点,记录第2终点耗HCl读数。
要求:平行标定三份,计算WNaOH、WNa2CO3、及drNaOH、drNa2CO3。
四、数据记录及处理五、表一:HCl标准溶液浓度标定表2:混合碱中NaOH、Na2CO3含量的测定六、误差分析.............................七、思考题.............................。

混合碱的分析——双指示剂法一、实验目的1、熟练滴定操作和滴定终点的判断;2. 掌握定量转移操作的基本要点;3. 掌握混合碱分析的测定原理、方法和计算.二、实验原理混合碱是Na2CO3与NaOH或Na2CO3与NaHCO3的混合物,可采用双指示剂法进行分析,测定各组分的含量。
在混合碱的试液中加入酚酞指示剂,用HCl标准溶液滴定至溶液呈微红色。
此时试液中所含NaOH完全被中和,Na2CO3也被滴定成NaHCO3,反应如下:NaOH + HCl = NaCl + H2ONa2CO3 + HCl = NaCl + NaHCO3设滴定体积V1mL。
再加入甲基橙指示剂,继续用HCl标准溶液滴定至溶液由黄色变为橙色即为终点。
此时NaHCO3被中和成H2CO3,反应为:NaHCO3 + HCl = NaCl + H2O + CO2↑设此时消耗HCl标准溶液的体积V2mL。
根据V1和V2可以判断出混合碱的组成。
设试液的体积为VmL。
当V1>V2时,试液为NaOH和Na2CO3的混合物,NaOH和Na2CO3的含量(以质量浓度g•L-1表示)可由下式计算:当V1<V2时,试液为Na2CO3和NaHCO3的混合物,NaOH和Na2CO3的含量(以质量浓度g•L-1表示)可由下式计算:三、实验仪器与试剂仪器:酸式滴定管,250mL容量瓶,250mL锥形瓶。
试剂:已标定好的0.10mol/L盐酸标准溶液,甲基橙1g/L水溶液;酚酞1g/L 乙醇溶液,混合碱液。
四、实验步骤1、混合碱液的稀释准确吸取混合碱液25.00mL于250mL容量瓶中,加水稀释至刻度线,摇匀。
2、混合碱液的测定用25mL的移液管移取25mL混合碱稀释液三份于250mL锥形瓶中,加2~3滴酚酞,以0.10mol/LHCl标准溶液滴定至红色变为无色为第一终点,记下HCl 标准溶液体积V1,再加入2滴甲基橙,继续用HCl标准溶液滴定至溶液由黄色恰变橙色为第二终点,记下HCl标准溶液体积V2。
5-3 混合碱的测定实验5-3 混合碱的测定一、试剂与仪器0.1mol/L HCl 标准溶液、0.2%甲基橙指示剂 、0.2%酚酞指示剂、混合碱液。
50 ml 酸式滴定管、250 ml 三角锥形瓶、25 ml 移液管、250 ml 容量瓶、50ml 量筒、洗耳球、洗瓶。
三、基本原理碱液易吸收空气中CO 2形成Na 2CO 3,苛性碱实际上往往含有Na 2CO 3,,故称为混合碱。
工业产品碱液中NaOH 和Na 2CO 3的含量,可在同一份试液中用两种不同的指示剂分别测定,此种方法称为“双指示剂法”。
测定时,混合碱中NaOH 和Na 2CO 3,是用HCl 标准溶液滴定的,其反应式如下:2NaOH+HCl=NaCl+H O233Na CO +HCl NaHCO +NaCl322NaHCO +HCl=NaCl+CO +H O可用酚酞及甲基橙来分别指示滴定终点,当酚酞变色时NaOH 巳全部被中和,而Na 2CO 3只被滴定到NaHCO 3,即只中和了一半。
在此溶液中再加甲基橙指示剂,继续滴定到终点,则生成的NaHCO 3进一步中和为CO 2。
设酚酞变色时,消耗HCl 溶液的体积为V 1,此后,至甲基变色时又用去HCl 溶液的体积为V 2,则V 1必大于V 2。
根据V 1一V 2来计算NaOH 含量,再根据2V 2计算Na 2CO 3含量。
三、 测定步骤:1.混合碱液的稀释 准确吸取混合碱液25.00ml,于250ml 容量瓶中, 用洗瓶加蒸馏水稀释至近刻度,改用滴定管加蒸馏水至准刻度,摇匀。
2.混合碱液的测定 用移液管吸取混合碱液的稀释试液25.00ml 三份, 分别置于250ml三角锥形瓶中, 加25ml 蒸馏水,再加1-2滴酚酞指示剂,用 HCl 标准溶液滴定至溶液由红色刚变为无色,即第一终点,记下V 1,然后加入2滴甲基橙指示剂于此溶液中,继续用HCl 标准溶液定,直至溶液出现橙色,即为第二终点,记下为V 2,根据V 1和V 2体积,计算NaOH 和Na 2CO 3的质量分数。
海南大学实验报告课 程:分析化学实验学院:材料与化工学院实验包括以下几项内容: 五、实验注意事项、实验目的1•掌握工业碱的总碱度测定的原理和方法。
2. 了解酸碱指示剂的变色原理以及酸碱滴定中选择指示剂的原则3•学习定量转移的基本操作。
4.了解双指示剂法测定混合碱中氢氧化钠和碳酸钠含量的原理。
二、实验原理工业碱的主要成分是碳酸钠,商品名为苏打,其中可能还含有少 量NaC k N 觅S6 NaOH NaHCQ 等杂质,用盐酸滴定时,以甲基橙 为指示剂,除了主要成分NaCQ 被滴定外,其他的碱性杂质如NaOH 、专业•班级: 日期:2017年3月27日实验名称混合碱的测定(双指示剂法)成绩学号 姓名、实验目的二、实验原理六、数据处理 三、实验仪器与试剂七、思考题四、实验步骤 八、实验分析与讨论NaHCQ等也可被滴定,因此所测定的结果是Na z CQ和NaOH或N82CQ和NaHCQ的总和,称为“总碱度”。
总碱度通常以Na?。
的质量百分含量来表示。
总碱度是衡量产品质量的指标之一,主要反应有:NaQH+HONaCI+HQNsbCQ+HC L NaHCQ+NaCINaHCQ+HClH NaCI+HQ+CQ测定时,反应产物为NaCI和H2CQ, H2CQ分解为CQ和威0, 化学计量点时,pH 值约为 3.8~3.9,因此可选用甲基橙为指示剂,用HCI标准溶液滴定至溶液由黄色转变为橙色即为终点。
工业碱中的碱性成分NaCQ与NaHCQ或Ns^CQ与NaQH的混合物称为复合碱,可以在同一份试液中用两种不同的指示剂来测定各组分的含量,这就是双指示剂法。
此法方便快捷在生产中应用普遍。
双指示剂法测定时先在混合碱试液中加入酚酞此时溶液呈红色,用HCI标准溶液滴定至溶液由红色恰好变为无色,此为第一滴定终点,消耗的盐酸溶液的体积记为V(mL);再加入甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,此为第二个滴定终点,消耗盐酸的体积为V2 (mL) ;以Na z CQ和NaQH的混合碱为例,滴定过程如下图所示根据双指示剂法中V i和V2的大小关系,可判断为知简样的组成。
混合碱的测定实验报告一、实验目的。
本实验旨在通过酸碱中和反应,利用酸度计准确测定混合碱的浓度,从而掌握酸碱中和反应的原理和方法。
二、实验原理。
混合碱是指由两种或两种以上的碱混合而成的物质。
本实验中,我们将利用盐酸与氢氧化钠中和反应的方法,通过酸度计测定混合碱的浓度。
盐酸与氢氧化钠中和反应的化学方程式为:HCl + NaOH → NaCl + H2O。
根据化学方程式,我们可以知道,1mol的盐酸中和1mol的氢氧化钠,会生成1mol的氯化钠和1mol的水。
因此,可以根据中和反应的化学方程式,利用酸度计测定盐酸的浓度,从而推算出氢氧化钠的浓度。
三、实验步骤。
1. 取一定量的混合碱溶液,加入适量的酚酞指示剂,使其呈现粉红色。
2. 用标定的盐酸溶液滴定混合碱溶液,直至颜色由粉红色变为无色。
3. 记录所耗盐酸溶液的体积V1。
4. 重复上述步骤,至少进行三次滴定,取平均值。
四、实验数据记录与处理。
1. 实验数据记录。
实验一:初试滴定体积V1 = 12.5ml。
再试滴定体积V2 = 12.3ml。
第三次滴定体积V3 = 12.4ml。
2. 实验数据处理。
平均滴定体积V = (V1 + V2 + V3) / 3 = (12.5 + 12.3 + 12.4) / 3 = 12.4ml。
五、实验结果分析。
根据实验数据处理得到的平均滴定体积V,结合盐酸的标定浓度,可以计算出混合碱的浓度。
假设盐酸的标定浓度为C(mol/L),则混合碱的浓度为C/1(mol/L)。
六、实验结论。
通过本实验的操作,我们成功地利用酸度计测定了混合碱的浓度。
实验结果表明,混合碱的浓度为C/1(mol/L)。
七、实验总结。
本实验通过酸碱中和反应,利用酸度计准确测定混合碱的浓度,达到了预期的实验目的。
在实验过程中,我们要严格控制实验操作的精度和准确性,确保实验结果的可靠性。
同时,我们还要对实验数据进行准确的记录和处理,以得出准确的实验结论。
通过本实验,我们对酸碱中和反应的原理和方法有了更深入的理解,为今后的实验操作积累了经验。
实验五 混合碱的测定
内容: P196-199
一、实验目的(明确)
1. 了解测定混合碱的原理
2. 掌握用双指示剂法测定混合碱中NaOH 与Na 2CO 3或NaHCO 3与Na 2CO 3的含量
3. 了解强碱弱酸盐滴定过程中pH 值的变化及酸碱滴定法在碱度测定中的应用
二、实验原理(讲清)
所谓混合碱通常是指NaOH 与Na 2CO 3或NaHCO 3与Na 2CO 3混合物,它们的测定通常采用双指示剂法,即在同一试液中用两种指示剂来指示两个不同的终点。
原理如下:
在混合碱试液中先加入酚酞指示剂,用HCl 标准溶液滴定至由红色刚变为无色。
若试液为NaOH 与Na 2CO 3的混合物,这时溶液中NaOH 将被完全滴定,而Na 2CO 3被滴定生成NaHCO 3,即滴定反应到达第一终点,设此时用去HCl 溶液的体积为V 1,反应式为:
NaOH + HCl ═ NaCl + H 2O Na 2CO 3 + HCl ═ NaCl + NaHCO 3
然后,再加甲基橙指示剂,继续用HCl 标准溶液滴定至由黄色变为橙色,设所消耗HCl 溶液的体积为V 2,这时,NaHCO 3全部被滴定,产物为H 2CO 3(CO 2+H 2O ),反应式为:
NaHCO 3 + HCl ═ NaCl + H 2CO 3
2+H 2O 所以甲基橙变色时滴定反应到达第二终点。
可见,滴定Na 2CO 3所需的HCl 溶液是两次滴定加入的,从理论上讲,两次用量相等。
故V 2
是滴定NaHCO 3所消耗HCl 的体积,NaOH 所消耗HCl 溶液的量为(V 1—V 2)。
那么各组分的含量按下式计算:
1000
V 1M
1000
2V 1V C 1××
=
ω-
1000
V
2M
1000
2V C 2××=
ω 式中: ω1 —— 混合碱中NaOH 的含量,g ·L –1
;
ω2 —— 混合碱中NaHCO 3的含量,g ·L –1
;
C —— HCl 溶液的浓度,mol ·L –1
;
V 1 —— 滴定过程中一阶段HCl 溶液的用量,mL ; V 2 —— 滴定过程中二阶段HCl 溶液的用量,mL ; V —— 混合碱的体积,mL ;
M 1 —— NaOH 的摩尔质量, g ·mol –1
、
M 2 —— NaHCO 3的摩尔质量, g ·mol –1
试样若为NaHCO 3与Na 2CO 3的混合物。
此时V 1<V 2,V 1仅为Na 2CO 3转化为NaHCO 3所需HCl 溶液的用量,滴定试样中NaHCO 3所需HCl 溶液的用量为(V 2—V 1)。
那么各组分的含量为:
1000
V 3M
1000
V 2V C ××
1=
3
ω-
1000
V
4M
1000
1V C ××=
4
ω 式中: 3
ω—— 混合碱中NaHCO 3的含量,g ·L
–1
;
4
ω—— 混合碱中Na 2CO 3的含量,g ·L –1
;
C —— HCl 溶液的浓度,mol ·L –1
;
V 1 —— 滴定过程中一阶段HCl 溶液的用量,mL ; V 2 —— 滴定过程中二阶段HCl 溶液的用量,mL ; V —— 混合碱的体积,mL ;
M 3—— NaHCO 3的摩尔质量, g ·mol –1。
M 4 —— Na 2CO 3的摩尔质量, g ·mol –1
三、实验仪器与试剂(叫学生实验前检查)
1. 仪器
酸式滴定管 锥形瓶(250 mL ) 移液管(25 mL ) 洗耳球 2. 试剂
HCl 溶液( mol ·L –1
) 酚酞指示剂( %) 甲基橙指示剂( %) 混合碱水溶液(待测
四、实验内容(介绍)
1. 用移液管移取已配好的混合碱溶液25 mL 于250 mL 锥形瓶中,加入2滴酚酞指示剂,立即[1]用 mol ·L –1HCl 标准溶液滴定至由红色变为近无色[2]
,记下所消耗HCl 的体积V 1 (mL)。
2. 加入甲基橙指示剂1滴,继续用HCl 标准溶液滴定至由黄色变为橙色,记下第二次所消耗HCl 的体积V 2 (mL)。
平行测定2~3次。
五、注意事项
1. 移液管的洗涤、润洗、装液和移液操作。
2. 酸式滴定管的检漏、洗涤、润洗、装液、赶气泡和调液面操作。
3. 滴定操作及滴定终点的准确判断。
六、结果与分析
1. 将实验数据填入表中。
2. 若V 1>V 2,样品仅含NaOH 和NaHCO 3,则按ω1、ω2式计算各组分的含量;若V 2>V 1,样品仅含NaHCO 3和Na 2CO 3,则按ω3、ω4式计算各组分的含量。
表1 混合碱的测定
七、思考题
1. 取等体积的同一烧碱试液2份,一份加酚酞指示剂,另一份加甲基橙指示剂,分别用HCl标准溶液滴定。
设所消耗HCl的体积分别为V1、V2。
怎样确定NaOH和Na2CO3所消耗的HCl 体积?
答:以酚酞为指示剂,其反应式为:NaOH + HCl = NaCl +H2O和Na2CO3+ HCl = NaHCO3+ NaCl,消耗HCl的体积为V1;以甲基橙为指示剂,其反应式为NaOH + HCl = NaCl +H2O和Na2CO3+ 2HCl = 2 NaCl + H2CO3(H2O + CO2),消耗HCl的体积为V2。
可见,滴定Na2CO3需要消耗HCl的体积为(V2– V1),则滴定NaOH所消耗的HCl的体积为V1– (V2– V1) = (2 V1– V2)。
2. Na2CO3是食碱主要成分,其中常含有少量NaHCO3。
能否用酚酞作指示剂,测定Na2CO3含量?
答:可以。
因为酚酞的变色范围为: ~ ,在碱性范围,用酚酞作指示剂,Na2CO3被滴定成NaHCO3,即为滴定终点。
这时所消耗HCl的体积的2倍即为Na2CO3全部被滴定消耗的HCl的体积,根据HCl标准溶液的浓度及其消耗的体积即可计算Na2CO3的含量。
3. 为什么移液管必须要用所移取溶液润洗,而锥形瓶则不用所装溶液润洗?
答:(1)若不用被移取溶液润洗移液管,则移液管内壁挂的水珠会讲被移取溶液稀释,即由移液管移到锥形瓶中的待测液浓度比原试剂瓶中的浓度小,滴定使讲出现负误差。
(2)滴定根据的原理就是化学反应的计量关系,只要待测液的物质的量n是准确的,在滴定结果就是准确的,所以,由移液管准确移取一定体积的待测液,其n必是准确的,所以,锥形瓶无须用所装溶液润洗。
4. 本实验用酚酞作指示剂时,所消耗的HCl的体积比甲基橙的少,为什么?
答:这说明本实验所用混合碱试样中仅含NaHCO3和Na2CO3。