2015年高中化学竞赛辅导无机化学s区和p区元素化学引言知识点素材
- 格式:doc
- 大小:1.40 MB
- 文档页数:3




§12-3 硒分族The Selenium Subgroup一、General Properties:1.Se 和Te 是稀散元素(scattered elements ),Po 是稀有元素(rare elements )2.Coordination number :S 、Se 与O 原子配位,配位数为3,4。
Te 与O 原子配位,配位数达6。
如:H 2SO 4、H 2SeO 4、H 6TeO 63.最高氧化态稳定性 SF 6>SeF 6<TeF 6 PoF 6>SF 6二、Simple S ubs tances1.Se 不与水、稀酸反应 Te + 2H 2O TeO 2 + 2H 2↑ Po + 2HClPoCl 2 + H 2↑ Se 与Te 可被HNO 3氧化 3Se + 4HNO 3(稀) + H 2O 3H 2SeO 3 + 4NO ↑由于 -+-++e2H 4SeO 24H 2SeO 3 + H 2O φ = +1.15V 所以HNO 3不能把Se 氧化成-24SeOPo + 8HNO 3Po(NO 3)4 + 4NO 2 + 4H 2O2.Disproportionation: 3M + 6KOHK 2MO 3 + 2K 2M + 3H 2O (M = Se 、Te ) 3.Preparation:从制备H 2SO 4的方法中用MnO 2氧化得SeO 2、TeO 2,然后 MO 2 + 2SO 2M + 2SO 3 三、The Compounds:1.[-2 ] O.S. H 2Se 、H 2Te(1) 酸性: H 2Te >H 2Se >H 2S ,(2) 还原性: H 2Te >H 2Se >H 2S(3) 制备(水解法):Al 2Se 3 + 6H 2O3H 2Se + 2Al(OH)3,Al 2Te 3 + 6H 2O 3H 2Te + 2Al(OH)3 2.[ +2 ] O.S. TeCl 2、SeCl 2不稳定2TeCl 2TeCl 4 + Te , 2SeCl 2 + 3H 2O H 2SeO 3 + Se + 4HCl3.[ +4 ] O.S. SO 2 → SeO 2 → TeO 2酸性减弱,还原性减弱,氧化性增强Se /SeO H 32ϕ= +0.74V ,所以H 2SeO 3能氧化SO 2、HI 和H 2S 等物质。

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。
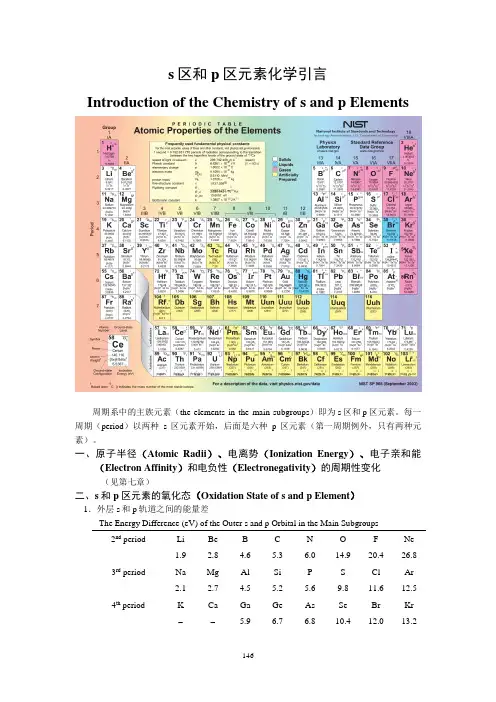
s区和p区元素化学引言Introduction of the Chemistry of s and p Elements周期系中的主族元素(the elements in the main subgroups)即为s区和p区元素。
每一周期(period)以两种s区元素开始,后面是六种p区元素(第一周期例外,只有两种元素)。
一、原子半径(Atomic Radii)、电离势(Ionization Energy)、电子亲和能(Electron Affinity)和电负性(Electronegativity)的周期性变化(见第七章)二、s和p区元素的氧化态(Oxidation State of s and p Element)1.外层s和p轨道之间的能量差The Energy Difference (eV) of the Outer s and p Orbital in the Main Subgroups 2nd period Li Be B C N O F Ne1.92.8 4.6 5.3 6.0 14.9 20.4 26.83rd period Na Mg Al Si P S Cl Ar2.1 2.7 4.5 5.2 5.6 9.8 11.6 12.54th period K Ca Ga Ge As Se Br Kr-- 5.9 6.7 6.8 10.4 12.0 13.25th periodIn Sn Sb Te I Xe 5.2 5.8 6.6 8.8 10.1 - 6th periodTl Pb Bi Po At Rn(7)(9)(10)(12)(16)-(1) 同一周期元素的最高氧化态的稳定性从左到右降低,这是由于s 和p 轨道之间的能级差增大,因此失去n s 2电子的机会减少,例如第三周期:ΔE 3s ~3p :Si(5.2eV),P(5.6eV),S(9.8eV),Cl(11.6eV)∴ ----4243444ClO SO O P SiO 、、、的稳定性从左到右降低(2) ΔE 3s ~3p <ΔE 4s ~4p >ΔE 5s ~5p 可以解释实验上发现如下稳定性序列:PCl 5>AsCl 5<SbCl 5,SF 6>SeF 6<TeF 6,-4ClO >-4BrO <-4IO(3) ΔE 6s ~6p 的值特别大,所以6s 2电子很难参与形成化学键,这种效应称为“6s 2惰性电子对效应”(inert 6s pair effect )2.通常周期系中奇数族元素的氧化数为奇数,偶数族元素的氧化数为偶数+3+5+7+1, 1En sn pEn sn p+4+6+2, 2三、s 和p 区元素的配位数(Coordination Numbers of s and p Elements )1.Fluoro and oxy complexes of selected elements) 2nd period -24BeF-4BF4CF +4NF3rd period -36AlF -26SiF -6PF 6SF+6ClF4th period -36GaF -26GeF-6AsF6SeF2nd period -33BO-23CO -3NO3rd period -44SiO -34PO-24SO-4ClO4th period -44GeO -34AsO -24SeO -4BrO5th period-86SnO-76SbO-66TeO-56IO-46XeO主族元素从上到下,配位数增大;同种元素与不同配体配位,配体体积越小,配位数越大。

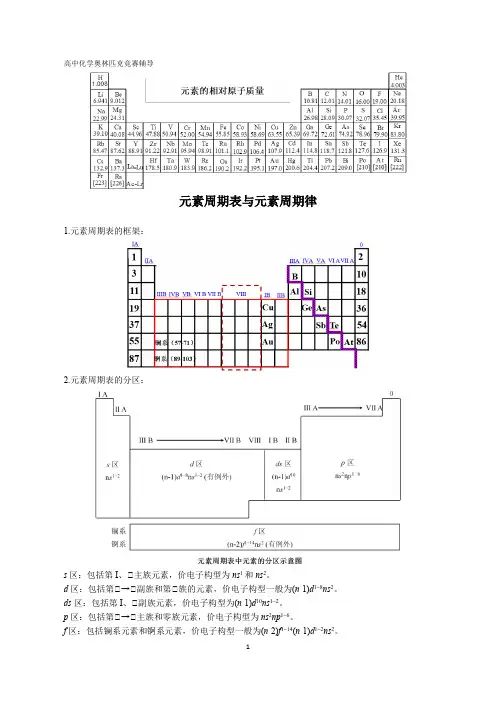
高中化学奥林匹克竞赛辅导元素周期表与元素周期律1.元素周期表的框架:2.元素周期表的分区:s区:包括第I、Ⅱ主族元素,价电子构型为ns1和ns2。
d区:包括第Ⅱ→Ⅱ副族和第Ⅱ族的元素,价电子构型一般为(n-1)d1~8ns2。
ds区:包括第I、Ⅱ副族元素,价电子构型为(n-1)d10ns1~2。
p区:包括第Ⅱ→Ⅱ主族和零族元素,价电子构型为ns2np1~6。
f区:包括镧系元素和锕系元素,价电子构型一般为(n-2)f1~14(n-1)d1~2ns2。
说明:(1)周期序数=原子的电子层数n。
第n周期含有元素的数目有以下规律:当n为偶数时,第n 周期含有元素的数目为(n+2)2/2;当n为奇数时,第n周期含有元素的数目为(n+1)2/2。
(2)主族元素的族序数=原子最外层电子数。
(3)对于d区元素,族序数=元素最高能级中的电子总数,如21Sc:[Ar]3d14s2是第Ⅱ B族,Mo:[Ar]3d64s2是第Ⅱ族。
26注意:如果元素最高能级组中的电子总数大于8,也属于第Ⅱ族,如Co、Ni等。
(4)对于ds区元素:族序数=原子最外层电子数,如29Cu:[Ar]3d104s1是第Ⅱ B族(5)d区和ds区元素均为副族元素,统称为过渡元素。
f区元素统称为内过渡元素。
3.元素周期律:原子半径、金属性、非金属性、电离能、电子亲合能、电负性。
4.原子半径:原子核的周围是电子云,它们是没有确定的边界的。
我们通常所说的原子半径是人为地规定的一种物理量。
原子半径可分为金属半径、共价半径、范德华半径三种。
共价半径是元素的两个原子以共价单键相连时,核间距离的一半。
稀有气体元素一般不能形成共价单键,所以用稀有气体分子晶体中两个原子距离的一半作为其半径,称为范德华半径。
范德华力不能像共价键一样将两个原子紧密结合,所以范德华半径大于共价半径,因此由于标准的不同,稀有气体的原子半径在同一周期的元素中半径是最大的。
金属单质的晶体中,相邻两金属原子核间距离的一半,称为该金属原子的金属半径。

§13-2 磷及其化合物Phosphorus and its Compounds一、General Properties: 1.磷原子的成键特征(1) 形成P 3-离子化合物 e.g. Na 3P :在水溶液中P 3-离子不存在,这是由于P 3-离子易水解:P 3- + 3H 2OPH 3 + 3OH -,P 3-离子有较大的半径,易变形,另外P 3-的电荷高,附加极化作用强,所以只存在为数极少的离子化合物,许多磷化物都向共价型过渡。
(2) 中心原子(P )可采取sp 3、sp 3d 、sp 3d 2杂化,可形成-3、+1、+3、+5氧化数的化合物,P 原子的最大配位数达到6。
(3) 磷的性质与氮有很大的差别主要是由于磷原子有3d 轨道。
例如NF 3不水解,而PF 3水解,NF 3不与过渡金属形成配合物,而PF 3可以与许多过渡元素形成配合物。
解释:除了都能形成σ配键外,P 还有空的3d 空轨道,可以接受过渡金属反馈回来的电子对,形成反馈π键,所以配位能力加强。
2.存在:在自然界以磷灰石,磷钙石(phosphorite):Ca 3(PO 4)2,氟磷灰石(fluorapatite):Ca 5(PO 4)3F ,羟基磷灰石(hydroxypatite):Ca 5(PO 4)3(OH)存在。
磷是动物体中的重要成份,骨头中Ca 5(PO 4)3(OH)形成矿物质部分,牙齿中含有Ca 5(PO 4)3F ,大脑和神经细胞中含有复杂的有机磷的衍生物,所以磷是动物体中的重要成份。
二、Simple Substance1.Allotropes : white 、red and black phosphorusP(白磷) (溶于CS 中)红磷 (不溶于CS 2中)P 4 is extremely poisonous !白磷的晶格点上是P 4分子,红磷的结构至今不清楚,有人认为红磷是P 4分子撕开一个P -P 键,把许多对成对的三角形连接起来而形成的长链状巨大分子所组成(如图)2.Properties : ( 以P 4为主 )(1) structure of P 4:Tetrahedral 键与键之间存在张力,∠PPP = 60︒,比纯p 轨道的σ键键角90°要小,P -P 键是受了应力而弯曲的键,P -P 键能很低,仅200 kJ ·mol -1,很容易受外力而张开,这说明白磷在通常情况下,非常活泼。


〔一〕主族元素及其化合物一、氢和稀有气体〔一〕氢氢位于周期表的第一周期IA族,具有最简单的原子结构。
氢在化学反响中有以下几种成键情况:1、氢原子失去1个电子成为H+。
但是除了气态的质子外,H+总是与其它的原子或分子相结合。
2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中〔除Be外〕的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键。
〔二〕稀有气体1、稀有气体的存在、性质和制备〔1〕存在:稀有气体的价电子结构称为饱和电子层结构,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
〔2〕物性:稀有气体均为单原子分子,He是所有单质中沸点最低的气体。
〔3〕制备:①空气的液化②稀有气体的别离2、稀有气体化合物〔1〕氟化物①制备:氙和氟在密闭的镍反响器中加热就可得到氙氟化物F2 + Xe〔过量〕→ XeF2 F2 + Xe〔少量〕→ XeF4 F2 + Xe〔少量〕→ XeF6②性质:〔a〕强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。
一般情况被复原为单质。
NaBrO3 + XeF2 + H2O → NaBrO4 + 2HF + Xe二、区元素〔一〕通性1、它们的价电子构型为ns1~2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2、有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3、电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
〔二〕单质1、存在:由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
如盐〔X-、CO-23、SiO-23、SO-24等〕;氧化物〔Li2O、BeO等〕2、性质:〔1〕物性:单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。
s 区和p 区元素化学引言
Introduction of the Chemistry of s and p Elements
周期系中的主族元素(the elements in the main subgroups )即为s 区和p 区元素。
每一周期(period )以两种s 区元素开始,后面是六种p 区元素(第一周期例外,只有两种元素)。
一、原子半径(Atomic Radii )、电离势(Ionization Energy )、电子亲和能
(Electron Affinity )和电负性(Electronegativity )的周期性变化 (见第七章)
二、s 和p 区元素的氧化态(Oxidation State of s and p Element ) 1.外层s 和p 轨道之间的能量差
The Energy Difference (eV) of the Outer s and p Orbital in the Main Subgroups
2nd period Li Be B C N O F Ne 1.9 2.8 4.6 5.3 6.0 14.9 20.4 26.8 3rd
period
Na Mg Al Si P S Cl Ar 2.1 2.7 4.5 5.2 5.6 9.8 11.6 12.5 4th period
K Ca Ga Ge As Se Br Kr - - 5.9 6.7 6.8 10.4 12.0 13.2 5th period
In Sn Sb Te I Xe 5.2 5.8 6.6 8.8 10.1 - 6th period
Tl Pb Bi Po At Rn
(7)
(9)
(10)
(12)
(16)
-
(1) 同一周期元素的最高氧化态的稳定性从左到右降低,这是由于s 和p 轨道
之间的能级差增大,因此失去n s 2
电子的机会减少,例如第三周期:
ΔE 3s ~3p :Si(5.2eV),P(5.6eV),S(9.8eV),Cl(11.6eV)
∴ -
---4243444ClO SO O P SiO 、、、的稳定性从左到右降低
(2) ΔE 3s ~3p <ΔE 4s ~4p >ΔE 5s ~5p 可以解释实验上发现如下稳定性序列: PCl 5>AsCl 5<SbCl 5,SF 6>SeF 6<TeF 6,-4ClO >-4BrO <-
4IO
(3) ΔE 6s ~6p 的值特别大,所以6s 2
电子很难参与形成化学键,这种效应称为
“6s 2
惰性电子对效应”(inert 6s pair effect )
2.通常周期系中奇数族元素的氧化数为奇数,偶数族元素的氧化数为偶数
+3+5+7
+1, 1E
n s
n p
E
n s
n p
+4+6
+2, 2
三、s 和p 区元素的配位数(Coordination Numbers of s and p Elements )
1.Fluoro and oxy complexes of selected elements) 2nd period
-24BeF
-4BF
4CF +4NF
3rd period -
36AlF -26SiF -6PF 6SF
+6ClF
4th period -36GaF -26GeF
-6AsF
6SeF
2nd peri od 3BO
3CO 3NO
3rd period -44SiO -34PO
-
24SO
-4ClO
4th period -44GeO -
34AsO -
24SeO -4BrO
5th period
-86SnO
-76SbO
-
66TeO
-
56IO
-
46XeO
主族元素从上到下,配位数增大;同种元素与不同配体配位,配体体积越小,配位数
越大。
2.共价化合物的分子轨道理论(The theory of molecular orbital of covalent compounds )
(1) s 、p 区元素的价轨道(valen ce orbital)是外层能级,即n s 、n p 轨道.虽然从第
三周期开始,元素有相应的n d 空轨道,但计算表明n d 轨道所处能态相当高,以致形成化学键的可能性相当小。
(2) 以SF 6为实例
2p
3p 3s σ non
σs σp
E
σp *σs
*SF 6
6F
S
Fig. 1 Energy diagram of the orbitals of the octahedral SF 6 molecule 分子轨道中SF 6十二个价电子为 (
σ
s )2
(σp )6
(σ non )4
(3) 为了解释s 、p 区元素共价化合物的性质,提出了两中心轨道和三中心轨道模型。
a .两中心两电子键(two centre two electron ):由中心原子(A )轨
道上的未成对电子与配位原子(L )轨道上的未成对电子形成。
即为电子配对法中的共价键和分子轨道中的σ键。
由分子轨道理论可知:
Fig. 2 Diagram of the molecular orbitals of a Fig. 3 Diagram of the molecular o rbitals of a
two-centre two-electron reaction three-centre four-electron interaction
b .三中心四电子键(tree centre four electrons ):是由中心原子
的一对成对电子对和二个配体(直线排列)的两个未成对电子形成的 再如:BeH 2
(a)
(b)
Fig. 4 (a) Energy diagram of the orbitals of (a) BeH 2 molecule and (b)
a scheme of their formation
BeH 2
XeF 2
F
Xe
F
+σ
non
σσ*++
+++
++
Fig. 5 Three-centre orbitals i n the XeF 2 molecule
c .三中心四电子键又称为超共价键(hypervalence bon
d )
(i) 可以解释VA → 零类主族元素形成配位化合物的结构和配位体数目,即解释配位数高于中心原子的未成对电子数。
例如ClF 3、ClF 5、XeF 2、XeF 4、XeF 6
(ii) 超共价键的形成使中心原子上的电子密度向配体上移动,电负性越
强的原子作为配体越有效。
这就解释了为什么高氧化态的氟化物、含氧化合物稳定。
(iii) 若中心原子的电离势越低,则共价键越强,即中心原子的电子密度越易
移向配体。
这就解释了为什么有SF 4、SF 6,而没有OF 4,更无OF 6;有PF 5和NF 3,而无NF 5。
d .第二周期共价键的另一个特点是形成p -p π键,但这种键不是第三
周期以及后面周期元素的特性。
这是因为随着原子序数的增加,其哑呤形的边变得更陡,使重叠几率变得更小。
由于p -p π
键稳定性不同,-
-323NO CO 、是三角形,--3444PO SiO 、是正
四面体
3.IA 和IIA 族元素主要形成离子化合物,其配位数取决于正、负离子半径比和其它一
些因素(如离子极化等),配位数高,一般为6,8。