影响化学平衡的条件(一)
- 格式:pptx
- 大小:154.76 KB
- 文档页数:16

一、教学内容:阻碍化学平稳的条件及等效平稳二、教学目标:明白得浓度、温度、压强、催化剂等对化学平稳阻碍的一样规律;把握勒沙特列原理及其应用;了解等效平稳原理;把握化学平稳图像题的解题规律和方法三、教学重点、难点:条件对化学平稳的阻碍,等效平稳原理和化学平稳图像题的解题规律四、教学过程:(一)化学平稳的移动,条件对化学平稳的阻碍及勒沙特列原理:化学平稳移动的实质是外界因素破坏了原平稳状态时v正= v逆的条件,使正、逆反应速率不再相等,然后在新的条件下达到正、逆反应速率重新相等。
也确实是说,化学平稳的移动是:平稳状态→不平稳状态→新平稳状态(1)浓度对化学平稳的阻碍:当其他条件不变时,增大反应物浓度或减小生成物浓度,平稳向正反应方向移动;增大生成物浓度或减小反应物浓度平稳向逆反应方向移动。
说明:①固体及纯液体的浓度是一定值,不因量的多少而改变,因此增加或减少固体及纯液体的量,可不能阻碍平稳状态。
②在可逆反应中,为了尽可能利用某一反应物,经常用过量的另一种物质和它作用。
③在生产中,也能够不断将生成物从反应体系中分离出来,则平稳将不断向生成产物的方向移动。
(2)压强对化学平稳的阻碍:当其他条件不变时,在有气体参加反应的平稳体系中,增大压强使平稳向气体体积缩小的方向移动;减小压强使平稳向气体体积增大的方向移动。
说明:①压强的改变对化学平稳的阻碍只针对有气体参加且气体体积在反应前后有变化的平衡体系。
关于固体或溶液间的反应,改变压强对速率和平稳没有阻碍;对反应前后气体分子总数保持不变的可逆反应,改变压强只能改变反应速率,对平稳无阻碍。
②增大压强不管平稳移动方向如何,新平稳状态里的速率一定大于原平稳状态的速率;减小压强不管平稳移动方向如何,新平稳状态里的速率一定小于原平稳状态的速率。
③在反应体系中充入与反应无关的气体时:a、在恒温恒压下,充入与反应无关的气体,容器的总压强保持不变,但平稳混合气体的分压减小,可通过降低压强平稳向体积增大的方向移动判定平稳移动方向;b在恒温恒容下,充入与反应无关的气体,容器的总压强增大,但平稳混合气体的分压保持恒定,因此,平稳不移动。

考点六十二影响化学平衡的因素聚焦与凝萃1.掌握影响化学平衡的因素;2.由图像的变化情况来判断外界条件的改变对化学平衡的影响。
解读与打通常规考点一、影响化学平衡的因素1.浓度:(1)规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动。
(2)当反应混合物中存在与其他物质不相混溶的固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或液体的量,对平衡基本无影响。
(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,v正减小,v逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
(4)这种影响常用于提高某反应物的转化率。
如催化氧化二氧化硫时,多通空气,使平衡右移,以提高二氧化硫的转化率。
2.温度:(1)规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。
3.压强:(1)规律:在有气体参加的可逆反应里,其他条件不变时,增大压强,会使平衡向着体积缩小方向移动;减小压强,会使平衡向着体积增大方向移动。
(2)压强的改变,通常是改变容器体积,或向恒容体系中加(减)气体物质等手段实现的。
压强对平衡的影响,实际上就是浓度对平衡的影响,只有当这些“改变”能改变反应物或生成物的浓度(分压)时,平衡才可能移动。
由于压强对固态、液态物质体积影响非常小,压强的改变几乎不影响这类体系的平衡。
在考虑压强对不均匀体系平衡的影响时,只须考虑对参加反应的气态物质的影响。
4.催化剂:(1)规律:由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。
但是使用催化剂可以影响可逆反应达到平衡所需的时间。
二、勒夏特列原理:已达平衡的可逆反应,如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。


化学平衡的影响因素和平衡条件化学平衡是指化学反应中反应物与生成物的浓度或者压强达到一定比例后,反应速度不再改变的状态。
在化学反应达到平衡时,反应物和生成物的浓度或者压强不再发生明显的变化。
然而,达到平衡的过程受到多种因素的影响。
本文将探讨化学平衡的影响因素和平衡条件。
一、影响化学平衡的因素1. 变量的改变改变反应物浓度、压强、温度或者添加催化剂都会影响化学平衡。
当改变反应物浓度或者压强时,根据勒夏特里亚法则(Le Chatelier's principle),系统会向反方向移动以减小这种变化。
例如,在N2(g) +3H2(g) ↔ 2NH3(g)这个反应中,如果增加N2或者减少H2的浓度,平衡会向右移动,生成更多NH3以抵消浓度变化。
2. 温度的变化温度对化学平衡的影响取决于反应是否是放热反应或吸热反应。
对于放热反应,增加温度会使平衡向左移动,减少温度则使平衡向右移动。
而对于吸热反应,增加温度会使平衡向右移动,减少温度则使平衡向左移动。
这是因为根据热力学原理,系统倾向于最小化能量变化。
3. 催化剂的作用催化剂可以加速反应速率,但不会改变化学反应的平衡位置。
催化剂通过提供新反应路径,使反应物更容易转化为生成物。
催化剂可通过减少反应活化能来降低反应的能量要求,从而加速反应。
然而,由于催化剂在反应结束时不发生净变化,所以对平衡位置没有影响。
二、达到化学平衡的条件化学平衡的条件由反应物和生成物的浓度、压强和温度决定。
1. 浓度和压强的影响化学平衡的条件要求反应物和生成物的浓度或者压强之间达到一定的比例。
在气相反应中,当反应物和生成物的压强达到一定比例时,反应物的分子碰撞会与生成物的分子碰撞相抵消,而且速度相等。
在溶液或者气体反应中,当反应物和生成物的浓度达到一定比例时,反应物和生成物的速度也会平衡,达到化学平衡。
2. 温度的影响化学平衡的条件还需满足热力学要求。
对于放热反应,提高温度会使反应向左移动,降低温度则使反应向右移动。


影响化学平衡的条件说课稿影响化学平衡的条件说课稿1一、说教材1、教材的地位和作用课题:高中化学第二册第二章第三节《影响化学平衡的条件》《影响化学平衡的条件》是中学化学的重要理论之一。
本节教材在本章中起到承上启下的作用,通过对本章的学习,既可以使学生加深对溶解平衡的化学理论的理解,又为以后学习电离平衡奠定了基础,对学生后续的学习有着深远的影响。
通过本章的学习,使学生能够进一步学习应用理论分析,研究,联系实际解决问题的能力。
2、教材简析教材分析:本节教材由三部分构成:第一部分,化学平衡移动;第二部分,影响化学平衡的条件,化学平衡移动;第三部分,勒夏特列原理。
其中第一部分是基础,第二部分是整节教材的核心,第三部分是对本节课的总结和升华。
3、教学目标的确定根据《大纲》的要求、教材编排意图及学生的实际情况,拟定以下教学目标:认知目标――理解掌握浓度、压强、温度等外界条件对化学平衡的影响。
技能目标――通过本节课的教学,培养学生分析问题,解决问题,创造性思维的能力和自学能力。
素质教育目标――对学生进行辩证唯物主义教育,培养学生热爱科学、勇于探索的精神。
4、重点及难点的确定重点:浓度,压强,温度对化学平衡的影响难点:1、平衡移动原理的应用。
2、平衡移动过程的速率――时间图。
确立依据:对化学平衡移动原理的学习很重要,所以讨论“浓度,压强,温度等条件对化学平衡的影响”成为本节课的重点。
由于理论付诸实践有一定的难度,因此平衡移动原理的利用和移动过程中的速率――时间图成为本节的难点。
二、高学情分析二学生已经具备独立思考问题能力,而且思维活跃,掌握了影响化学反应速率的理论,以此为契机在教学中变探究为验证,激发学生学习的主动性,并培养学生严谨求实的科学态度。
三、说教法由于本节教材地位的重要性,结合学生实际情况,采取以下教学方法:1、通过演示实验,启发学生总结,归纳出浓度,压强,温度等条件改变对化学平衡影响。
2、通过对外界条件对速率影响理论复习,采取启发式教学,使学生从理论上认识平衡移动规律。

《影响化学平衡的条件》教学设计教学设计题目:《影响化学平衡的条件》一、教学目标:1.知识与技能目标:(1)理解化学平衡的概念;(2)能够描述平衡常数的意义与计算方法;(3)理解温度、浓度和压力对化学平衡的影响。
2.过程与方法目标:(1)通过实验,观察不同条件对化学平衡的影响;(2)运用实验结果与理论知识,探究化学平衡条件的规律;(3)培养学生的实验操作能力和科学探究能力。
3.情感目标:(1)培养学生的观察力和动手能力,培养学生对科学实验的兴趣;(2)培养学生合作学习和团队合作精神,提高解决问题的能力。
二、教学重点与难点:1.教学重点:(1)理解化学平衡的概念;(2)掌握平衡常数的计算方法;(3)理解温度、浓度和压力对化学平衡的影响。
2.教学难点:(1)理解平衡常数的意义与计算方法;(2)理解温度、浓度和压力对化学平衡的影响。
三、教学过程:1.导入(15分钟):(1)通过展示一些常见的化学反应方程,引导学生回顾反应的平衡状态;(2)提问引导学生思考:什么是化学平衡?反应在什么条件下达到平衡?2.知识授课(30分钟):(1)向学生介绍平衡常数的概念,并从理论角度解释其意义;(2)介绍平衡常数的计算方法,并通过例题让学生掌握计算方法;(3)解释温度、浓度和压力对化学平衡的影响,并结合例子进行讲解。
3.实验操作(60分钟):(1)分成小组进行实验,每个小组选择不同条件下的化学反应进行观察;(2)学生根据实验结果,记录下反应物浓度和反应物比例关系,并进行分析与比较;(3)学生讨论不同条件下化学平衡的变化规律,并总结影响化学平衡的条件。
4.实验报告与讨论(30分钟):(1)每个小组汇总实验结果,进行实验报告;(2)全班学生进行讨论,总结影响化学平衡的条件和规律;(3)教师进行总结,帮助学生理解并巩固所学知识。
5.总结与拓展(15分钟):(1)教师进行知识梳理,总结本课所学内容;(2)提醒学生进行课后拓展学习,通过阅读相关资料深化对化学平衡条件的理解。


化学平衡条件(一)化学平衡条件什么是化学平衡?化学平衡是指在封闭容器中,反应物与生成物浓度达到一定比例,反应速度相等的状态。
在化学平衡状态下,反应物形成与分解的速度相等,整个系统保持稳定。
反应物和生成物的浓度比化学平衡的一个关键特征是反应物与生成物的浓度比。
当达到平衡时,反应物和生成物的浓度比保持不变。
在平衡点附近,化学反应遵循勒沃厄定律。
根据勒沃厄定律的表达式,反应物和生成物的浓度比与各自的反应系数有关。
影响化学平衡的因素化学平衡的位置受到多种因素的影响。
以下是一些常见的影响因素:•温度:改变温度会改变反应物和生成物的浓度,从而影响平衡的位置。
•压力:对于气相反应,改变压力会改变气体浓度,从而影响平衡。
•浓度:改变反应物和生成物的浓度会改变平衡位置。
•催化剂:催化剂可以影响反应速率,但不会改变平衡位置。
正向与逆向反应在化学平衡中,正向反应和逆向反应同时发生。
正向反应是指反应物转化为生成物的过程,而逆向反应是指生成物转化为反应物的过程。
正向反应:反应物→ 生成物逆向反应:生成物→ 反应物两个反应同时进行,直到达到平衡状态。
平衡常数和平衡表达式平衡常数是用于描述平衡系统中反应物和生成物浓度比例的数值常数。
平衡常数由平衡表达式得出。
平衡表达式可以通过平衡反应方程式得出。
对于一般的反应方程式:aA + bB → cC + dD平衡表达式的一般形式为:[C]^c [D]^d / [A]^a [B]^b方括号表示物质的浓度,上标表示物质的系数。
小结化学平衡是指反应物和生成物浓度达到一定比例,反应速度相等的状态。
平衡的位置受到温度、压力、浓度和催化剂等因素的影响。
平衡常数和平衡表达式用于描述平衡系统中反应物和生成物浓度比例的数值常数。
•在达到平衡的过程中,正向反应和逆向反应同时进行,直到反应速度相等,形成稳定的平衡态。
•温度是影响平衡的重要因素之一。
根据勒沃厄定律,在温度升高时,反应物的浓度增加,而在温度降低时,反应物的浓度减少,从而影响平衡位置。

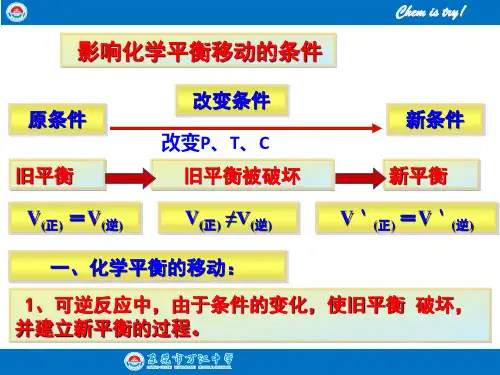
1.化学平衡移动可逆反应的平衡状态是在一定条件下(浓度、温度、压强)建立起来的,当条件发生改变时,原平衡状态被破坏,并在新条件下建立起新的平衡。
此过程可表示为:(1)化学平衡移动:可逆反应中就化学平衡的破坏、新化学平衡的建立的过程。
(2)化学平衡移动的原因:反应条件的改变,移动的结果是正逆反应速率发生变化,平衡混合物中各组分的含量发生相应的变化。
(3)化学平衡移动的特征:○1从反应速率来看:若有v正=v逆到v正≠v逆某条件下平衡,再到这样的过程表明化学平衡发生了移动。
○2从混合物组成来看:各组分的含量从保持一定到条件改变时含量发生变化,最后在新条件下保持新的一定,同样表明化学平衡发生了移动。
(4)化学平衡移动的方向:○1若外界条件改变,引起v正>v逆时,正反应占优势,化学平衡向正反应方向移动。
○2若外界条件改变,引起v正<v逆时,逆反应占优势,化学平衡向逆反应方向移动。
○3若外界条件改变,引起v正和v逆都发生变化,如果v正和v逆能保持相等,化学平衡就没有发生移动。
2.影响化学平衡的条件参加反应的物质的性质是影响化学平衡的内在因素,影响化学平衡的外界条件主要有浓度、压强和温度等。
外界条件的改变对化学平衡的影响实质上是通过改变正、逆反应速率来实现的。
(1)浓度对化学平衡的影响○1结论:在其他条件不变的情况下,增大反应物浓度或减少生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物浓度或减少反应物的浓度,都可以使化学平衡向逆反应方向移动。
2增大反应物浓度增大生成物浓度减小反应物浓度减小生成物浓度a.由于增加固体或纯液体的浓度是常数,改变固体或纯液体的量并不影响v正、v逆的大小,所以化学平衡不移动。
b.在溶液中进行的反应,如果稀释溶液,反应浓度减小,生成物浓度也减小,v正、v逆的量减小,但减小的程度不同,总的结果使化学平衡向反应方程式中化学计量增大的方向移动。
c.在生产中适当增大廉价的反应物浓度,使化学反应向正反应方向移动,可提高价格较高原料的转化率,以降低生产成本。
影响化学平衡的三个因素1.浓度(1)可能影响化学反应速率和平衡移动的是浓度而不是质量、物质的量、体积。
若质量、物质的量、体积等的改变不能使浓度改变,则化学反应速率和平衡不改变。
(2)对于溶液中进行的离子反应,改变不参与反应的离子的浓度,速率和平衡一般不移动,如FeCl3+3KSCN≒Fe(SCN)3+3KCl,增加c(K+)或c(Cl-),不会影响化学反应速率和平衡。
(3)浓度的变化一定会带来反应速率的变化,但不一定导致化学平衡的移动。
如同等程度地增大反应各物质浓度,平衡向反应前后气体化学计量数之和减少的方向移动:同等程度地减少反应各物质浓度,平衡向反应前后气体化学计量数之和增大的方向移动;但对于反应前后气体化学计量数之和相等的反应,同等程度地改变反应各物质的浓度,平衡不移动。
(4)浓度改变瞬间时的正(逆)反应速率与反应物(生成物)浓度的变化成同一趋势,与生成物(反应物)浓度变化无关。
经常可以先判断平衡移动的方向,再由此判断外界条件改变瞬间,正、逆反应速率的相对大小。
(5)温度一定时,固体、纯液体的浓度一般认为是一常数,所以,改变固体、纯液体的量,其浓度仍不变,化学反应速率和平衡无影响;但改变固体的表面积(如“块状粉末状”),化学反应速率会增大或减小。
(6)H2O作为纯液体,虽然它的浓度为一常数(液态时),但对于在溶液中发生的反应,改变H2O的量往往会导致其他物质的浓度增大或减少,从而引起化学反应速率和平衡的移动,如Al3++3H2O ≒Al(OH)3+3H+,加水,其他反应物和生成物的浓度下降。
使υ正、υ逆均下降且平衡右移;另外,H2O作溶质,其他物质作溶剂进行的化学反应,此时H2O的浓度不再是一常数,改变H2O的量,会引起H2O 的浓度改变从而影响速率和平衡;最后注意水蒸气参加的反应,它的浓度亦不是一常数;可能随外界条件的改变而改变。
2.压强(1)只有压强的变化能引起反应物质的浓度改变时,平衡才有可能移动。
30化学平衡的影响的条件一、化学平衡移动1、概念:一定条件下,某可逆反应达平衡后,当改变某条件〔浓度、温度、压强〕,平衡混合物各组分的浓度也就随之改变,因而在新的条件下达到新的平衡。
这种由于条件的改变而使旧的平衡破坏和在新的条件下达到新的平衡的过程叫做化学平衡移动。
2、外界原因:改变了条件3、本质原因:V正≠V逆4、移动方向判断的依据:勒夏特列原理。
二、影响化学平衡的条件:勒夏特列原理如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向着能够减弱这种改变的方向移动。
改变影响平衡的一个条件化学平衡移动方向化学平衡移动结果增大反应物浓度向正反应方向移动反应物浓度减小减小反应物浓度向逆反应方向移动反应物浓度增大增大生成物浓度向逆反应方向移动生成物浓度减小减小生成物浓度向正反应方向移动生成物浓度增大增大体系压强向气体体积减小的反应方向移动体系压强减小减小体系压强向气体体积增大的反应方向移动体系压强增大升高温度向吸热反应方向移动体系温度降低降低温度向放热反应方向移动体系温度升高注意:①、固体、纯液体的浓度当作一个不变的量,所以增加固体或纯液体并不能改变浓度。
在实际生产中,往往采用增大易取得的或成本较低的物质的方法,使平衡正向移动,同时提高成本较高的原料的利用率〔转化率〕。
②、压强——要有气态物质存在,改变压强(使容器内气体的浓度发生改变),才可能使平衡移动。
A、充入与反应无关的气体如稀有气体要分析容器是恒容(不移)、还是恒压(向扩体方向移);反应式左右两边气体化学计量数和不变(无论上述那种均不变)B、颜色的改变要注意是一个动态变化的过程,先变?后变?C、平衡不移动,并不表示颜色不会变,因为颜色深浅决定于有色物质的浓度。
如:2NO2 N2O4(红棕色) 〔无色〕增大压强,颜色先深后浅;减小压强,颜色先浅后深。
③、温度——所有化学反应均具有能量变化,温度改变,化学平衡一定移动。
④、催化剂——只改变反应速率,而平衡不移动。