影响化学平衡的条件图像
- 格式:ppt
- 大小:585.50 KB
- 文档页数:14
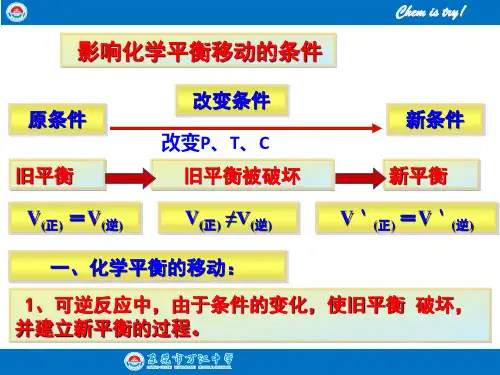



影响化学平衡的条件1、浓度对化学平衡的影响规律:当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向____反应方向移动;增大生成物浓度或减小反应物浓度,化学平衡向_____反应方向移动。
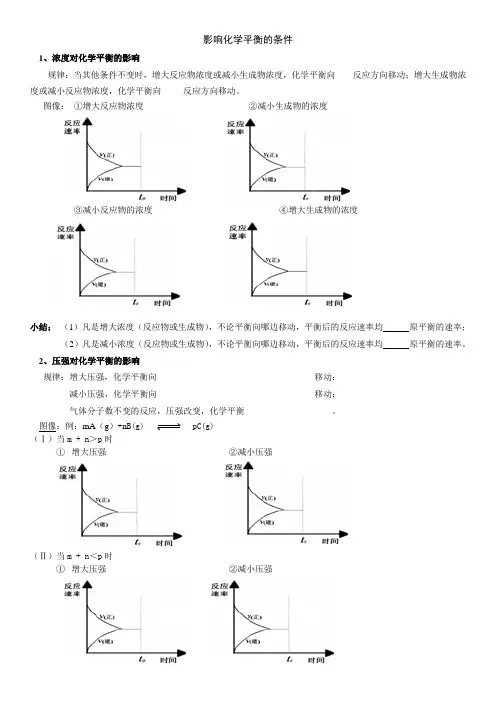
图像:①增大反应物浓度②减小生成物的浓度③减小反应物的浓度④增大生成物的浓度小结:(1)凡是增大浓度(反应物或生成物),不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是减小浓度(反应物或生成物),不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。
2、压强对化学平衡的影响规律:增大压强,化学平衡向____________________________________移动;减小压强,化学平衡向____________________________________移动;气体分子数不变的反应,压强改变,化学平衡____________________。
图像:例:mA(g)+n B(g) pC(g)(Ⅰ)当m + n>p时①增大压强②减小压强(Ⅱ)当m + n<p时①增大压强②减小压强(Ⅲ)当m + n=p时①增大压强②减小压强小结:压强变化直接导致变化。
(1)凡是增大压强,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是减小压强,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。
3、温度对化学平衡的影响规律:升高温度平衡向方向移动,降低温度平衡向方向移动。
A(g)+B(g) C(g)△H >0①升高温度②降低温度图像:A(g)+B(g) C(g)△H <0①升高温度②降低温度图像:小结:(1)凡是升高温度,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是降低温度,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。

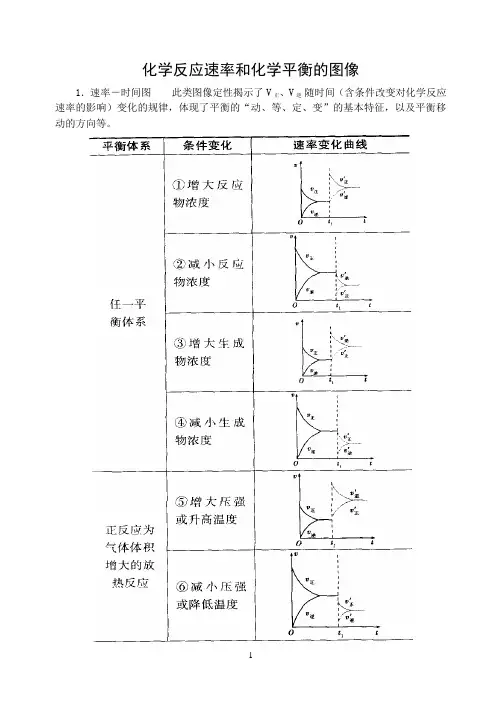
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。




化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。