RealTimeRTPCR常见问题分析
- 格式:doc
- 大小:229.50 KB
- 文档页数:5

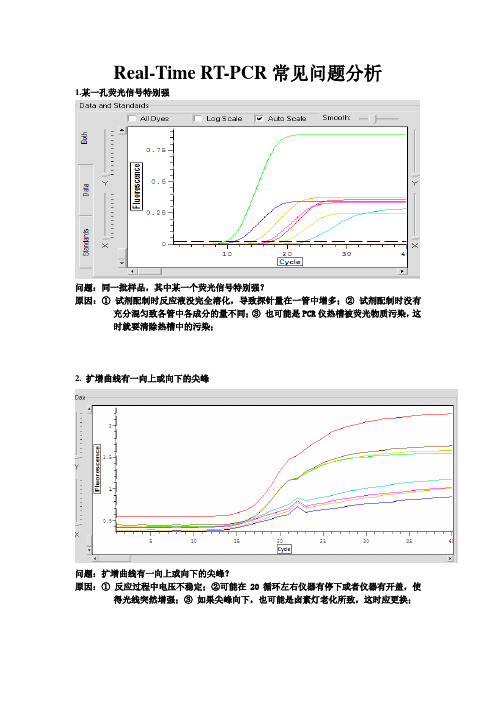
Real-Time RT-PCR常见问题分析1.某一孔荧光信号特别强问题:同一批样品,其中某一个荧光信号特别强?原因:①试剂配制时反应液没完全溶化,导致探针量在一管中增多;②试剂配制时没有充分混匀致各管中各成分的量不同;③也可能是PCR仪热槽被荧光物质污染,这时就要清除热槽中的污染;2. 扩增曲线有一向上或向下的尖峰问题:扩增曲线有一向上或向下的尖峰?原因:①反应过程中电压不稳定;②可能在20循环左右仪器有停下或者仪器有开盖,使得光线突然增强;③如果尖峰向下,也可能是卤素灯老化所致,这时应更换;3. 部分样本扩增效率过低问题:部分样本扩增效率过低?原因:①提取液残留,一定程度抑制了PCR反应;②反应液未严格取量混匀或分装不均匀;③试剂失效;4.阴性对照或空白对照翘尾,可能原因:1、模板提取环境有污染。
2、模板提取操作有污染。
3、配液过程存在污染。
问题:阴性对照或空白对照翘尾?原因:①模板提取环境有污染;②模板提取操作有污染;③试剂配制过程存在污染;5. 直线型扩增曲线问题:直线型扩增曲线?原因:①探针部分降解(探针降解原因:a.探针反复冻融――稀释的探针可在4℃保存至少3个月,应避免反复冻融;b.探针在光线下暴露时间太长);②反应液中有PCR抑制物;6.没有扩增曲线问题:没有扩增曲线?原因:①PCR参数设置错误,在设计循环参数时将荧光信号读取时间设在反应的第一步,即stage 1阶段;②电脑设定了自动休眠;7.基线下滑问题:扩增曲线有一个下滑阶段?原因:基线选取范围不对,可试着将基线范围改大一些,这一问题常因试剂质量所致;8.扩增曲线断裂问题:扩增曲线断裂?原因:基线选取范围不对,基线终点大于Ct值,这通常是由于模板DNA浓度过高所致,因Ct值<15,而基线范围仍取3-15,其中包含部分扩增信号,导致标准差偏大,阈值过高,解决办法:减少基线终点至Ct值前4个循环,重新分析数据9.样品浓度跨度过大样品浓度过高,至阳性样品扩增曲线在后面循环中呈一向下的直线,原因及解决办法同“扩增曲线断裂”。

.PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低.6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。


PCR实验常见问题、原因分析及其解决方案!PCR产物的电泳检测时间,一般为48h以内,有些最好于当日进行检查,大于48h后带型不规章甚至消逝。
但有时仍会与到这样那样的问题,影响检测结果的推断,详细归类为以下常见的4点,描述如下:问题一:无扩增产物现象:正对比有条带,而样品则无。
缘由:1、模板:含有抑制物,含量低。
2、Buffer对样品不合适。
3、引物设计不当或者发生降解。
4、反应条件:退火温度太高,延长时间太短。
对策:1、纯化模板或者使用试剂盒提取模板DNA或加大模板的用量。
2、更换Buffer或调整浓度。
3、重新设计引物(避开链间二聚体和链内二级结构)或者换一管新引物。
4、降低退火温度、延长延长时间。
问题二:非特异性扩增现象:条带与估计的大小不全都或者非特异性扩增带。
缘由:1、引物特异性差。
2、模板或引物浓度过高。
3、酶量过多。
4、Mg2+浓度偏高。
5、退火温度偏低。
6、循环次数过多。
对策:1、重新设计引物或者使用巢式PCR。
2、适当降低模板或引物浓度。
3、适当削减酶量。
4、降低镁离子浓度。
5、适当提高退火温度或使用二阶段温度法。
6、削减循环次数。
问题三:拖尾现象:产物在凝胶上呈Smear状态。
缘由:1、模板不纯。
2、Buffer不合适。
3、退火温度偏低。
4、酶量过多。
5、dNTP、Mg 2+浓度偏高。
6、循环次数过多。
对策:1、纯化模板。
2、更换Buffer。
3、适当提高退火温度。
4、适量用酶。
5、适当降低dNTP和镁离子的浓度。
6、削减循环次数。
问题四:假阳性现象:空白对比消失目的扩增产物。
缘由:靶序列或扩增产物的交叉污染。
对策:1、操作时应当心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
2、除酶及不能耐高温的物质外,全部试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3、各种试剂最好先进行分装,然后低温贮存。
RT-PCR中可能遇到的问题及处理方法摘要:本文就在RT-PCR实验中可能遇到的,包括在琼脂糖凝胶电泳分析中看到少量或没有RT-PCR产物、在琼脂糖凝胶分析中看到非预期条带、多聚糖同RNA共沉淀、cDNA第一链合成错误或数量少、RNA二级结构太多等问题进行分析,并提出了相应的可能的处理方法。
RT-PCR 为反转录RCR(reverse transcription PCR)和实时PCR(real time PCR)共同的缩写。
逆转录PCR,或者称反转录PCR(reverse transcription-PCR, RT-PCR),是聚合酶链式反应(PCR)的一种广泛应用的变形。
由一条RNA单链转录为互补DNA(cDNA)称作“逆转录”,由依赖RNA的DNA聚合酶(逆转录酶)来完成。
随后,DNA的另一条链通过脱氧核苷酸引物和依赖DNA的DNA聚合酶完成,随每个循环倍增,即通常的PCR。
原先的RNA模板被RNA酶 H降解,留下互补DNA。
RT-PCR的指数扩增是一种很灵敏的技术,可以检测很低拷贝数的RNA。
RT-PCR广泛应用于遗传病的诊断,并且可以用于定量监测某种RNA的含量。
RT-PCR的关键步骤在是RNA 的反转录,要求RNA模版为完整的且不含DNA、蛋白质等杂质。
1 材料与方法1.1材料1.1.1 RT-PCR技术相关试试剂:oligo: 多聚体,相当于mRNA引物AMV RT:禽类成髓细胞瘤病毒逆转录酶MMLV RT:莫洛尼鼠白血病病毒逆转录酶dNTPs:脱氧核苷酸RNase:RNA酶抑制剂PCR Buffer:RT-PCR缓冲液MgCl2:2价镁离子1.2 方法1.2.1 RNA提取组织剪碎加入1ml Trizol,冰上匀浆(边匀浆边暂停)。
转入一新EP管中(1.5ml),室温保存5min。
加氯仿0.2ml,振荡混合(手摇剧烈),室温放置5min。
10000 rpm 4℃离心15min。
转移上层水相(吸70%)到一新EP管中,加异丙醇0.5ml,振荡混合,室温保存10min。
RT-PCR常见问题什么是RT-PCR?RT-PCR全称为反转录聚合酶链式反应(Reverse Transcription Polymerase Chain Reaction),是一种常用的分子生物学技术。
它通过先将RNA转录成cDNA,再进行聚合酶链式反应来扩增目标DNA序列,从而便于对目标基因的定性和定量分析。
RT-PCR的原理是什么?RT-PCR的基本原理是先通过逆转录酶(Reverse Transcriptase)将RNA转录成互补的cDNA,然后利用聚合酶链式反应(Polymerase Chain Reaction)对cDNA进行扩增。
逆转录酶根据RNA模板合成cDNA,聚合酶负责在不断升高的温度下合成新的DNA链。
RT-PCR常见的应用有哪些?RT-PCR技术在许多领域得到广泛应用,主要用于以下方面:1.基因表达分析:通过检测转录产物的浓度,了解特定基因在不同生理状态下的表达水平。
2.病原微生物检测:对病原微生物的核酸进行扩增和检测,用于诊断和监测传染病。
3.肿瘤检测和诊断:检测癌细胞中特定基因的表达水平,以辅助肿瘤的早期诊断和治疗选择。
4.病毒感染检测:通过检测病毒基因组的存在和复制水平,帮助诊断病毒感染。
5.遗传病诊断:通过检测患者DNA中的突变位点,早期发现和预防遗传病。
RT-PCR实验中常见的问题有哪些?在进行RT-PCR实验时,常见的问题包括:1.污染:实验室环境和试剂可能导致样品污染,影响实验结果。
因此,严格控制实验条件和采取相应的质量控制措施非常重要。
2.物质稀释和浓度计算:正确计算样品和试剂的稀释倍数以及逆转录反应液和扩增反应液的浓度对于得到准确结果至关重要。
3.阴性对照:包括模板对照和水对照,用于检测反应物的特异性和检测污染。
如果阴性对照出现阳性结果,可能是污染导致的。
4.温度控制:在逆转录和扩增过程中,保持恒定的温度是非常重要的。
温度的变化可能导致逆转录或扩增效率低下或产生非特异性产物。
PCR 常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 2009-03-28 11:38问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear 状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR 引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA 序列的保守区是通过物种间相似序列的比较确定的。
在NCBI 上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30 碱基之间。
Real-Time RT-PCR常见问题分析
1.某一孔荧光信号特别强
问题:同一批样品,其中某一个荧光信号特别强?
原因:①试剂配制时反应液没完全溶化,导致探针量在一管中增多;②试剂配制时没有充分混匀致各管中各成分的量不同;③也可能是PCR仪热槽被荧光物质污染,这
时就要清除热槽中的污染;
2. 扩增曲线有一向上或向下的尖峰
问题:扩增曲线有一向上或向下的尖峰?
原因:①反应过程中电压不稳定;②可能在20循环左右仪器有停下或者仪器有开盖,使得光线突然增强;③如果尖峰向下,也可能是卤素灯老化所致,这时应更换;
3. 部分样本扩增效率过低
问题:部分样本扩增效率过低?
原因:①提取液残留,一定程度抑制了PCR反应;②反应液未严格取量混匀或分装不均匀;③试剂失效;
4.阴性对照或空白对照翘尾,可能原因:1、模板提取环境有污染。
2、模板提取操作有
污染。
3、配液过程存在污染。
问题:阴性对照或空白对照翘尾?
原因:①模板提取环境有污染;②模板提取操作有污染;③试剂配制过程存在污染;
5. 直线型扩增曲线
问题:直线型扩增曲线?
原因:①探针部分降解(探针降解原因:a.探针反复冻融――稀释的探针可在4℃保存至少3个月,应避免反复冻融;b.探针在光线下暴露时间太长);②反应液中有PCR抑
制物;
6.没有扩增曲线
问题:没有扩增曲线?
原因:①PCR参数设置错误,在设计循环参数时将荧光信号读取时间设在反应的第一步,即stage 1阶段;②电脑设定了自动休眠;
7.基线下滑
问题:扩增曲线有一个下滑阶段?
原因:基线选取范围不对,可试着将基线范围改大一些,这一问题常因试剂质量所致;8.扩增曲线断裂
问题:扩增曲线断裂?
原因:基线选取范围不对,基线终点大于Ct值,这通常是由于模板DNA浓度过高所致,因Ct值<15,而基线范围仍取3-15,其中包含部分扩增信号,导致标准差偏大,
阈值过高,解决办法:减少基线终点至Ct值前4个循环,重新分析数据
9.样品浓度跨度过大
样品浓度过高,至阳性样品扩增曲线在后面循环中呈一向下的直线,原因及解决办法同“扩增曲线断裂”。
10.山坡形曲线
问题:山坡形曲线?
原因:常因反应管封口不严,至反应液蒸发所致。