PCR常见问题分析及解决策略
- 格式:ppt
- 大小:621.50 KB
- 文档页数:27


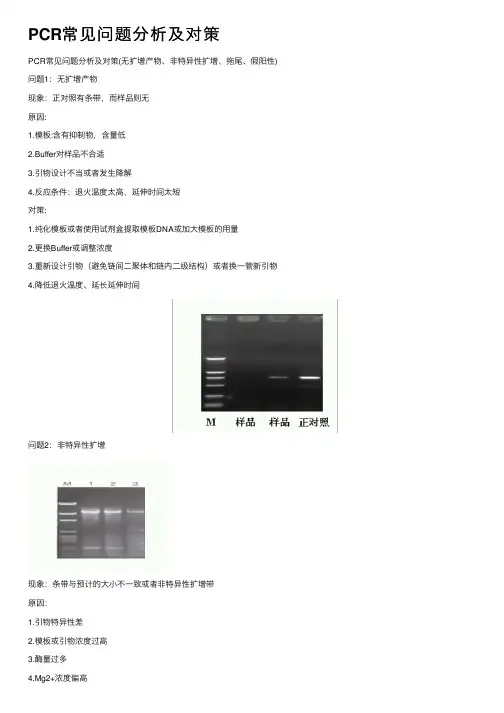
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)2009-03-28 11:38问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因: 1.引物特异性差 2.模板或引物浓度过高 3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR 2.适当降低模板或引物浓度 3.适当减少酶量 4.降低镁离子浓度 5.适当提高退火温度或使用二阶段温度法 6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因: 1.模板不纯 2.Buffer不合适 3.退火温度偏低 4.酶量过多 5.dNTP、Mg 2+浓度偏高 6.循环次数过多对策: 1.纯化模板 2.更换Buffer 3.适当提高退火温度 4.适量用酶 5.适当降低dNTP和镁离子的浓度 6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策: 1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外; 2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen) 1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI 上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区 2.引物长度一般在15~30碱基之间。

PCR问题总汇及详细解决方案
PCR的影响因素很多的,尤其试剂的保存,人为的因素都很重要: 看看试剂是否有过期或保存不当,可能出现部分变质所以P不出来,换新的试剂看看
人为也很重要,冰上操作的时间,步骤等对P的效果很有影响,可找实验经验好点的人再试一试.
如果是怀疑仪器方面的问题,我觉得也有可能,可以去别的试验室借PCR仪看看是否能行.
别用自己的胶检测,用别人的胶检测试试,以前我P的很好,但是胶有问题老是扩散,后来用别人的胶试了试,非常赞.
本文针对PCR产物序列中引入了错误怎么办?PCR扩增有时出现涂抹带或片状带或地毯样带?如果没有回收到目的片段,还需要作什么对照实验?或者同时出现特异性扩增带与非特异性扩增带?对照实验结果好,却没有回收到目的片段,实验出了什么问题?
PCR体系是10ul的,每次PCR完了以后,管壁上有一层水气,需不需要覆盖矿务油?加多少,具体步骤应怎样?
PCR加样孔上有很亮的条带,但没有产物条带?
PCR的产量有许多因素决定他们的主次关系是什么,各因素又是怎么调节的?
PCR产物大约有900bP,哪种测序方法比较好?直接用纯化的PCR产物测序还是克隆到T载体上再测序?纯化PCR产物的方法哪种比较好?
引物间形成了比较多的二聚体,使产物很少。
这种情况该怎么处理?
为什么会产生弥散(smear)条带?如何解决?。

PCR反应常见问题汇总(转自tiangen)----PCR常见问题分析及对策1.PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
2.假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR 循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD 值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。

PCR技术之——常见问题解析及处理方法我们进行核酸扩增时,往往会不定的出现一些异常问题,本期我给大家搜集了一些平时经常性遇到的一些问题,希望对大家有所帮助。
(一)相对特异性 PCR产物的特异性主要取决于引物链的特异性。
由于存在同源序列,随意设计的引物链,其PCR产物在电泳分析时可能出现多条链,因此在设计引物链时应考虑其绝对特异性和相对特异性。
前者指两条引物链的核苷酸序列只与靶DNA片段互补,后者是指两条引物链的核苷酸序列及两者之间的DNA长度对靶DNA片段是特异的,但亦可与其他区域的DNA片段互补,而其PCR产物的长度与靶DNA片段的扩增产物的长度明显不同,应根据两引物问的DNA片段长度,预计PCR产物的大小,并与电泳分析的DNA片段大小比较.或用寡聚核苷酸限制性内切酶片段分析,或用分子杂交、核苷酸序列分析来测定。
(二)标本中存在的有形成分对反应的抑制这一点主要是针对来自临床标本中的杂质加细菌蛋白质和Taq DNA聚合酶抑制因子,须注意避免污染和去除标本中的杂质;将标本加热煮沸使抑制因子与DNA分离。
对于来自标本中的细胞和细胞器的崩解、核酸酶的激活均可使待检的DNA降解,降解的DNA是Taq DNA聚合酶作用良好底物,能与靶DNA竞争,从而扩增大量的非特异性DNA,这种非特异性DNA会使背景干扰超过了前景信号影响PCR循环扩增效率,减少特异性DNA扩增产量。
(三)Taq DNA聚合酶 Taq DNA聚合酶扩增的特异性受PCR循环次数及延伸时间与温度的影响循环次数太多使延伸时间延长和Taq DNA聚合酶单位用量增长可能导致非特异性扩增;循环次数太少,则不能得到充足的扩增产物,温度不适宜会影响扩增产物数量,延伸温度一般高于复性温度。
(四)复性温度与时间引物与变性DNA的复性温度对PCR 的特异性有影响,复性温度由引物的碱基成分决定。
在低温度(37℃)下复性可出现比扩增DNA长的非特异性扩增带;而在55~60℃复性的扩增带一般是特异的,复性时间过长或过短都会增加非特异性扩增。

.PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低.6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。

P C R检测常见问题与解决途径------------------------------------------作者xxxx------------------------------------------日期xxxxPCR检测常见问题与解决途径利用PCR方法检测转基因成分时,经常出现假阳性、假阴性、非特异性扩增和涂抹带。
尤其是假阳性和假阴性可使检测结果得出错误结论,有时可造成严重后果。
为了提高转基因检测的准确性和可靠性,PCR检测应尽量减少假阳性、假阴性、非特异性扩增和涂抹带现象的发生。
一个好的PCR方法不但要求特异性好、灵敏度高、还要求具有高的可重复性、重现性、鲁棒性,尽量减少假阳性、假阴性和非特异性扩增。
本文对PCR检测中出现的假阳性、假阴性、非特异性扩增和涂抹带的原因及其解决方法予以综述。
一、假阳性:(一)假阳性现象假阳性是指检测阴性材料得到阳性结果。
如果一次实验中的几个阴性对照中出现一个或几个阳性结果,提示本次实验中其它标本的检测结果可能有假阳性。
实验中设立的阴性对照可提示有无假阳性结果出现。
(二)造成假阳性的原因1. 样品间交叉污染:样本污染主要有收集样本的容器被污染,或样本放置时,由于密封不严溢于容器外,或容器外粘有样本而造成相互间交叉污染;样本核酸模板在提取过程中,由于吸样枪污染导致标本间污染;2. PCR试剂的污染:主要是由于在PCR试剂配制过程中,由于加样枪、容器、双蒸水及其它溶液被PCR核酸模板污染。
3. PCR扩增产物污染:这是PCR反应中最主要最常见的污染问题。
因为PCR产物拷贝量大(一般为1013拷贝/ml),远远高于PCR检测数个拷贝的极限,所以极微量的PCR产物污染,就可形成假阳性。
4. 气溶胶污染:在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染。
据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个值得特别重视的问题。

PCR常见问题分析及计谋(无扩增产物、非特异性扩增、拖尾、假阳性)2009-03-28 11:38问题1:无扩增产物现象:正对照有条带,而样品那么无原因:1.模板:含有抑制物,含量低对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与估量的大小不一致或非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯不合适3.退火温度偏低4.酶量过多、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照显现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。
引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。

PCR实验常见问题、原因分析及其解决方案!PCR产物的电泳检测时间,一般为48h以内,有些最好于当日进行检查,大于48h后带型不规章甚至消逝。
但有时仍会与到这样那样的问题,影响检测结果的推断,详细归类为以下常见的4点,描述如下:问题一:无扩增产物现象:正对比有条带,而样品则无。
缘由:1、模板:含有抑制物,含量低。
2、Buffer对样品不合适。
3、引物设计不当或者发生降解。
4、反应条件:退火温度太高,延长时间太短。
对策:1、纯化模板或者使用试剂盒提取模板DNA或加大模板的用量。
2、更换Buffer或调整浓度。
3、重新设计引物(避开链间二聚体和链内二级结构)或者换一管新引物。
4、降低退火温度、延长延长时间。
问题二:非特异性扩增现象:条带与估计的大小不全都或者非特异性扩增带。
缘由:1、引物特异性差。
2、模板或引物浓度过高。
3、酶量过多。
4、Mg2+浓度偏高。
5、退火温度偏低。
6、循环次数过多。
对策:1、重新设计引物或者使用巢式PCR。
2、适当降低模板或引物浓度。
3、适当削减酶量。
4、降低镁离子浓度。
5、适当提高退火温度或使用二阶段温度法。
6、削减循环次数。
问题三:拖尾现象:产物在凝胶上呈Smear状态。
缘由:1、模板不纯。
2、Buffer不合适。
3、退火温度偏低。
4、酶量过多。
5、dNTP、Mg 2+浓度偏高。
6、循环次数过多。
对策:1、纯化模板。
2、更换Buffer。
3、适当提高退火温度。
4、适量用酶。
5、适当降低dNTP和镁离子的浓度。
6、削减循环次数。
问题四:假阳性现象:空白对比消失目的扩增产物。
缘由:靶序列或扩增产物的交叉污染。
对策:1、操作时应当心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
2、除酶及不能耐高温的物质外,全部试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3、各种试剂最好先进行分装,然后低温贮存。

普通PCR常见问题及解决对策普通PCR常见问题及解决对策⼀、普通PCR常见问题及解决对策PCR产物的电泳检测时间⼀般为48h以内,有些最好于当⽇电泳检测,⼤于48h 后带型不规则甚致消失。
1. 假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及活性④PCR循环条件。
寻找原因亦应针对上述环节进⾏分析研究。
1.1 模板①模板中含有杂蛋⽩质,②模板中含有Taq酶抑制剂,③模板中蛋⽩质没有消化除净,特别是染⾊体中的组蛋⽩,④在提取制备模板时丢失过多,或吸⼊酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了⽑病,因⽽要配制有效⽽稳定的消化处理液,其程序亦应固定不宜随意更改。
1.2 酶失活需更换新酶,或新旧两种酶同时使⽤,以分析是否因酶的活性丧失或不够⽽导致假阴性。
需注意的是有时忘加Taq酶或溴⼄锭。
1.3 引物引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物⼀条浓度⾼,⼀条浓度低,造成低效率的不对称扩增,对策为:①选定⼀个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,⼀定要有引物条带出现,⽽且两引物带的亮度应⼤体⼀致,如⼀条引物有条带,⼀条引物⽆条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如⼀条引物亮度⾼,⼀条亮度低,在稀释引物时要平衡其浓度。
③引物应⾼浓度⼩量分装保存,防⽌多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成⼆聚体等。
1.4 Mg2+浓度Mg2+离⼦浓度对PCR扩增效率影响很⼤,浓度过⾼可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚⾄使PCR扩增失败⽽不出扩增条带。
1.5 反应体积的改变通常进⾏PCR扩增采⽤的体积为20ul、30ul、50ul。
PCR常见问题分析及对策PCR常见问题分析及对策(⽆扩增产物、⾮特异性扩增、拖尾、假阳性)问题1:⽆扩增产物现象:正对照有条带,⽽样品则⽆原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发⽣降解4.反应条件:退⽕温度太⾼,延伸时间太短对策:1.纯化模板或者使⽤试剂盒提取模板DNA或加⼤模板的⽤量2.更换Buffer或调整浓度3.重新设计引物(避免链间⼆聚体和链内⼆级结构)或者换⼀管新引物4.降低退⽕温度、延长延伸时间问题2:⾮特异性扩增现象:条带与预计的⼤⼩不⼀致或者⾮特异性扩增带原因:1.引物特异性差2.模板或引物浓度过⾼3.酶量过多4.Mg2+浓度偏⾼5.退⽕温度偏低6.循环次数过多对策:1.重新设计引物或者使⽤巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离⼦浓度5.适当提⾼退⽕温度或使⽤⼆阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退⽕温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏⾼6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提⾼退⽕温度4.适量⽤酶5.适当降低dNTP和镁离⼦的浓度6.减少循环次数问题4:假阳性现象:空⽩对照出现⽬的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应⼩⼼轻柔,防⽌将靶序列吸⼊加样枪内或溅出离⼼管外;2.除酶及不能耐⾼温的物质外,所有试剂或器材均应⾼压消毒。
所⽤离⼼管及加样枪头等均应⼀次性使⽤。
3.各种试剂最好先进⾏分装,然后低温贮存琼脂糖凝胶电泳回收PCR产物⼀.原理DNA⽚断的分离与回收是基因⼯程操作中的⼀项重要技术,例如可收集特定酶切⽚断⽤于克隆或制备探针,回收PCR产物⽤于再次鉴定等。
回收实验中两个最重要的技术指标是纯度和回收率:前者未达标时会严重影响以后的酶切、连接、标记等酶参与的反应;后者不理想时往往会⼤⼤增加前期的⼯作量。
PCR 常见问题及解决方案1没有扩展条带可能的原因及对应的解决方案如下:酶失活或在反应体系中未加入酶。
Taq DNA 聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA 脱嘌呤而影响PCR 的结果。
变性温度是否准确:PCR 仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
反应系统中污染了蛋白酶及核酸酶,应在未加Taq 酶以前,将反应体系95℃加热5~10 分钟。
引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
引物错误。
利用BLAST 检查引物特异性或重新设计引物。
DNA 凝胶电泳时加入阳性对照,确保不是DNA 凝胶和PCR 程序的问题。
2PCR 产物量过少可能的原因和对应的解决方案如下:退火温度不合适。
以 2 度为梯度设计梯度PCR 反应优化退火温度。
DNA 模板量太少。
增加DNA 模板量。
PCR 循环数不足。
增加反应循环数。
引物量不足。
增加体系中引物含量。
延伸时间太短。
以 1 kb/分钟的原则设置延伸时间。
变性时间过长。
变性时间过长会导致DNA 聚合酶失活。
DNA 模板中存在抑制剂。
确保DNA 模板干净3扩增产物跑电泳条带弥散可能的原因和对应的解决方案如下:酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
dNTP 浓度过高。
减少dNTP 的浓度。
MgCl₂浓度过高。
可适当降低其用量。
模板量过多。
质粒DNA 的用量应<50 ng,而基因组DNA 则应<200 ng。
引物浓度不够优化。
对引物进行梯度稀释重复PCR 反应。
循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR 循环。
退火温度过低。
电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。
若为PCR 试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
PCR常见问题及解决方案问题可能原因解决方法无产物或产量低模板浓度偏低或偏高电泳检测模板浓度,调整模板用量模板降解重新制备;基因组DNA、cDNA应小量分装后低温保存模板中含有抑制反应的杂质纯化模板引物浓度不足调整引物浓度,特别是针对长片段PCR引物存在二级结构重新设计引物,避免二级结构;优化退火温度引物降解引物应高浓度小量分装,-20℃保存,避免反复冻融Mg2+浓度偏低适当提高Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP降解-20℃保存,小量分装,避免反复冻融酶纯度低,扩增效率差选用高质量DNA聚合酶酶量不足适当增加酶量用酶不当针对模板、目标片段的特选择适当的酶(详见PCR产品选择指南)缓冲液失效更换缓冲液或使用预混PCR反应体系模板变性不充分适当延长变性时间;对高GC或复杂结构模板,提高起始变性温度至98℃退火温度偏高降低退火温度,应比引物Tm低至少5℃ 延伸时间不足增加延伸时间,特别是针对长片段PCR 循环数目不够增加循环数PCR管污染质量可靠的PCR管通常不需灭菌,否则应先高温高压灭菌处理;用过的PCR管不可清洗后重复使用PCR仪故障检查程序和模块温度其他使用PCR增强剂非特异产物过多,引物二聚体拖尾严重体系污染设计对照实验寻找污染源,操作时应注意避免交叉污染引物浓度过高适当减少引物浓度引物序列特异性差重新设计引物Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP浓度过高降低dNTP浓度酶量过多减少酶量,以0.5 U间隔递减退火温度过低提高退火温度延伸时间过短增加延伸时间,以1 min间隔递增循环次数过多减少循环次数模板结构过于复杂或目标片段过长特选择适当的酶(详见PCR产品选择指南);使用PCR增强剂其他HotStart PCRTouchDown PCR巢式PCR引物3’末端存在互补序列重新设计引物引物浓度过高降低引物浓度模板浓度过低提高模板浓度退火温度不合适优化退火温度循环次数过多减少循环次数其他HotStart PCR引物浓度过高调整引物浓度引物序列特异性差或模板上存在同源序列重新设计引物模板降解重新制备模板模板浓度过高降低模板浓度dNTP浓度过高减少dNTP用量Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度酶量过多或质量差减少酶量,以0.5 U间隔递减;更换质量可靠的酶变性温度过低提高变性温度,以0.5℃递增退火温度过低提高退火温度延伸时间过长缩短延伸时间循环次数过多减少循环次数,以2个循环间隔递减体系污染设计对照实验,消除污染源其他HotStart PCR TouchDown PCR 巢式PCR假阳性目标片段与非特异扩增片段间存在同源性设计阴性对照,确认为引物问题后重新设计引物体系污染设计阴性对照判断是否有污染,去除污染源。
PCR引物设计的11条黄金法则1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区。
2.引物长度一般在15~30碱基之间。
引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。
3.引物GC含量在40%~60%之间,Tm值最好接近72℃。
GC含量(composition)过高或过低都不利于引发反应。
上下游引物的GC含量不能相差太大。
另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。
有效启动温度,一般高于Tm值5~10℃。
若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。
4.引物3′端要避开密码子的第3位。
如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。
5.引物3′端不能选择A,最好选择T。
引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T时,错配的引发效率大大降低,G、C 错配的引发效率介于A、T之间,所以3′端最好选择T。
6. 碱基要随机分布。
引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(False priming)。
降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。
尤其3′端不应超过3个连续的G或C,因这样会使引物在GC富集序列区错误引发。