DNA测序分析常见问题整理
- 格式:ppt
- 大小:3.07 MB
- 文档页数:31

基因组测序数据分析中常见问题及解决策略基因组测序是一项重要的技术,已经广泛应用于生物医学研究、疾病诊断和个体化治疗等领域。
然而,基因组测序数据分析过程中常会遇到一些问题,正确解决这些问题对于准确地分析基因组数据至关重要。
本文将探讨基因组测序数据分析中常见的问题,并提出解决策略。
一、质量控制问题质量控制是基因组测序数据分析的第一步,主要目的是检查测序数据的质量,并去除质量较差的数据。
常见的质量控制问题包括低质量碱基、接头污染和重复序列等。
针对这些问题,可以采取以下策略。
首先,使用质量评估工具(如FastQC)检查测序数据的质量分布。
对于低质量碱基,可以通过Trimming或过滤掉具有低质量碱基的序列来解决。
接头污染可以通过使用Trimming工具删除接头序列来解决。
对于重复序列,可以利用特定软件(如Prinseq)去除这些序列,以保证数据的准确性和可靠性。
二、序列比对问题在基因组测序数据分析中,序列比对是其中一个关键步骤,目的是将测序数据与参考基因组进行比对,并得到每个位置的reads覆盖度。
常见的问题包括参考基因组选择和序列比对比对率等。
针对这些问题,可以考虑以下解决策略。
首先,对于参考基因组的选择,应根据具体研究目的和样本特点选择最适合的参考基因组。
对于高变异的样本,可以选择一致性较高的参考基因组进行比对。
其次,比对率低的问题可以通过选择合适的比对工具来解决。
目前常用的比对工具包括Bowtie、BWA等,根据具体情况选择适合的工具进行比对。
三、变异检测问题基因组测序数据分析的主要目的之一是检测样本中的变异,包括单核苷酸变异(SNV)、插入缺失变异(Indel)等。
常见的变异检测问题包括假阳性和假阴性。
针对这些问题,可以考虑以下策略。
首先,采用多个变异检测工具进行分析,不仅能够减少假阳性结果的产生,更能提高结果的准确性。
其次,对于假阴性结果,可以根据实验的目的进行进一步的验证,如采用Sanger测序等验证方法来提高结果的可信度。

DNA测序技术的使用中常见问题DNA测序技术是一项重要的科学工具,被广泛应用于生物医学研究、进化学、司法科学等领域。
然而,在使用DNA测序技术的过程中,常常会遇到一些问题。
本文将介绍DNA测序技术使用中常见的问题,并提供相应的解决方案。
1. 样品质量问题在DNA测序之前,样品质量是至关重要的。
低质量的样品会导致测序结果的偏差和错误。
常见的样品质量问题包括样品的纯度不高、浓度不足或者样品受到了污染。
解决方案:- 提高样品纯化方法:使用恰当的纯化试剂和技术来提高样品的纯度,例如使用芳香族化合物或异维酮类物质。
- 检测样品浓度:使用光谱法或者比色法来测量样品中DNA的浓度,确保其符合测序要求。
- 避免样品污染:在样品处理过程中,严格遵守无菌操作规程,使用经过无菌过滤器过滤的试剂和器具。
2. 序列读取长度问题DNA测序技术可以产生从数十个碱基对到上百万个碱基对的序列。
然而,部分DNA测序技术的读取长度有限,这可能影响到某些研究或应用的结果。
解决方案:- 选择合适的测序方法:不同的测序方法具有不同的读取长度,选择适合自己研究目的的测序方法,以满足相关的研究需求。
- 使用测序技术的新发展:不断发展的测序技术,如第三代测序技术,具有较长的读取长度和更高的准确性,可以解决传统测序方法的限制。
3. 突变检测问题DNA测序技术不仅可以用于确定特定序列的顺序,还可以用于检测和鉴定突变。
然而,突变的检测可能受到多种因素的影响,如检测方法的灵敏度和特异性、突变类型的多样性等。
解决方案:- 选择合适的突变检测方法:不同的突变具有不同的检测方法,如SNP分析、插入和缺失突变的分析等。
选择合适的方法来检测特定类型的突变。
- 结合多种检测方法:结合使用不同的突变检测方法可以提高突变检测的准确性和可靠性。
- 验证突变结果:通过使用其他独立的测序技术或方法来验证突变结果,以确保结果的可靠性。
4. 数据分析问题DNA测序技术生成的数据量巨大,数据分析是一个复杂而耗时的过程。
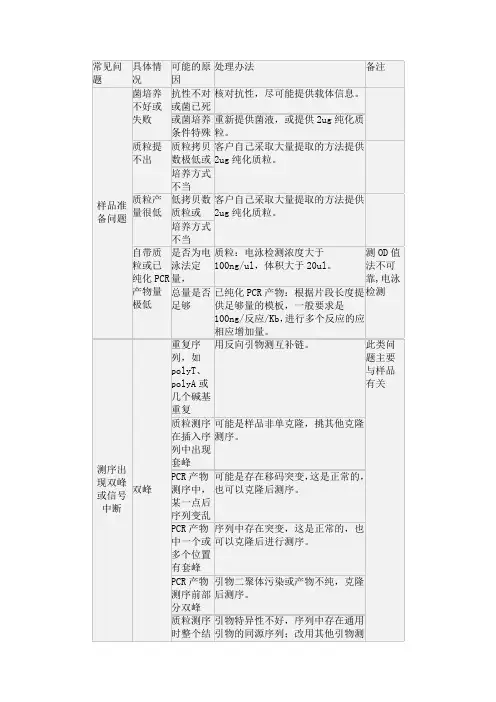

1 、为什么开始一段序列的信号很杂乱,几乎难以辨别这主要是因为残存的染料单体造成的干扰峰所致,该干扰峰和正常序列峰重叠在一起;另外,测序电泳开始阶段电压有一个稳定期,所以经常有20-50 bp 的紧接着引物的片段读不清楚,有时甚至更长。
2 、为什么在序列的末端容易产生 N 值,峰图较杂由于测序反应的信号是逐渐减弱的,所以序列末端的信号会很弱,峰图自然就会杂乱,加上测序胶的分辨率问题,如果碱基分不开,就会产生 N 值,正常情况下ABI377测序仪能正确读出500个碱基的有效序列。
3 、测序结果怎么找不到我的引物序列如果找不到测序所用的引物序列。
这是正常的,因为引物本身是不被标记的,所以在测序报告中是找不到的;如果找不到克隆片段中的扩增引物,可能是您克隆的酶切位点距离您的测序引物太近,开始一段序列很杂,几乎难以辨别,有可能看不清或看不到扩增引物;另外插入片段的插入方向如果是反的,此时需找引物的互补序列。
4 、测序结果怎么看不到我克隆的酶切位点可能的原因同上,您克隆的酶切位点距离您的测序引物太近,开始一段序列很杂,几乎难以辨别,有可能看不清或看不到酶切位点。
通常我们会尽量选择距离酶切位点远点的引物,当然,若是样品出现意外原因,如空载、载体自连等,克隆的酶切位点也是看不到的。
5 、你测出的结果与我预想的不一致,给我的结果与我需要的序列有差距,这是怎么回事首先,我们会核实给您的测序结果是否对应您的样品编号,如果对应的是您的样品,由于不知您的实验背景,测得的序列是否与您预想的结果一致我们无法判断,我们能做到的是检查发送给您的测序结果和您提供来的样品是否一致。
6 、序列图为什么会有背景噪音(杂带)是否会影响测序结果序列图的背景杂带是由荧光染料引起,如果太强会影响测序结果,要看信噪比,我们给的结果信噪比大都在98%以上。
7 、测序结果为什么与标准序列有差别原因可能有:样品个体之间的差别、测序准确率的问题,自动测序仪分析序列的准确并非100%,建议至少测一次双向,通过双向测序可以最大限度减少测序的错误。


总结了测序中经常遇到的问题及原因分析,希望对大家有帮助!Q:测序结果中为什么找不到引物序列?A:找不到用来测序的引物,这是正常的,因为测序的方法是荧光标记测序法,仪器通过检测 ddNTP 上的荧光来读取所测序列,而引物本身是不被标记的,所以仪器无法检测到;找不到所测片段的扩增引物,这种情况是因为您所采用的酶切位点离所用的测序引物距离太近,一般荧光燃料会干扰几十个碱基的读取,这部分碱基会损失掉,损失掉的序列很可能就包含引物的序列,所以引物的序列无法找到;测出的引物序列是原引物序列的反向互补序列,这是因为 TA 克隆的插入没有方向性,如果插入片段是相反的,这时就要反向互补查找引物;测出的结果为空载体,这是因为由于某种原因导致质粒上没有插入外源片段,这时所测的为载体序列,所以就找不到引物了;存在单引物扩增,有一条引物的特异性不好,有多个结合位点,导致只有一条引物参与扩增。
Q:为什么测序结果中引物的序列有个别碱基不同了?A: 这是因为引物区同样存在错配的可能,出现这种可能性有两种: 合成错误和引物区有错配我们可以挑选同批次 2个以上的克隆进行测序验证,如果结果完全相同,应该是合成错误;如果在引物的相同位置错误的碱基不一样那就应该是引物区有错配。
Q:哪些引物不适合作为测序引物?A:①兼并引物:简并引物要在测序模板上有多个结合位点,直接影响测序结果;②随机引物:如 RAPD 引物,随机引物一般都比较短,所用退火温度低,在测序反应的条件下,不能很好地与模板结合;③过长的引物:一般要求测序引物不大于 24bp,过长的引物在测序反应的较低的条件下容易在测序模板上有多个结合位点,导致测序结果背景增高。
另外,较长的引物纯度也将难以保证。
通常用于测序的引物纯度要在 90%以上,引物纯度低时,测序反应的背景将明显增大,直接影响到测序结果;④有特殊标记的引物:该情况主要指荧光标记的引物。
我们测序反应的四种碱基都是荧光标记的,这样,荧光标记的引物将产生干扰。

DNA测序过程可能遇到的问题及分析对于一些生物测序公司(如Invitrogen等),我们的菌液或质粒经过PCR和酶切鉴定都没问题,但几天后的测序结果却无法另人满意。
为什么呢?PCR产物直接进行测序,在PCR产物长度以后将无反应信号,机器将产生许多N值。
这是由于Taq酶能够在PCR反应的末端非特异性地加上一个A碱基,我们所用的T载体克隆PCR产物就是应用该原理,通常PCR产物结束的位点,PCR产物测序一般末端的一个碱基为A(绿峰),也就是双脱氧核甘酸ddNTP终止反应的位置之前的A,A后的信号会迅速减弱。
N值情况一般是由于有未去除的染料单体造成的干扰峰。
该干扰峰和正常序列峰重叠在一起,有时机器377以下的测序仪无法正确判断出为何碱基。
有时,在序列的起始端的小片段容易丢失,导致起始区信号过低,机器有时也无法正确判读。
在序列的3’端易产生N值。
一个测序反应一般可以读出900bp以上的碱基(ABI3730可以达到1200bp),但是,只有一般600bp以前的碱基是可靠的,理想条件下,多至700bp的碱基都是可以用的。
一般在650bp以后的序列,由于测序毛细管胶的分辩率问题,会有许多碱基分不开,就会产生N值。
测序模板本身含杂合序列,该情况主要发生在PCR产物直接测序,由于PCR产物本身有突变或含等位基因,会造成在某些位置上有重叠峰,产生N值。
这种情况很容易判断,那就是整个序列信号都非常好,只有在个别位置有明显的重叠峰,视杂合度不同N值也不同。
测序列是从引物3’末端后第一个碱基开始的,所以就看不到引物序列。
有两种方法可以得到引物序列。
1.对于较短的PCR产物(<600bp),可以用另一端的引物进行测序,从另一端测序可以一直测通,可以在序列的末端得到该引物的反向互补序列。
对于较长的序列,一个测序反应测不通,就只能将PCR产物片段克隆到载体中,用载体上的通用引物(T7/SP6)进行测序。
载体上的通用引物与所插入序列间有一段距离,因此就可以得到完整的引物序列。



测序常见问题分析与解答1、DNA测序样品用什么溶液溶解比较好?答:溶解DNA测序样品时,用灭菌蒸馏水溶解最好。
DNA的测序反应也是Taq酶的聚合反应,需要一个最佳的酶反应条件。
如果DNA用缓冲液溶解后,在进行了测序反应时,DNA溶液中的缓冲液组份会影响测序反应的体系条件,造成Taq酶的聚合性能下降。
有很多客户在溶解DNA测序样品时使用TE Buffer。
的确,TE Buffer能增加DNA样品保存期间的稳定性,但TE Buffer对DNA测序反应有影响,根据我们的经验,我们还是推荐使用灭菌蒸馏水来溶解DNA测序样品。
2、提供DNA测序样品时,提供何种形态的比较好?答:我们推荐客户提供菌体,由我们来提取质粒,这样DNA样品比较稳定。
如果您要以提供DNA样品,我们也很欢迎,但一定要注意样品纯度和数量。
提供的测序样品为PCR产物时,特别需要注意DNA的纯度和数量。
PCR产物应该进行切胶回收,否则无法得到良好的测序效果。
有关DNA测序样品的详细情况请严格参照“DNA测序样品准备及注意事项”部分的说明。
3、提供的测序样品为菌体时,以什么形态提供为好?答:一般菌体的形态有:平板培养菌、穿刺培养菌,甘油保存菌或新鲜菌液等。
我们提倡寄送穿刺培养菌或新鲜菌液。
平板培养菌运送特别不方便,我们收到的一些平板培养菌的培养皿在运送过程中常常已经破碎,面目全非,需要用户重新寄样。
这样既误时间,又浪费客户的样品。
一旦是客户非常重要的样品时,其后果更不可设想。
而甘油保存菌则容易污染。
制作穿刺菌时,可在1。
5ml的Tube管中加入琼脂培养基,把菌体用牙签穿刺于琼脂培养基(固体)中,37℃培养一个晚上后便可使用。
穿刺培养菌在4℃下可保存数个月,并且不容易污染,便于运送。
4、与测序引物有关的问题:答:对于通用测序引物,只要正确使用,一般不会有太大问题,测序引物问题主要发生在客户自己提供的PCR引物上。
应该明确的一点是并不是所用的用于PCR的引物都可以用来作测序,以下几种PCR引物将是不适合用作测序引物的:(1)简并引物,简并引物必然要在测序模板上有多个结合位点,直接影响测序结果。

2 结果2.1 成功的建立HSV-1致死性感染动物模型,HSV感染滴度为106ID50/0.1ml。
死亡小鼠各组织器官涂片上HSV抗原均呈阳性反应,表明小鼠死于HSV感染。
2.2 空白对照组小鼠100%健康存活,致死攻击组小鼠100%发病死亡。
多于感染后第4~5天出现茸毛、抽搐、下肢麻痹等脑炎症状,5~7d内死亡。
M cAbS被动免疫实验组对小鼠均有保护作用。
第3、4组小鼠全部存活21d以上,第5组于感染后第15天发生1只鼠死亡,其余全部存活。
于感染后24d将第1,3,4,5组小鼠人工处死。
以上表明HSV-1 M cAbS对HSV-1致死性感染的小鼠几乎100%有特异性保护治疗作用。
另外,致死攻击组小鼠各组织器官涂片HSV 抗原均呈强阳性,其余各组与对照组为阴性。
表明小鼠感染HSV后,发生病毒血症导致死亡。
3 讨论HSV属于疱疹病毒科的具有代表性的典型疱疹病毒,其核酸为线状双股DNA。
有两种血清型:HSV-1和HSV-2。
两型病毒的DNA有50%的同源性,因此有型间共同抗原,也有型特异性抗原。
HSV病毒体有6种与细胞膜相关的糖蛋白,分别为糖蛋白B(g B)、gC、gD、g E、gG和g H。
其中gB、g D 与病毒感染的吸附及穿入有关,gH与病毒释放有关[7]。
g D 是HSV-1和HSV-2的共同抗原决定簇,其抗gD抗体属中和抗体,中和病毒的能力最强,能与HSV的g D抗原特异结合,结果改变了病毒的表面结构,阻断了病毒对宿主细胞的吸附,使病毒失去了感染能力[8]。
本实验所用的M cAbS中既有能识别HSV的gB、g D抗原的型共同性特异性单克隆抗体,也有能识别HSV的g C的型特异性单克隆抗体,体外中和试验也证明其中和效价为105~107,具有很强的中和病毒的作用[9]。
本实验结果在观察期内,空白对照组100%存活,且HSV抗原呈阴性。
致死对照组100%死亡,HSV抗原呈强阳性,证实本组小鼠死于HSV感染。
测序常见问题解答1.为什么需要新鲜的菌液?首先,新鲜的菌液易于培养,可以获得更多的DNA,同时最大限度地保证菌种的纯度.2.如何提供菌液?如果您提供新鲜菌液,用封口膜封口以免泄漏;也可以将培养好的4—5ml菌液沉淀下来,倒去上清以方便邮寄。
同时邮寄时最好用盒子以免邮寄过程中压破.3.如何制作穿刺菌?用灭菌过1.5ml或2ml离心管加入LB琼脂(7g/L)斜面凝固,用接种针挑取分散良好的单菌落穿过琼脂直达管底,不完全盖紧管盖适当温度培养过夜,然后盖紧盖子加封口膜,室温或4度保存。
4.PCR产物直接测序有什么要求?1).扩增产物必须特异性扩增,条带单一.如果扩增产物中存在非特异性扩增产物,一般难以得到好的测序结果;.2)必须进行胶回收纯化;3)DNA纯度在16—2.0之间.浓度50ng/ul以上.5.为什么PCR产物直接测序必须进行Agarose胶纯化?如果不进行胶纯化而直接用试剂盒回收,经常会导致测序出现双峰甚至乱峰。
这主要是非特异性扩增产物或者原来的PCR引物去除不干净所导致。
大多所谓的PCR"纯化试剂盒"实际上只是回收产物而不能起到纯化的作用的。
对于非特异性扩增产物肯定无法去除,而且通常他们不能够完全去除所有的PCR引物,这会造成残留的引物在测序反应过程中参与反应而导致乱峰。
6.如何进行PCR产物纯化?PCR产物首先必须用Agarose胶电泳,将特异扩增的条带切割下,然后纯化。
使用凝胶回收试剂盒回收.产物用ddH2O溶解。
7.PCR产物直接测序的好处?A) PCR产物直接测序可以反映模板的真实情况.B) 省去克隆的实验费用和时间.C) PCR产物测序正确的片段进行下一步克隆实验使结果更有保障.D) 混合模板进行PCR的产物直接测序可以发现其中的点突变.8.对用于测序的质粒DNA的要求有哪些?对测序模板DNA的一般要求:1).DNA纯度要求高,1.6—2.0之间,不能有混合模板,也不能含有RNA,染色体DNA,蛋白质等;2).溶于ddH2O中,溶液不能含杂质,如盐类,或EDTA等螯合剂,将干扰测序反应正常进行。
DNA果套峰分析Q-12. 测序结果有很多套峰(出现很多N),还照常收费,为什么? 返回顶端A-12. DNA模板上出现二处以上的引物结合位点,或者DNA模板上有严重的重复序列,以及测序引物不纯时, 测序结果便会出现套峰现象(见图4)。
出现这种现象的原因由DNA模板本身或者引物本身所造成,对这些结果(公司保证进行2次以上的测序工作),公司会根据具体情况进行收费(详细见测序结果说明)。
Q-13. 为什么用PCR产物测序时,经常会出现套峰现象? 返回顶端A-13. PCR产物测序出现套峰现象,一般有以下几种原因:1)PCR用模板不纯或PCR用引物特异性不好,扩增出的产物除了目的片段外,还有与目的片段长度相近的片段,即使用凝胶电泳也无法分离开,这样的PCR产物测序结果是套峰。
2)结构上的原因,造成了PCR产物测序出现套峰的现象。
PolyA/G/C/T以及原因不明的复杂结构的存在,都会出现测序结果套峰的情况。
Q-14. 出现套峰的原因是什么?返回顶端A-14. 在测序反应中,模板或引物的原因都可能造成套峰的形成,归结其形成原因有以下几点1)测序引物在模板上有两个结合位点形成套峰2)模板不纯,如果是质粒或是菌液,原因是非单克隆,如果是PCR,原因为非特异性条带3)模板序列的特殊结构,如poly结构、发卡结构等4)引物降解,引物不纯,或引物的特异性不好Q-15. 测序结果不到800 Bases,还照常收费了,为什么? 返回顶端A-15. 如在DNA样品中的DNA序列分布匀称,没有复杂结构时,正常的测序反应能保证达到800 Bases以上。
但有一些DNA样品立体结构复杂,造成聚合酶延伸反应终止,测序信号突然减弱或消失,或者测序结果出现套峰现象。
出现这些现象的原因由DNA模板本身所造成(公司保证进行2次以上的测序工作)。
对这些结果,公司会根据具体测序情况,进行收费(详细见测序结果说明)。
出现这些情况的原因分析如下:1) G/C rich、G/C Cluster:这种情况一般表现为测序信号突然减弱或消失(见图1);2) A、T的连续结构:这种情况一般表现为A、T连续结构后面的测序结果出现套峰(见图2)。
DNA测序结果分析比对 - 测序图初识通常一份测序结果图由红、黑、绿和蓝色测序峰组成,代表不同的碱基序列。
测序图的两端(本图原图的后半段被剪切掉了)大约50个碱基的测序图部分通常杂质的干扰较大,无法判读,这是正常现象。
这也提醒我们在做引物设计时,要避免将所研究的位点离PCR序列的两端太近(通常要大于50个碱基距离),以免测序后难以分析比对。
我的课题是研究基因多态性的,因此下面要介绍的内容也主要以判读测序图中的等位基因突变位点为主。
实际上,要在一份测序图中找到真正确实的等位基因多态位点并不是一件容易的事情。
由于临床专业的研究生,这些东西是没人带的,只好自己研究。
开始时大概的知道等位基因位点在假如在测序图上出现像套叠的两个峰,就是杂合子位点。
实际比对了数千份序列后才知道,情况并非那么简单,下面测序图中标出的两个套峰均不是杂合子位点,如图并说明如下:说明:第一组套峰,两峰的轴线并不在同一位置,左侧的T峰是干扰峰;第二组套峰,虽两峰轴线位置相同,但两峰的位置太靠近了,不是杂合子峰,蓝色的C峰是干扰峰通常的杂合子峰由一高一略低的两个轴线相同的峰组成,此处的序列被机器误判为“C”,实际的序列应为“A”,通常一个高大碱基峰的前面1~2个位点很容易产生一个相同碱基的干扰峰,峰的高度大约是高大碱基峰的1/2,离得越近受干扰越大。
一个摸索出来的规律是:主峰通常在干扰峰的右侧,干扰峰并不一定比主峰低。
最关键的一点是一定要拿疑似为杂合子峰的测序图位点与测序结果的文本序列和基因库中的比对结果相比较;一个位点的多个样本相比较;你得出的该位点的突变率与权威文献或数据库中的突变率相比较。
通常,对于一个疑似突变位点来说,即使是国际上权威组织大样本的测序结果中都没有报道的话,那么单纯通过测序结果就判定它是突变点,是并不严谨的,因一份PCR产物中各个碱基的实际含量并不相同,很难避免不产生误差的。
对于一个未知突变位点的发现,通常还需要用到更精确的酶切技术。
测序过程常见问题分析与解答1、DNA测序样品用什么溶液溶解比较好?答:溶解DNA测序样品时,用灭菌蒸馏水溶解最好。
DNA的测序反应也是Taq酶的聚合反应,需要一个最佳的酶反应条件。
如果DNA用缓冲液溶解后,在进行了测序反应时,DNA溶液中的缓冲液组份会影响测序反应的体系条件,造成Taq酶的聚合性能下降。
有很多客户在溶解DNA测序样品时使用TE Buffer。
的确,TE Buffer能增加DNA样品保存期间的稳定性,但TE Buffer对DNA测序反应有影响,根据我们的经验,我们还是推荐使用灭菌蒸馏水来溶解DNA测序样品。
2、提供DNA测序样品时,提供何种形态的比较好?答:我们推荐客户提供菌体,由我们来提取质粒,这样DNA样品比较稳定。
如果您要以提供DNA样品,我们也很欢迎,但一定要注意样品纯度和数量。
提供的测序样品为PCR产物时,特别需要注意DNA的纯度和数量。
PCR产物应该进行切胶回收,否则无法得到良好的测序效果。
有关DNA测序样品的详细情况请严格参照“测序模板的要求”部分的说明。
3、提供的测序样品为菌体时,以什么形态提供为好?答:一般菌体的形态有:平板培养菌、穿刺培养菌,甘油保存菌或新鲜菌液等。
我们提倡寄送穿刺培养菌或新鲜菌液。
平板培养菌运送特别不方便,我们收到的一些平板培养菌的培养皿在运送过程中常常已经破碎,面目全非,需要用户重新寄样。
这样既误时间,又浪费客户的样品。
一旦是客户非常重要的样品时,其后果更不可设想。
而甘油保存菌则容易污染。
制作穿刺菌时,可在1.5ml的Tube管中加入琼脂培养基,把菌体用牙签穿刺于琼脂培养基(固体)中,37℃培养一个晚上后便可使用。
穿刺培养菌在4℃下可保存数个月,并且不容易污染,便于运送。
4、与测序引物有关的问题答:对于通用测序引物,只要正确使用,一般不会有太大问题,测序引物问题主要发生在客户自己提供的PCR引物上。
应该明确的一点是并不是所用的用于PCR的引物都可以用来作测序,以下几种PCR引物将是不适合用作测序引物的:(1)简并引物,简并引物必然要在测序模板上有多个结合位点,直接影响测序结果。
1 、为什么开始一段序列的信号很杂乱,几乎难以辨别这主要是因为残存的染料单体造成的干扰峰所致,该干扰峰和正常序列峰重叠在一起;另外,测序电泳开始阶段电压有一个稳定期,所以经常有20-50 bp 的紧接着引物的片段读不清楚,有时甚至更长。
2 、为什么在序列的末端容易产生 N 值,峰图较杂由于测序反应的信号是逐渐减弱的,所以序列末端的信号会很弱,峰图自然就会杂乱,加上测序胶的分辨率问题,如果碱基分不开,就会产生 N 值,正常情况下ABI377测序仪能正确读出500个碱基的有效序列。
3 、测序结果怎么找不到我的引物序列如果找不到测序所用的引物序列。
这是正常的,因为引物本身是不被标记的,所以在测序报告中是找不到的;如果找不到克隆片段中的扩增引物,可能是您克隆的酶切位点距离您的测序引物太近,开始一段序列很杂,几乎难以辨别,有可能看不清或看不到扩增引物;另外插入片段的插入方向如果是反的,此时需找引物的互补序列。
4 、测序结果怎么看不到我克隆的酶切位点可能的原因同上,您克隆的酶切位点距离您的测序引物太近,开始一段序列很杂,几乎难以辨别,有可能看不清或看不到酶切位点。
通常我们会尽量选择距离酶切位点远点的引物,当然,若是样品出现意外原因,如空载、载体自连等,克隆的酶切位点也是看不到的。
5 、你测出的结果与我预想的不一致,给我的结果与我需要的序列有差距,这是怎么回事首先,我们会核实给您的测序结果是否对应您的样品编号,如果对应的是您的样品,由于不知您的实验背景,测得的序列是否与您预想的结果一致我们无法判断,我们能做到的是检查发送给您的测序结果和您提供来的样品是否一致。
6 、序列图为什么会有背景噪音(杂带)是否会影响测序结果序列图的背景杂带是由荧光染料引起,如果太强会影响测序结果,要看信噪比,我们给的结果信噪比大都在98%以上。
7 、测序结果为什么与标准序列有差别原因可能有:样品个体之间的差别、测序准确率的问题,自动测序仪分析序列的准确并非100%,建议至少测一次双向,通过双向测序可以最大限度减少测序的错误。