九年级科学物质转化与材料利用1
- 格式:doc
- 大小:44.00 KB
- 文档页数:2

第二章物质的转化与材料利用填空题一、金属材料1.人类的生活和生产都离不开金属。
铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关。
(1)生活中常用铜作导线,主要是利用了铜的________。
(2)铁制品锈蚀的过程,实际上是铁丝与空气中的________和水蒸气发生了化学反应。
(3)为了验证三种金属的活动性顺序,可选择Al、Cu和下列试剂中的来达到实验目的。
(选填字母序号)A. Al2(SO4)3溶液B. FeSO4溶液C. CuSO4溶液(4)可“用稀盐酸除去铁锈,原理是(用化学方程式表不)_____ ___。
2.我国自行研发的大型客机C919于2017年5月成功试飞,请根据所学知识回答问题:(1)选用铝合金做飞机机身而不选用饱铝,主要原因是铝合金硬度和强度比纯铝________(2)飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与________接触(3)若要验证飞机材料中的Fe、Cu和Al的金属活动性顺序,只需一种试剂直接与上述三种金属反应就能达到目的,该试剂是(填序号)。
A. 硫酸铝溶液B. 硫酸亚铁溶液C. 硫酸钢溶液3.垃级分类回收是保护环境、防止资源浪费的一项重要举措。
镇海区街头垃圾桶如图所示,回答下列问题;(1)图中标示的物质中,属于金属材料的是________(写出1种即可)。
(2)塑料矿泉水瓶应放入________(填“可回收”或“不可回收”)筒中。
(3)使用铝合金做内筒的优点是______ __(写出1点即可)。
4. 生活中处处有科学,某同学拆开家中使用过的“暖宝宝”,发现内有褐色固体,查阅后得知:“暖宝宝”成分中有铁粉、食盐和水等物质;使用后形成的褐色固体主要是氧化铁和氢氧化铁:其中氢氧化铁受热会分解成氧化铁和水。
据上信息,你认为该褐色固体可能是“暖宝宝”中的物质跟空气中的________发生反应形成的。
请写出氢氧化铁受热分解的化学方程式____ ____。
5.今年5月,吴王夫差剑重返苏州。

第二章物质转化与材料利用置换反应:A+BC=B+AC,单质和化合物反应,生成新单质和新的化合物在这一章内,涉及的置换反应相当多,主要归纳为两类:①金属和酸反应②金属和盐反应一、金属和酸置换反应:活泼金属+酸=氢气+盐。
这一类的题型在第一章就已经接触过,考察的点比较简单,一般需要考虑的就是恰好完全反应、金属过量、酸过量等几种因素。
恰好完全反应最简单,只要根据化学反应方程式进行相应的判断和计算即可。
金属过量则根据方程式中酸的量来进行判断和计算,这里需要注意,最终产生的氢气的量一定是相同的。
酸过量或者金属完全反应指的是一类问题,都是说供应的酸可以使等质量的金属完全消失。
那么这个时候最快的方法就是根据金属的相对原子质量和它反应后的化合价来判断生成一份氢气需要多少金属,然后再看所给出的金属质量是多少,从而得出结论哪种金属生成的氢气多。
一般,等质量的几种金属,反应后化合价一致的,相对原子质量越小,生成的氢气越多。
在这里,我们新学习了金属的活动性顺序,那么在反应中还可以加入考虑金属与酸反应的快慢。
练习:1、锌粉、铝粉、镁粉的混合物3.8克与一定质量的稀硫酸恰好完全反应,生成氢气0.2克,将反应后的溶液蒸发水分,则得到固体硫酸锌、硫酸铝、硫酸镁的混合物质量为()A.13.6克 B.13.4克 C.12克 D.11克2、某实验小组在探究金属的化学性质时,得到金属与酸反应制取氢气的质量关系.请根据图象信息判断,下列说法正确的是()D. Al、Mg、Fe、Zn四种金属与酸反应得到氢气的质量比:3、向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是()4、(1)等质量的A、B 两种物质分别与等质量的同浓度的稀盐酸充分反应,反应产生气体的质量与反应时间的关系如甲图所示。
请回答下列问题:①若A、B 为Mg、Zn 中的一种,则A是,反应结束后只有一种金属剩余,则剩余金属为。
②若A、B为碳酸钠粉末和碳酸钙块状固体中的一种,反应结束后,则它们消耗的酸(填“A多”、“B 多”或“相等”)。

第⼆章物质的转化与材料利⽤(全章教案)九年级第⼆章物质的转化与材料利⽤教案第1节物质的分类和利⽤(计划3课时)教学⽬标:1、掌握对纯净物进⾏分类的基本⽅法2、能根据物质的组成对纯净物进⾏分类,并能运⽤实验的⽅法,通过对⽐对物质进⾏分类3、了解⾦属与⾮⾦属不同的性质,了解⾦属的⽤途重点难点:物质的分类⽅法药品器材:⽆⽔硫酸铜、碳酸钠溶液、⾷盐、冰醋酸、试管、酒精灯、⾊拉油、滴管、⾼锰酸钾、烧杯教学过程:第1课时引⼊:⾃然界中物质的各类繁多,性质各异,为了更好的研究和识别它们,有必要对它们进⾏分类。
在第⼀册中我们已经学过了关于动物和植物的分类。
今天让我们⼀起来研究⼀下物质的分类。
⼀、物质分类的⽅法观察下列物质:氯化钠、硫酸、氧⽓、醋酸、氯⽓、氧化镁、⾼锰酸钾,并按它们的颜⾊和状态进⾏分类?――按颜⾊分类⽩⾊:氯化钠、氧化镁⽆⾊:硫酸、氧⽓、醋酸黄绿⾊:氯⽓紫⿊⾊:⾼锰酸钾――按状态分类固态:氯化钠、氧化镁、⾼锰酸钾液态:硫酸、醋酸⽓态:氧⽓、氯⽓提问:还有其它的分类⽅法么?若有,请说明分类的依据(学⽣讨论,并回答)――还可以从⽓味、溶解性等来分讲授:物质的分类*注:⑴氧化物:由两种元素组成,其中⼀种是氧元素的化合物。
⑵有机物:含碳的化合物(哪些需除外?),种类繁多,完全燃烧⼀般都⽣成⽔和⼆氧化碳,不完全燃烧时会有⿊⾊的炭产⽣。
⼩结:根据已知物质和未知物的特性,运⽤实验的⽅法,通过对⽐也可以对物质进⾏分门别类。
第2课时*探究:每只烧杯中装了什么物质?1、提出问题:7只烧杯中分别装有蔗糖、⾷盐、、冰醋酸、⽆⽔硫酸铜粉末、⾊拉油、⾼锰酸钾、碳酸钠溶液中的某⼀种,能否⽤实验⽅法区分所装的物质各是什么?23、动⼿试⼀试,并将结果填于表格中。
除了观察、⽔溶性之处,还可以进⾏如下实验:加热后是否熔化?加热是否变⾊?⽤显微镜观察晶体形状等⽅法⼩结:有机物与⽆机物的区别是什么?――是否含碳元素(组成上的区别);⼤多数有机物易燃,固体发热会变⿊,难溶于⽔(实验现象中的区别)⼆、常见的物质根据本节上述内容对常见的物质进⾏分类(略,如上图)三、区别⾦属与⾮⾦属观察:如图2-7所⽰,请仔细观察和记录这些样品的外观。


物质转化与材料利用第一节物质的分类和利用一.物质分类的方法物质分类的标准很多,所以分类的方法也很多,如可先观察物质不同的颜色、状态、颗粒的大小(形状)、气味等对物质进行分类,再根据物质的组成和物质的特性进行分类。
二.常见物质的分类2.混合物和纯净物纯净物:由同种物质组成。
混合物:由两种或两种以上物质组成。
3.单质和化合物单质:由同种元素组成的纯净物(由同种元素组成的物质不一定是单质,例如,金刚石和石墨混合在一起属于混合物)。
化合物:由不同种元素组成的纯净物(结晶水合物因有固定的组成和性质,属于纯净物)。
4.氧化物:由两种元素组成,其中一种是氧元素的化合物。
5.有机化合物:通常指含碳的化合物(CO、CO2、H2CO3和碳酸盐除外)。
三. 金属和非金属的比较名称金属非金属颜色金属光泽有多种颜色,无金属光泽延展性良好不具有硬度比较硬硬度不一致导电性良好一般不导电(除石墨)导热性高低熔点高低第二节物质的转化的规律一、单质、氧化物、酸、碱、盐各类物质的相互关系1、写出金属到碱性氧化物的化学方程式。
2Ca+O2==2CaO2、写出碱性氧化物到碱的化学方程式CaO+H2O==Ca(OH)23、写出碱到盐的化学方程式。
Ca(OH)2+2HCl==CaCl2+2H2O4、写出非金属到酸性氧化物的化学方程式。
C + O2点燃⇒CO25、写出酸性氧化物到酸的化学方程式。
CO2+H2O==H2CO36、写出酸到盐的化学方程式。
H2CO3+Ca(OH)2==CaCO3 +2H2O二、金属单质与其化合物的转化关系1.金属→金属氧化物→碱→盐2.非金属→非金属氧化物→酸→盐物质转化10条主要规律:①金属单质+氧气→金属氧化物②非金属单质+氧气→非金属氧化物③金属单质+酸→氢气+盐④金属单质+盐→另一种金属+另一种盐⑤金属氧化物+酸→盐+水⑥非金属氧化物+碱→盐+水⑦酸+碱→盐+水⑧酸+盐→新酸+新盐⑨碱+盐→新碱+新盐⑩盐+盐→新盐+新盐⑾非金属氧化物+ H2O =酸(除二氧化硅,一氧化碳除外)⑿某些金属氧化物 + 水→碱(可溶)三、金属的冶炼(1)还原法:在金属氧化物中加入还原剂,夺取金属氧化物中的氧,而使其还原成金属单质。


浙教版九年级上册科学知识点总结一、物质的转化与材料利用。
1. 物质的变化。
- 物理变化:没有新物质生成的变化,例如物质的三态变化(水的凝固、冰的熔化等)、形状改变(金属丝的弯曲)等。
- 化学变化:有新物质生成的变化,如燃烧(镁条燃烧生成氧化镁)、生锈(铁生锈生成铁锈,主要成分是氧化铁)等。
化学变化中常伴随发光、发热、变色、产生气体、生成沉淀等现象,但有这些现象的不一定是化学变化。
2. 物质的性质。
- 物理性质:不需要发生化学变化就能表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度、溶解性等。
- 化学性质:物质在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性、稳定性等。
3. 物质的转化规律。
- 金属→金属氧化物→碱→盐。
- 金属(如镁)在氧气中燃烧生成金属氧化物(氧化镁):2Mg +O_2{点燃}{===}2MgO。
- 金属氧化物(如氧化钙)与水反应生成碱(氢氧化钙):CaO +H_2O===Ca(OH)_2。
- 碱(如氢氧化钠)与酸(盐酸)反应生成盐(氯化钠)和水:NaOH+HCl===NaCl + H_2O。
- 非金属→非金属氧化物→酸→盐。
- 非金属(如碳)在氧气中充分燃烧生成非金属氧化物(二氧化碳):C+O_2{点燃}{===}CO_2。
- 非金属氧化物(如二氧化碳)与水反应生成酸(碳酸):CO_2+H_2O===H_2CO_3。
- 酸(如硫酸)与碱(氢氧化钾)反应生成盐(硫酸钾)和水:H_2SO_4+2KOH===K_2SO_4+2H_2O。
4. 常见的材料。
- 金属材料:包括纯金属和合金。
合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
例如,铁合金(生铁和钢),生铁含碳量高,钢含碳量低,合金的硬度一般比组成它的纯金属大,熔点比组成它的纯金属低。
- 无机非金属材料:如陶瓷、玻璃、水泥等。
陶瓷具有耐高温、耐腐蚀等特点;玻璃具有透明、硬度大等特点;水泥是建筑工程中常用的材料。



first第二章 物质转化与材料利用 知识点归纳一、金属的性质12.金属与非金属的主要性质差异3.合金:两种或两种以上的金属(也可以是金属和非金属)熔合在一起具有金属特性的物质。
合金具有金属特性,其性能比纯金属更好,硬度更大。
钢是最常见、应用较广的一种合金,由Fe 和C 形成的合金 金属锈蚀的条件:空气和水分保护膜法:油漆、涂油、电镀、烤蓝等改变金属内部结构:不锈钢二、金属的化学性质 1. 金属的化学性质有些金属能在空气中燃烧,如镁; 有些金属能在纯氧中燃烧,如铁;有些虽不能燃烧,但也会反应,生成氧化物,如铜、铁、铝等分别能生成氧化铜、氧化铁、氧化铝。
金属跟酸的反应铝、镁、铁、锌等金属能跟稀硫酸、稀盐酸反应产生氢气,而铜等却不能跟稀硫酸、稀盐酸反应。
金属跟某些盐溶液反应能生成新的盐和新的金属 置换反应2. 金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb [H] Cu Hg Ag Pt Au金属活动性由强逐渐减弱。
s e c o n d金属活动性顺序的应用规律:金属跟酸反应:在金属活动性顺序中,只有排在氢前面的金属可以把酸中的氢置换出来。
金属跟盐溶液的反应:在金属活动性顺序中,只有一种活动性较强的金属才能把另一种活动性较弱的金属从它的盐溶液中置换出来。
(注:金属和两种盐反应时先置换出活泼性弱的)【注意】K 、Ca 、Na 太活泼,易与水反应,不与酸、盐发生置换反应;铁与酸、盐发生的置换反应 中,产物是亚铁盐(Fe三、简单有机物 1.有机物的定义:一类含碳化合物(碳的氧化物、碳酸和碳酸盐除外),大多含C 、H 、O 、N 等元素。
2.甲烷 (1)甲烷的化学式为CH 4,它是最简单的一种有机物。
(2)沼气、天然气和石油气的主要成分都是甲烷。
火星的大气层也发现有很多的甲烷 (3)由于甲烷气体与空气或氧气混合点燃时,易发生爆炸,故使用前需要验纯 。
家庭在使用沼气或天然气体作燃料时要注意安全。
常见合金的主要组成元素、性能和用途污染金属一般不会自行分解会影响土质金属的氧化和锈蚀也会污染土壤危害生态环境像铅、镉等有毒的金属被腐蚀后会溶于水形成金属离子污染土壤和地下水源重金属污染指由重金属或其化合物造成的环境污染主要由采矿、废气排放、污水灌溉和使用重金属制品等密度在4.5克每立方厘米以上的金属,称作重金属重金属在人体内能和蛋白质及酶等发生强烈的相互作用,使它们失去活性,也可能在人体的某些器官中累积,造成慢性中毒重⾦属中毒的原理回收利用意义节约资源和能源非金属堆积会造成金属资源的浪费并且侵占土地基本上所有金属都可循环再生减少环境污染普遍回收的金属铝铅铁铜锡锌在潮湿的空气中会被氧化而生锈能在空气中燃烧如:镁化学方程式现象剧烈燃烧,发出耀眼的白光,生成白色的固体,放出热量些金属在空气中不燃烧,但能在氧气中燃烧如:铁烈燃烧,火星四射,生成黑色固体,放出热量高温加热后能与氧反应,表面由红色变为黑色与稀盐酸的反应一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应大基本反应类型16年由于锈蚀而直接损失的钢铁材料约占年产钢铁产量的四分之一属的锈蚀既与周围环境里的水、空气等物质的作用有关持金属制品表面的洁净和干燥草及动物粪便经过发酵会产生大量的沼气个氢原子构成的烷具有可燃性,于甲烷气体与空气或氧气混合点燃时,装在容器中贮存,使用时经减压,使液态丁烷汽化成气体气态的丁烷经压缩后变成液态,丁烷容易被液化由于丁烷容易液化与可燃的性质,得丁烷能成为便携的燃料,可用于乙炔具有可燃性,在氧气中燃烧时能产生℃以上的高温,可用于焊接和切割金属部分有机物熔点较低,受热易分解,易挥发,易燃烧,不易导电等。
故保存时一定要密封,做实验时一定要远离明火,防止着火或爆炸大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂许多有机物,如酒精、汽油、乙醚、苯、氯仿等都是常见的、很好的有机溶剂。
11各类别的概念详见下一页混合物:由两种或多种物质混合而成的物质纯净物:有同种基本微粒(基本微粒指的是原子、分子、离子)构成的物质。

九年级上册第二章物质转化与材料利用一、物质的分类物质按组成进行的简单分类:二、知道单质、氧化物、酸、碱、盐之间的相互转化规律1、单质、氧化物、酸、碱、盐等各类物质之间存在相互联系并,在一定条件下可以互相转化:金属可以转化为金属氧化物,金属氧化物可以转化为碱;非金属可以转化为非金属氧化物,非金属氧化物可以转化为酸。
三、根据单质、氧化物、酸、碱、盐之间的转化规律设计物质制备的方案。
1、金属+非金属→盐2、金属氧化物+非金属氧化物→盐3、金属氧化物+酸→盐+水4、非金属氧化物+碱→盐+水5、碱+酸→盐+水6、酸+盐→新酸+新盐7、碱+盐→新碱+新盐8、盐+盐→两种新盐9、金属+酸→盐和氢气10、金属+盐→新金属+新盐四、金属1、区别金属和非金属。
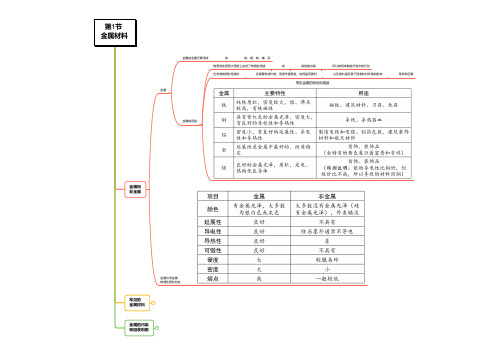
金属的普遍特性:有金属光泽,是良好的导电、导热体,有延展性,密度和熔点高,具有广泛的用途。
2、金属的冶炼就是要把金属从化合态变成游离态。
3、金属的锈蚀和防护。
金属的锈蚀与其在周围环境中接触的物质有关,如:金属与空气中的氧气、水蒸气接触易生锈;同时也与金属的内在结构有关,不同的金属,生锈的难易程度不同。
根据金属锈蚀的条件,人们采取了一系列措施以防止金属生锈,如在金属表面涂上一层保护膜(刷油漆、涂油) ,以及改变金属的结构(掺入一些其他成分)等。
4、废弃金属将对环境造成严重的污染,因此,要尽可能地使金属循环再生。
五、材料的发展1、合金材料:把一种金属跟其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。
2、无机非金属材料:如水泥、陶瓷、玻璃等。
3、有机合成材料:如合成塑料、合成纤维、合成橡胶等。
4、新型材料:如纳米材料、碳纤维等。
5、在合成材料的制造过程中,为了减少或消除对环境的污染,需要设计绿色工艺,以提高原料的利用率,增加产品的产量,同时降低生产对环境的污染。

九年级科学上第二章《物质转化与材料利用》知识点班级__________ 姓名_______________一、物质的分类:1、分类法就是根据事物的特点把事物分别归类。
分类时需要依据一定的标准,根据不同的标准可以把事物分为不同的类别。
如:对氯化钠、硫酸、氧气、醋酸、氯气、氧化镁、高锰酸钾进行分类为例: ⑴按颜色分类: ⎪⎪⎩⎪⎪⎨⎧紫红色:高锰酸钾黄绿色:氯气白色:氧化镁氧气、醋酸无色:氯化钠、硫酸、⑵按状态分类: ⎪⎩⎪⎨⎧、高锰酸钾固态:氯化钠、氧化镁液态:硫酸、醋酸气态:氧气、氯气 此外对物质还可按照溶解性、导电性等不同的标准进行分类。
⑶物质按组成分类:(熟记)纯净物根据 元素组成 不同,可分为 单质 和 化合物 两大类。
A .单质:由 一种元素 组成的纯净物。
如氧气、氮气、铁、硫等。
注意:由同种元素组成的物质,可能是单质,也可能是混合物。
①单质按性质不同分 金属 和 非金属 : 金属如铁,铜、镁等; 非金属如:氧气、碳、硫等。
金属与非金属物理特性的比较:注意:金属的导电性强弱顺序为:银>铜>铝>铁。
人们常根据金属的一般属性和每种金属的独特性质,如密度、外表、价格等来选择使用金属。
如金具有光泽好、化学性质稳定等特点,可做金饰品;铜的导电性好,可用做导线。
B .化合物:由 两种或两种以上的元素 组成的纯净物。
如水、硫酸、烧碱、食盐等。
化合物可分为: 有机化合物 和 无机化合物 。
⑴有机化合物:含 碳 的化合物,简称有机物。
注意:a .有机化合物一定含有碳元素.但含有碳元素的化合物不一定是有机化合物,例如CO 、CO 2、H 2CO 3、Na 2CO 3 等碳酸盐就属于无机化合物。
b .最简单的有机物是甲烷(CH 4)。
⑵无机化合物:不含碳元素 的化合物。
但包括CO 、CO 2、H 2CO 3、Na 2CO 3 等碳酸盐。
无机化合物可分为: 氧化物 、 酸 、 碱 和 盐 。

第2章物质转化与材料利用第1节金属材料一、知识与技能1.了解金属的物理特征及常见金属的特性和应用,能区分金属和非金属;2.认识合金,能说出合金和纯金属在组成和性能上的区别,知道合金比纯金属用途更广泛;3.知道生铁和钢等重要合金材料。
二、过程与方法1.学习收集、整合信息的方法;2.学习设计和进行对比实验的研究方法,在探究过程中培养学生观察、分析、归纳的能力。
三、情感与价值观1.认识金属材料在生产、生活和社会发展中的重要作用,初步形成“物质性质决定物质用途,用途体现其性质”的观念;2.培养学生全面、综合分析问题的能力及合理使用金属保护金属资源的意识。
1.金属材料的物理性质2.物质性质与用途的关系1.培养学生运用探究方法得出相关结论的能力2.提高学生综合分析问题的能力展示:一组金属制品的图片(马踏飞燕、司母戊鼎、铝合金制品、日常金属用品)。
提问:图片中的物品都是由什么材料制成的?提问:(1)生活、生产中常用金属有哪些?(2)你知道人类目前用途最广的金属(铜、铁、铝)被人类应用的时间前后吗?录像展示:人类利用金属的发展史;过渡:本节课我们就来学习金属材料的相关知识。
一、探究金属的物理性质和决定用途的因素讲述故事:1912年,英国探险队的船只,在去南极的途中,因天气十分寒冷,可是用于取暖的煤油却漏光了,以致探险队员全部冻死在南极冰原。
原来装煤油的铁桶是用锡焊接的,而锡却莫名其妙地化为了灰尘。
1867年冬天,俄国彼得堡海军仓库的大批锡砖,一夜之间不翼而飞,留下了泥土一样的灰色粉末。
提问:①听了上面两个小故事,你能猜出产生事故的原因吗?②在日常生活中,你碰到过类似因为不恰当使用金属而导致的尴尬事吗?过渡:看来熟悉金属材料的性质非常重要,我们一起通过科学探究得到我们想知道的知识。
活动探究:利用发给小组的金属材料进行实验,通过实验现象并结合生活经验总结金属有哪些共同的物理性质。
总结:①常温下是固体(汞除外)②有金属光泽③有延展性④有良好的导电性和导热性⑤密度较大⑥熔点较高。

第1节金属材料(一)金属与非金属2.金属的用途物质的性质决定物质的用途,物质的用途反应物质的性质决定性质 . 一用途反映(二)常见金属材料1.合金1)定义:把一种金属踉其他金属(或非金属)熔合而成的具有金属特性的物质,属于混合物2)性能a)合金的硬度一般大于组成它们的金属b)合金的强度一般高壬组成它们的金属(韧性好、耐拉伸、耐弯曲、耐压打)c)合金的熔点一般低于组成它们的金属d)合金的抗腐蚀能力一般强于组成它们的金属2.钢1)组成:由碳和铁等元素形成的合金2)性能:质地坚硬,有弹性和延展性,机械性能好3)用途:制作汽车车身、刀具等(三)金属的污染和回收利用1.金属的污染1)金属一般不会自行分解,会影响土质2)金属的氧化和锈蚀也会污染环境,危害生态环境3)像铅、镉等有毒的重金属被腐蚀之后会溶于水形成金属离子,污染土壤和地下水源2.重金属污染指由重金属或其化合物造成的环境污染,主要由采矿、废气排放、污水灌溉和使用重金属制品等认为因素所致3.金属的回收利用1)普遍回收的金属包括:铝、铅、铁、铜、锡等2)回收旧金属的意义:节约资源和能源:减少环境污染第2节金属的化学性质(一)金属与氧气的反应232.铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,因此铝具有良好的抗腐蚀性能(二金属与盐酸、稀硫酸的反应 A.金属与盐酸、稀硫酸的反应1.单质铁与稀盐酸、稀硫酸发生反应时,生成的是亚铁盐,且亚铁盐溶液都为浅绿色2.硝酸和浓硫酸具有强氧化性,与金属反应不生成H2,而生成水2Fe+6H2sO4(浓)=Fe2(SO4)3+3SO2个+6H2OFe+4HNO3^)=Fe(NO3)3+NO个+2H2OFe+6HNO3(浓)=Fe(NO3)3+3NO2个+3H2OB.置换反应1.定义:由一种单质与一种化合物反应,生成另一种单质和化合物的反应。
置换反应是化学基本反应类型之一2.特征:反应物和生成物都是一种单质和一种化合物3.通式:A + BC - B + AC(三)金属的活动性顺序A.金属活动性顺序KCa Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性逐渐减弱B.金属活动性顺序在实际应用中的意义1.可判断金属的化学活动性在金属活动性顺序中,金属的位置越靠前,它的活动性就越强2.可判断金属能否与酸发生置换反应而产生氢气在金属活动性顺序中,排在氢前面的金属能置换出盐酸、稀硫酸里的氢,排在氢后面的金属不能置换酸里的氢3.可判断金属能否跟盐溶液发生置换反应在金属活动性顺序中,只有排在前面的金属,才能把排在后面的金属从它们的可溶性盐溶液里置换出来(前金置后金,除了K、Ca、Na)。