小结:浓度、压强、温度催化剂的的改变影响单位体积内的活化分子数 ;
温度和催化剂的改变影响活化分子的百分数
催化剂:一般是加快反应速率。使用时要注意温度及防止催化剂中毒
注:催化剂对活化能的影响:改
变了反应的历程,使发生的每一
次反应所需的活化能降低
6、其他因素:光辐射、放射线辐照、超声波、电弧、
强磁场、高速研磨等也能影响化学反应速率
(2)不能作为“标志”的四种情况
①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。
②恒温恒容下的体积不变的反应,体系的压强或总物质的量不再随时间而变化,如
2HI(g) ⇌H2(g)+I2(g)。
③全是气体参加的体积不变的反应,体系的平均相对分子质量不再随时间而变化,如
2HI(g) ⇌H2(g)+I2(g)。
3、有效碰撞
(1)定义:能够发生化学反应的碰撞叫做有效碰撞。
(2)条件: ①分子必须具有一定的能量,即活化分子(能够发生有
效碰撞的分子)
②有合适的取向
活化分子具有的平均能量与反应物分子具有的平均能量
4、活化能: 之差,叫做反应的活化能
E1表示反应物的活化能
E2表示活化分子变成生成物分子放出的能量
E1-E2表示反应热
3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、
实验室中的实际问题,能思考化学反应条件的选择和优化
4.针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析
NO.1
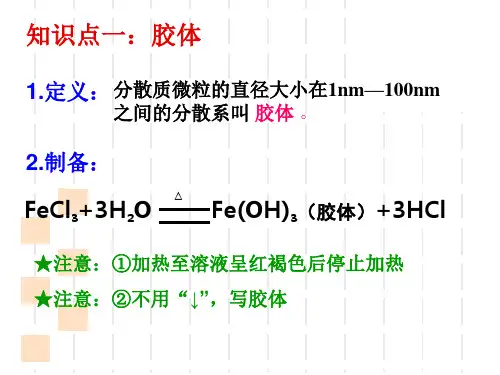
知识点一
化学反应速率及其影响因素
知识网络
1.注意事项:
①反应方程式中各物质的化学计量数之比等于各物质的化学反应速率之