化学选修5拓展复习材料
- 格式:doc
- 大小:870.00 KB
- 文档页数:13

化学选修5期末备考全册总复习第一章复习【本章重点】1.熟知常见有机物的类别及其结构特点。
2.掌握同分异构体的概念、类别、书写及判断方法。
3.掌握有机物命名的方法原则。
4.会确定有机物的实验式和分子式。
【考点归纳】考点一有机化合物的分类1. 按碳架分类:有机化合物是以碳为骨架的,可根据碳原子结合而成的基本骨架不同,分成链状化合物和环状化合物。
(1)链状化合物:化合物分子中的碳原子连接成链状,因油脂分子中主要是这种链状结构,因此又称为脂肪族化合物。
如:丙烷(CH3CH2CH3)、正丁醇(CH3CH2CH2CH2OH)、丙酸(CH3CH2COOH)。
(2)环状化合物:化合物分子中的碳原子连接成环状结构,故称为碳环化合物。
碳环化合物又可分成脂环族化合物和芳香族化合物。
①脂环族化合物:这类化合物的性质与前面提到的脂肪族化合物相似,只是碳链连接成环状,如:环戊烷()、环己醇()、氯代环己烷()。
②芳香族化合物:化合物分子中含有一个或多个苯环,它们在性质上与脂环族化合物不同,具有一些特性。
如:甲苯()、苯甲酸()、萘()。
2. 按官能团分类:官能团是决定有机化合物主要性质和反应的原子或原子团。
官能团是有机化合物分子中比较活泼的部位,一旦条件具备,它们就充分发生化学反应。
含有相同官能团的有机化合物具有类似的化学性质。
例如:丙酸和苯甲酸,因分子中都含羧基(—COOH),因此都具有酸性。
因此将有机化合物按官能团进行分类,便于对有机化合物的共性进行研究。
【考点练习】1. 下列对有机化合物的分类结果正确的是( )A.乙烯CH2CH2、苯、环己烷都属于脂肪烃B.苯、环戊烷、环己烷同属于芳香烃C.乙烯CH2===CH2、乙炔CH CH同属于烯烃D.同属于环烷烃解析:烷、烯、炔都属于脂肪链烃,而苯、环己烷、环戊烷都属于环烃,而苯是环烃中的芳香烃。
环戊烷、环丁烷及乙基环己烷均是环烃中的环烷烃。
答案:D2. 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如下图。

第一单元糖类油脂疑难拓展拓展点一葡萄糖的氧化性与还原性葡萄糖分子中含有醛基和醇羟基,可发生还原、氧化、加成、酯化等反应。
1. 还原反应(加成反应)2. 氧化反应(1)银镜反应(2)菲林反应葡萄糖除了能被Ag(NH3)2OH、新制Cu(OH)2悬浊液等弱氧化剂氧化外,还能被酸性KMnO4溶液、溴水等强氧化剂氧化,而使它们褪色。
(3)生理氧化反应C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)∆H = —2804kJ/mol葡萄糖在人体组织中发生缓慢氧化,放出热量,提供生命活动所需要的能量。
3. 酯化反应4. 发酵生成酒精C6H12O6酒化酶————→2C2H5OH+2CO2↑拓展点二糖类水解的条件1.蔗糖和麦芽糖:稀硫酸作催化剂,水浴加热。
2.淀粉:稀硫酸或酶作催化剂,水浴加热。
3.纤维素:较浓的硫酸作催化剂,小火微热。
拓展点三淀粉水解程度的判断淀粉在酸的作用下能够发生水解反应最终生成葡萄糖。
反应物淀粉遇碘能变蓝色,不能发生银镜反应(或菲林反应);产物葡萄糖遇碘不能变蓝色,能发生银镜反应(或菲林反应)。
据此可以判断淀粉在水溶液中是否已发生了水解和水解进行的程度。
(1)如果淀粉还没有水解,其溶液中没有葡萄糖,则不能发生银镜反应。
(2)如果淀粉已完全水解,其溶液中没有淀粉,遇碘则不能变蓝色。
(3)如果淀粉仅部分水解,其溶液中既有淀粉,还有葡萄糖。
则既能发生银镜反应,又能遇碘变成蓝色。
注意:检验葡萄糖时,必须先入NaOH溶液中和作催化剂的稀硫酸,再加入银氨溶液或新制氢氧化铜悬浊液进行检验。
拓展点四由淀粉(或纤维素)制乙醇的多步反应淀粉淀粉酶————→麦芽糖催化剂————→△葡萄糖酒化酶————→乙醇(C6H10O5)n + nH2O 催化剂————→△nC6H12O6C6H12O6酒化酶————→2C2H5OH+2CO2↑计量关系:(C6H10O5)n ~nC6H12O6~2nC2H5OH拓展点五肥皂的制取1.制肥皂的关键问题是各种原料的配料比和皂化反应进行的程度。

高中化学选修 5 第五章期末复习一点通【本章重点】1. 掌握加聚反应和缩聚反应的原理。
2. 掌握判断高聚物单体的方法。
3. 掌握有机推断题的解答方法。
【考点归纳】考点一高分子的结构与性质线型高分子体型( 网状) 高分子分子中的原子以共价键相连,构成一分子链与分子链之间还有许多共价键交结构条很长的卷曲状态的“链”联起来,形成三维空间的网状结构溶解性能缓慢溶解于适当溶剂很难溶解,但往往有一定程度的胀大性能具有热塑性,无固定熔点具有热固性,受热不熔化特性强度大、可拉丝、吹薄膜、绝缘性好强度大、绝缘性好,有可塑性常见物质聚乙烯、聚氯乙烯、天然橡胶酚醛树脂、硫化橡胶1. 高分子化合物有机高分子化合物有淀粉、纤维素、蛋白质、天然橡胶。
(2) 按照高分子化合物分子链分类,可分为线型高分子、支链型高分子和体型高分子。
(3) 按照高分子化合物受热时的不同行为分类,可分为热塑性高分子和热固性高分子。
(4)按照高分子化合物的工艺性质和使用分类,可分为塑料、橡胶、纤维、涂料、黏合剂 和密封材料。
3. 加聚反应(1) 加聚反应是合成高分子化合物的基本反应之一,或三键 ) 。
(2) 高分子化合物由链节和聚合度共同构成。
加聚产物的链节与对应单体组成相同。
(3) 链节上只有碳原子的聚合物为加聚产物。
(4) 加聚产物寻找单体的口诀为单键两两断,双键四个碳;单键变双键,双键变单键。
发生加聚反应的单体具有不饱和键( 双键加聚物方法 单体(1) 高分子化合物:有许多小分子化合物以共价键结合成的、相对分子质量很高(通常为104 ~106)的一类化合物。
也称聚合物或高聚物。
(2) 单体:用来合成高分子化合物的小分子化合物。
(3) 链节:组成高分子链的化学组成和结构均可以重复的最小单位。
也可称为最小结构单元,是高分子长链中的一个环节。
(4) 链节数:高分子链节的数目,也称重复结构单元数,以n 表示。
2. 高分子化合物的分类(1)按照高分子化合物的来源分类,可分为天然高分子化合物和合成高分子化合物。

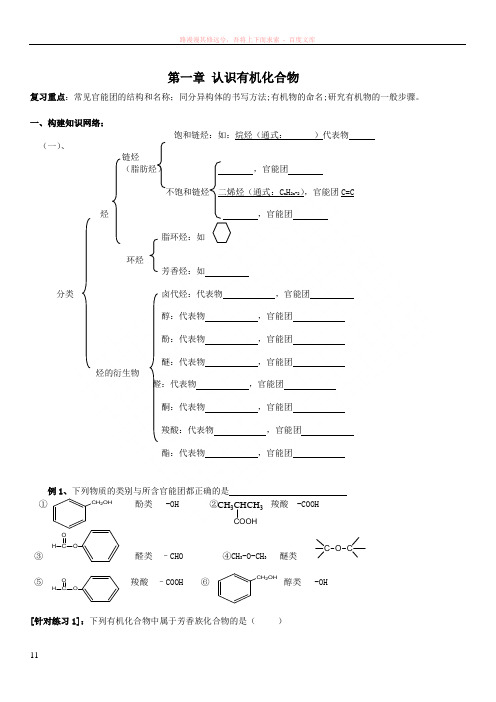
第一章 认识有机化合物复习重点:常见官能团的结构和名称;同分异构体的书写方法;有机物的命名;研究有机物的一般步骤。
一、构建知识网络:饱和链烃:如:烷烃(通式: )代表物(一)、链烃(脂肪烃) ,官能团不饱和链烃 二烯烃(通式:C n H 2n-2),官能团C=C烃 ,官能团脂环烃:如环烃芳香烃:如分类 卤代烃:代表物 ,官能团醇:代表物 ,官能团酚:代表物 ,官能团醚:代表物 ,官能团 烃的衍生物醛:代表物 ,官能团酮:代表物 ,官能团羧酸:代表物 ,官能团酯:代表物 ,官能团例1、下列物质的类别与所含官能团都正确的是① 酚类 -OH ② 羧酸 -COOH ③ 醛类 –CHO ④CH 3-O-CH 3 醚类⑤ 羧酸 –COOH ⑥ 醇类 -OH[针对练习1]:下列有机化合物中属于芳香族化合物的是( )CH 2OHCH 3CHCH 3COOH H O OO CH C OOCH 2OH-C ≡C -CH =CH -CH 3①CH 3CH 2CH(CH 3)2;②CH 3;③CH 2CH 2CH 2CH 2CH 2;④OH;⑤;⑥H 3C NO 2A .②④⑥B .②⑤⑥C .③④⑤D .③④⑥ (二)、有机物中碳原子的成键特点:结构特点 定义:同分异构现象 异构,如分类 异构,如 异构,如 习惯命名法有 命名 烷烃命名步骤: 机 系统命名法 烯烃、炔烃命名步骤: 物 苯的同系物命名基本步骤:分离、提纯→确定 →确定 →确定 蒸馏(依据): 分离、提纯 重结晶(苯甲酸重结晶步骤): 研究有机 萃取 物的步骤和方法 实验式 :确定方法:分子中各元素原子的个数比 各元素的质量分数之比 =方法 各原子的相对原子质量之比 实验式 分子式确定相对分子质量——质谱法 红外光谱(作用):分子结构鉴定核磁共振氢谱(作用):[针对练习]:2、某烃结构简式如下:二、重难点突破: (一) 同系物的判断规律[针对练习]:6、下列说法不正确的是()A.分子式为C3H8与C6H14的两种有机物一定互为同系物B.具有相同通式的有机物不一定互为同系物C.两个相邻同系物的相对分子质量数值一定相差14D.分子组成相差一个或若干个CH2原子团的化合物必定互为同系物7、下列物质一定属于同系物的是()A.①和②B.④和⑥C.⑤和⑦D.⑤和⑧(二)同分异构体1.书写口诀:2.同分异构体数目的判断方法▲记忆法:记住已掌握的常见的同分异构体数。

第4章糖类 油脂 氨基酸和蛋白质有机合成及其应用一、糖类1.糖类的概念和分类:(1)概念:从分子结构上看,糖类可定义为多羟基醛、多羟基酮和它们的脱水缩合物。
(2)组成:主要包含碳、氢、氧三种元素。
大多数糖类化合物的通式为Cn(H2O)m ,所以糖类也叫碳水化合物。
(3)分类。
2.单糖——葡萄糖与果糖:(1)组成和分子结构。
分子式 结构简式 官能团 类别 葡萄糖__________________________ _____ 多羟基醛果糖 ______ _______________ _____ _____多羟基酮(2)葡萄糖的化学性质。
①氧化反应。
a.与银氨溶液反应的化学方程式为_____________________________________________________。
b.与新制Cu(OH)2悬浊液反应的化学方程式为__________________________________________。
c.人体内催化氧化的化式为C 6H 12O 6(s)+6O 2(g)→6CO 2(g)+6H 2O (l) ②加成反应。
葡萄糖可与H 2发生加成反应生成己六醇: 催化剂CH 2OH(CHOH)4CHO+H 2CH 2OH(CHOH)4CH 2OH 。
③发酵。
酒化酶C 6H 12O 6 2CO 2+2C 2H 5OH 。
3.双糖——蔗糖与麦芽糖:(1)蔗糖与麦芽糖的比较。
很多摩尔单糖2~10摩尔单糖蔗糖麦芽糖分子式________________无醛基有醛基结构特点互为___________化学性质能发生_________能发生_________和_______水解产物(2)主要化学反应。
①水解反应。
a.蔗糖的水解反应在稀硫酸催化作用下,蔗糖水解生成一分子葡萄糖和一分子果糖,反应方程式为_____________________________________________。
一、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH2原子团,但通式相同组成上相差一个或几个CH2原子团不一定是同系物,如CH3CH2Br和CH3CH2CH2CI都是卤代烃,且组成相差一个CH2原子团,但不是同系物。
(马上点标题下蓝字"高中化学"关注可获取更多学习方法、干货!)5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1 —丁烯与2 —丁烯、1—丙醇与2 —丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1 —丁炔与1,3 —丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:卩疋曲申只能是烷畐而且只有碳链异构.如HCHXCH2)3CH J.CH J CH(CH3)CH:CH3. C(CHa)4⑵C山X 单晞烽.环烷婭CH:=CHCH:CH;. CH J CH=CHCH J >CHy=C(CH5)3.晋-甲i , /貫CHj CHi—CH-CH]烘怪、二烯婭.如 2 CHXCHiCHg CH J C^CCH J,CH^CHCH-CH J⑷芳香烧(苯及其同系物驚如CHa-Q-CHa腔和月旨防醇.眇飞如;CH;CH:CHX)H. CHiCH(OH)CHh CH5OCH<H J⑹C』匕CH 醛.酮r环貶、环醇F烯基醇。
【最新整理,下载后即可编辑】化学选修五教材实验知识复习以下为本人建议的实验复习重点。
选修四的实验:1.中和反应反应热的测定;2.实验测定酸碱滴定曲线(或中和滴定);3.探究盐溶液的酸碱性;选修五的实验:1.溴乙烷的取代反应;2.乙醇和苯酚的性质;3.乙醛的性质;4.乙酸乙酯的水解反应;5.糖类的性质;6.蛋白质的性质。
1.P17.蒸馏实验:防止液体暴沸,使液体平稳沸腾,应加入素烧瓷片(未上釉的废瓷片);冷却水的通入方向:无论冷凝管横放、竖放,都下进上出,若上进下出,易形成空气泡,影响冷凝效果。
▲2.p18:苯甲酸的重结晶:为了减少趁热过滤过程中损失苯甲酸,应在趁热过滤前加入少量蒸馏水,避免立即结晶,且使用短颈漏斗。
较为复杂的操作:漏斗烘热、滤纸用热液润湿、马上过滤、漏斗下端越短越好。
3.p19:萃取:萃取包括液-液萃取和固-液萃取。
常用的萃取等。
剂有乙醚、石油醚、二氯甲烷、CCl44.p19:实践活动:用粉笔分离菠菜叶中的色素,研磨时用到仪器研钵。
5.p32:乙炔的实验室制取及性质:(1)为减缓电石与水的反应速率,实验室常滴加饱和食盐水而不直接滴加水。
(2)除去乙炔气体中的杂质气体H 2S 、PH 3,用硫酸铜溶液。
(3)该实验装置不能用启普发生器,原因是:反应放出大量热,因受热不均易使启普发生器炸裂;生成的氢氧化钙糊状物易堵塞导管。
6.p37:实验室制溴苯、硝基苯的实验方案:(1)溴苯的制取:把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。
用带导管的瓶塞塞紧瓶口(如图2-4),跟瓶口垂直的一段导管可以兼起冷凝器的作用。
在常温时,很快就会看到,在导管口附近出现白雾(由溴化氢遇水蒸气所形成)。
反应完毕后,向锥形瓶内的液体里滴入AgNO 3溶液,有浅黄色溴化银沉淀生成。
把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体。
不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显褐色。
一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(...2.F.2.,沸点为....-.29.8....CCl....℃.)......CH..3.Cl..,.沸点为...-.24.2....℃.).氟里昂(氯乙烯(...HCHO....,沸点为....-.21..℃.).....℃.).甲醛(......,沸点为....CH....-.13.9..2.==CHCl氯乙烷(..2.C.l.,沸点为....℃.).一溴甲烷(CH3Br,沸点为3.6℃)....12.3..3.CH....CH四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3环己烷甲醇CH3OH 甲酸HCOOH溴乙烷C2H5Br 乙醛CH3CHO 溴苯C6H5Br 硝基苯C6H5NO2★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态★特殊:苯酚(C6H5OH)、苯甲酸(C6H5COOH)、氨基酸等在常温下亦为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示:☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体;☆部分被空气中氧气所氧化变质的苯酚为粉红色;☆2,4,6—三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂);☆苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液;☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
5.有机物的气味许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:☆甲烷无味☆乙烯稍有甜味(植物生长的调节剂)☆液态烯烃汽油的气味☆乙炔无味☆苯及其同系物芳香气味,有一定的毒性,尽量少吸入。
☆一卤代烷不愉快的气味,有毒,应尽量避免吸入。
☆二氟二氯甲烷(氟里昂)无味气体,不燃烧。
☆ C4以下的一元醇有酒味的流动液体☆C5~C11的一元醇不愉快气味的油状液体☆C12以上的一元醇无嗅无味的蜡状固体☆乙醇特殊香味☆乙二醇甜味(无色黏稠液体)☆丙三醇(甘油)甜味(无色黏稠液体)☆苯酚特殊气味☆乙醛刺激性气味☆乙酸强烈刺激性气味(酸味)☆低级酯芳香气味☆丙酮令人愉快的气味二、重要的反应1.能使溴水(Br2/H2O)褪色的物质(1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯(2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质(1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应)(2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应(取代反应)与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体。
与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体。
4.既能与强酸,又能与强碱反应的物质(1)2Al + 6H+ == 2 Al3+ + 3H2↑2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑(2)Al2O3 + 6H+ == 2 Al3+ + 3H2O Al2O3 + 2OH-== 2 AlO2- + H2O(3)Al(OH)3 + 3H+ == Al3+ + 3H2O Al(OH)3 + OH-== AlO2- + 2H2O(4)弱酸的酸式盐,如NaHCO3、NaHS等等NaHCO3 + HCl == NaCl + CO2↑ + H2O NaHCO3 + NaOH == Na2CO3 + H2ONaHS + HCl == NaCl + H2S↑NaHS + NaOH == Na2S + H2O(5)弱酸弱碱盐,如CH3COONH4、(NH4)2S等等2CH3COONH4 + H2SO4 == (NH4)2SO4 + 2CH3COOHCH3COONH4 + NaOH == CH3COONa + NH3↑+ H2O(NH4)2S + H2SO4 == (NH4)2SO4 + H2S↑(NH4)2S +2NaOH == Na2S + 2NH3↑+ 2H2O(6)氨基酸,如甘氨酸等H2NCH2COOH + HCl → HOOCCH2NH3ClH2NCH2COOH + NaOH → H2NCH2COONa + H2O(7)蛋白质蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应。
5.银镜反应的有机物(1)发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)(2)银氨溶液[Ag(NH3)2OH](多伦试剂)的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。
(3)反应条件:碱性、水浴加热.......若在酸性条件下,则有Ag(NH3)2+ + OH- + 3H+ == Ag+ + 2NH4+ + H2O而被破坏。
(4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出(5)有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == Ag(NH3)2OH + 2H2O银镜反应的一般通式:RCHO + 2Ag(NH3)2OH 2 A g↓+ RCOONH4 + 3NH3 + H2O【记忆诀窍】:1—水(盐)、2—银、3—氨甲醛(相当于两个醛基):HCHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2CO3 + 6NH3 + 2H2O乙二醛:OHC-CHO + 4Ag(NH3)2OH4Ag↓+ (NH4)2C2O4 + 6NH3 + 2H2O甲酸:HCOOH + 2 Ag(NH3)2OH 2 A g↓+ (NH4)2CO3 + 2NH3 + H2O葡萄糖:(过量)CH2OH(CHOH)4CHO +2Ag(NH3)2OH2A g↓+CH2OH(CHOH)4COONH4+3NH3 + H2O(6)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~4Ag(NH)2OH~4 Ag6.与新制Cu(OH)2悬浊液(斐林试剂)的反应(1)有机物:羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖)、甘油等多羟基化合物。
(2)斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液(即斐林试剂)。
(3)反应条件:碱过量、加热煮沸........(4)实验现象:① 若有机物只有官能团醛基(—CHO ),则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有(砖)红色沉淀生成; ② 若有机物为多羟基醛(如葡萄糖),则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有(砖)红色沉淀生成;(5)有关反应方程式:2NaOH + CuSO 4 == Cu(OH)2↓+ Na 2SO 4RCHO + 2Cu(OH)2RCOOH + Cu 2O↓+ 2H 2O HCHO + 4Cu(OH)2CO 2 + 2Cu 2O↓+ 5H 2OOHC-CHO + 4Cu(OH)2HOOC-COOH + 2Cu 2O↓+ 4H 2OHCOOH + 2Cu(OH)2CO 2 + Cu 2O↓+ 3H 2OCH 2OH(CHOH)4CHO + 2Cu(OH)2CH 2OH(CHOH)4COOH + Cu 2O ↓+ 2H 2O(6)定量关系:—COOH ~½ Cu(OH)2~½ Cu 2+ (酸使不溶性的碱溶解)—CHO ~2Cu(OH)2~Cu 2OHCHO ~4Cu(OH)2~2Cu 2O7.能发生水解反应的有机物是:卤代烃、酯、糖类(单糖除外)、肽类(包括蛋白质)。