化学选修5 第三章复习总结
- 格式:ppt
- 大小:1.92 MB
- 文档页数:35

高中化学选修5_有机化学总复习高中化学选修 5——有机化学总复习在高中化学的学习中,选修 5 的有机化学是一个重要且富有挑战性的部分。
为了帮助同学们更好地掌握这部分知识,进行一次全面的总复习是非常必要的。
首先,让我们来回顾一下有机化学的基本概念。
有机化合物是指含碳的化合物,但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐等,由于它们的性质与无机物相似,通常不被视为有机化合物。
碳原子的独特结构使得它能够形成多种多样的化学键,从而构建出复杂而丰富的有机分子。
碳原子可以通过单键、双键和三键与其他原子相连,形成链状、环状等不同的结构。
这就为有机化合物的多样性奠定了基础。
有机化合物的分类是我们学习的重要内容之一。
按照官能团的不同,有机化合物可以分为烃类(包括烷烃、烯烃、炔烃和芳香烃)、卤代烃、醇、酚、醚、醛、酮、羧酸、酯等。
烷烃是最简单的一类烃,其通式为 CₙH₂ₙ₊₂。
它们的化学性质相对稳定,通常在光照条件下能与卤素单质发生取代反应。
烯烃含有碳碳双键,通式为 CₙH₂ₙ。
双键的存在使得烯烃具有较强的反应活性,能与卤素单质、氢气、水等发生加成反应。
炔烃则含有碳碳三键,通式为 CₙH₂ₙ₋₂。
它们的化学性质与烯烃类似,但反应活性可能更强。
芳香烃,如苯,具有特殊的环状结构和独特的化学性质。
苯环上的氢原子可以在一定条件下被取代,而苯环本身在特定条件下也能发生加成反应。
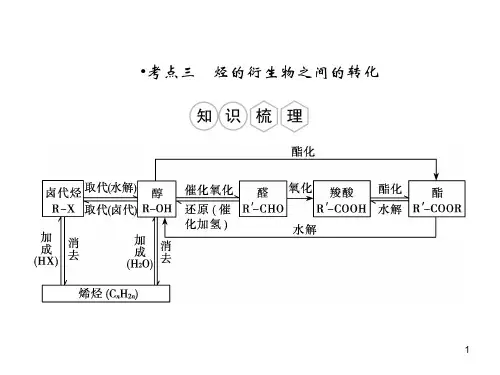
卤代烃是烃分子中的氢原子被卤素原子取代后的产物。
它们在有机合成中起着重要的桥梁作用,可以通过水解反应转化为醇,也可以通过消去反应生成烯烃。
醇类化合物,官能团为羟基(—OH)。
根据羟基所连接的碳原子类型,醇可以分为伯醇、仲醇和叔醇。
醇能发生氧化反应、消去反应等。
酚类的官能团也是羟基,但羟基直接连接在苯环上。
酚具有一定的酸性,能与氢氧化钠等碱反应。
醚的官能团是醚键(—O—),结构相对较为稳定。
醛和酮的官能团分别为醛基(—CHO)和羰基()。
醛能被氧化为羧酸,也能与氢气发生加成反应生成醇。
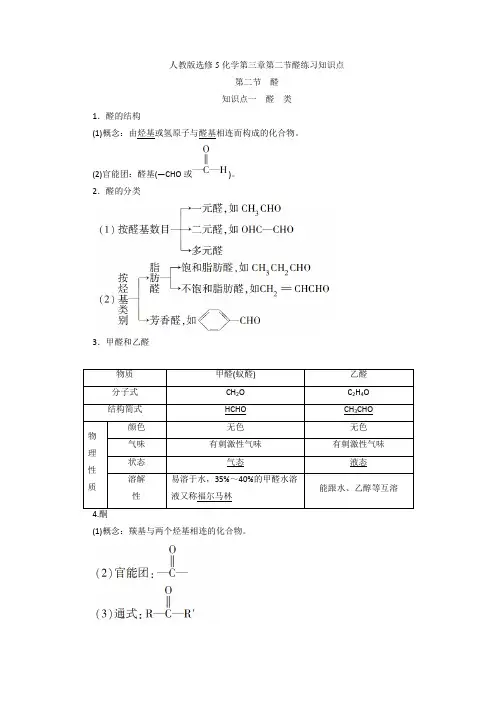
人教版选修5化学第三章第二节醛练习知识点第二节醛知识点一醛类1.醛的结构(1)概念:由烃基或氢原子与醛基相连而构成的化合物。
(2)官能团:醛基(—CHO或)。
2.醛的分类3.甲醛和乙醛物质甲醛(蚁醛)乙醛分子式CH2O C2H4O 结构简式HCHO CH3CHO物理性质颜色无色无色气味有刺激性气味有刺激性气味状态气态液态溶解性易溶于水,35%~40%的甲醛水溶液又称福尔马林能跟水、乙醇等互溶(1)概念:羰基与两个烃基相连的化合物。
(4)代表物:丙酮,其结构简式为CCH3OCH3,不能被银氨溶液、新制的Cu(OH)2等弱氧化剂氧化,能与H2发生加成反应。
1.下列物质中不属于醛类的是()解析:选B。
①属于醛,②属于酯类,③属于醛,④中含有氯元素,不属于醛。
2.下列关于醛的说法中正确的是()A.所有的醛都有醛基和烃基B.一元醛的通式为C n H2n OC.醛的官能团为—COHD.所有的醛都能发生银镜反应解析:选D。
A项,甲醛(HCHO)中没有烃基,B项为饱和一元醛的通式,C项醛的官能团为—CHO。
醛和酮的区别与联系类别醛酮区别官能团官能团位置碳链末端碳链中间简写形式类别醛酮联系通式饱和一元醛:C n H2nO饱和一元酮:C n H2n O 同分异构现象相同碳原子数的饱和一元醛和饱和一元酮互为同分异构体下列物质分子结构中含有醛基,但是不属于醛的是()[解析]醛的结构为R—CHO,其中R为H或烃基,A项物质不含—CHO,B、C、D项中含—CHO,但B项物质—CHO连接的不是H或烃基,B为甲酸乙酯,不属于醛类。
[答案]B能发生银镜反应的有机物是不是都属于醛类答案:有机物只要含有醛基就可以发生银镜反应,能发生银镜反应的不一定都是醛,可能是其他含有醛基的有机物。
例如:甲酸,甲酸某酯,另外,还有将要学习的葡萄糖等。
醛的概念及性质1.下列有关说法正确的是()A.含有醛基的物质一定是醛B.含醛基的物质能发生银镜反应,但不能使KMnO4酸性溶液褪色C.醛类物质常温、常压下都为液体或固体D.醛与H2发生的加成反应也是还原反应解析:选D。

高中化学学习材料唐玲出品章末系统总结一、重点知识梳理二、实验专项探究——有机物的分离和提纯1.分离与提纯的区别。
分离是把混合物中的各物质逐一分开,得到各种纯净物,分开后的物质应该尽量减少损失,各组分要尽量纯净。
提纯是将物质中的杂质除掉而得到纯净物质,除掉的杂质可以不进行恢复。
2.分离提纯的原则。
(1)不增:不增加新的杂质。
(2)不减:不减少被提纯的物质。
(3)易分离:被提纯物质与杂质易分离。
(4)易复原:被提纯物质转变成其他物质后,易恢复到原来的状态。
3.分离提纯的几种思路。
(1)杂转纯:如除去Na2CO3中的NaHCO3,将混合物加热使NaHCO3全部转化为Na2CO3。
(2)杂变沉:如除去NaCl溶液中的BaCl2,先加过量Na2CO3使BaCl2转化为BaCO3沉淀,过滤后再在滤液中加盐酸。
(3)杂转气:如除去NaCl溶液中的Na2CO3,加盐酸使Na2CO3转化为CO2。
(4)萃取分:如用CCl4将碘水中的碘萃取出来并分液。
4.有机物分离提纯的常用方法。
(1)物理方法。
易错提醒在分离和提纯物质时,应依据被提纯物质的性质,选择适当的物理方法和化学方法,同时还应注意以下几个方面:(1)除杂试剂需过量。
(2)过量试剂需除尽。
(3)除去多种杂质时要考虑加入试剂的顺序。
(4)选择最佳的除杂路径。
即时训练乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。
实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:物质相对分子质量密度/(g·cm-3)沸点℃水中溶解性异戊醇88 0.812 3 131 微溶乙酸60 1.049 2 118 溶乙酸异戊酯130 0.867 0 142 难溶在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。
开始缓慢加热A,回流50 min。
反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。

章末系统总结、重点知识梳理通式:R—0H・泡和一兀醇通式:C n H2…—10H 官能团:一OH(①中性•不电离出0H-或H +空与活泼金等)反应放出③可被氧化成醛代表物:CH3CH2OH^④分子间脱水生成乙讎•分子内脱水生成乙烯区可与竣酸酯化生成酯、⑥与HX发生取代反应生成卤代泾催化剂I ①CH —CH,-H. 0 ~<H.CH^OHCH;CH:O H的制聪°°_加热、加压」_丨②淀粉发酵制C2H=OH『官能团:一OH「①易被氧化变色/—江②与Be发生取代反应酣米代表物:< 、一OH < _朋大“、一/③遇FeCl3溶液显紫色弱酸性(不能使指示剂变邑)的制取:《—:一-一" 0H■通式:R-CHO H 饱和一元醛分子式为CHO 或C H H :…O 官能团t —CHO卄辽虽化反宣:银攪反宜.与新制CuCOH'h 悬浊液反应.能便强水用MnQ 陵性擂液褪色醛类”代a^rCH.CHO 总初或反宜:牺缶竝还原成匚H .CH 2OHC LL 或 AgCH^CHO :2CH.CH ;OH-O.—— 2CH L CHO-2H ?O通式:K —COOH.t&和一元幾酸的通式齿C^Hi.-xCOOH 或匚“比“住官能团「一 COOH①具有史的澄性(醋釀盐几乎全涪于水) 芒与酣发主昌址豆应生成幽CH :COOH 制脱:乙醇■.乙盤氧化注igjtiRCOOR'.R 和应可以栢同’也寸以不同CH :COOC :H=的制 ^:CH ;COOH-C ?H :OH^—^*€H.CQOC,H=亠比 O台迸任4礎骨架的搐律和官能团的引人、转化、诺变 有机合成£有机合成路线——連合成分析法有削合成的应用二、实验专项探究一一有机物的检验和鉴别的方法1根据溶解性:通常是向有机物中加水,观察其是否溶于水, 如鉴别羧酸与四氯化碳(或烃、酯、油脂等),醇与四氯化碳(或烃、酯、 油脂等)。




人教化学选修5第三章烃的含氧衍生物章末总结【例1】已知有机物A〜I之间的转化关系如图所示:,①A 与D、B与E、I与F互为同分异构体;②加热条件下将新制Cu(0H)2悬浊液分别加入到有机物I、F中,I中无明显现象,F 中有红色沉淀生成;③C的最简式与乙炔相同,C为芳香族化合物且相对分子质量为104;④B的一种同分异构体与FeCI3发生显色反应。
,根据以上信息,回答下列问题:(1)C中含有的官能团名称为。
(2) H的结构简式为 _____ 。
(3) 反应①〜⑨中属于取代反应的是 __________ 。
(4) 写出反应⑥的化学方程式 ________________ 。
(5) 写出F与新制Cu(0H)2悬浊液反应的化学方程式【解析】由C的最简式与乙炔相同,C为芳香族化合物且相对分子质量为104,可以求出C的分子式为C8H8,结合框图中的信息A在氢氧化钠的醇溶液中生成C, B在浓硫酸作用下生成C,可知C为苯乙烯;由B氧化生成的I无醛基,可知物质B为, 物质A为,由D,转化生成的F有醛基,故物质D为,物质E为, 物质F为,物质G为。
,答案:(1)碳碳双键,【名师点拨】有机反应类型解题方法与技巧及注意点(1)解答此类试题时常用的方法有:官能团分析、官能团比较和官能团迁移。
(2) 对新型有机物的分析,要紧扣物质中的官能团,并根据官能团确定其性质。
(3) 注意在有机结构中,官能团的位置不同,其性质及反应情况有所不同。
女口:①羟基连在脂肪烃基或苯环侧链上的物质为醇,而直接连在苯环上的物质为酚。
,②与醇羟基(或卤原子)相邻的碳原子上没有氢原子,则不能发生消去反应。
③伯醇氧化生成醛(进一步氧化生成羧酸);仲醇氧化生成酮,叔醇很难被氧化。
④连在苯环上的卤原子,水解时,1mol卤原子消耗2molNaOH。
⑤ 1mol酚酯(如HCOOC6H5)水解时消耗2molNaOH。
,有机合成路线【例2】粘合剂M的合成路线如图所示:,完成下列填空:⑴写出A和B的结构简式。

重难点三苯酚的化学性质【要点解读】(1)定义:羟基与苯环上的碳原子直接相连构成的化合物叫酚强调:①在定义上去醇的定义的区别;②酚的官能团是酚羟基.(2)分子结构:分子式结构式结构简式比例模型结构特点C6H6O 苯酚分子里至少有12个原子位于同一平面内,是极性分子(3)物理性质:①颜色/状态/气味:纯净的苯酚是无色晶体,苯酚具有特殊的气味,长时间露置在空气的苯酚晶体会因被氧化而呈现粉红色,故苯酚应隔绝空气,密封保存;②熔沸点:熔点为43℃;③溶解性:常温下在水中的溶解度不大,当温度高于65℃时,则能与水以任意比互溶,苯酚易溶于乙醇等有机溶剂;④毒性:苯酚有毒,浓溶液对皮肤有强烈的腐蚀性.(4)化学性质:1)酚羟基的性质①苯酚的(弱)酸性(俗称石炭酸)1″C6H5OH+NaOH→C6H5ONa+H2O(由浑浊变澄清)2″苯酚的电离方程式:C6H5OH+H2O C6H5O-+H3O+(酸性极弱,不能使石蕊试液变红)3″往澄清的C6H5ONa溶液中通CO2C6H5ONa+CO2+H2O→C6H5OH+NaHCO3(澄清变浑浊)说明:①酸性很弱,不能使酸碱指示剂变色;②电离出H+的能力:H2CO3>C6H5OH>HCO3-,对应离子结合H+的能力:HCO3-<C6H5O-<CO32-,不管CO2量多少,溶液中通入CO2生成物一定是NaHCO3,C6H5OH不能与NaHCO3反应.C6H5OH+Na2CO3→C6H5ONa+NaHCO34″苯酚显弱酸性,能和钠反应,反应速率比乙醇、水均快.2C6H5OH+2Na→2C6H5ONa+H2↑ (醇、酚共性)②苯酚的显色反应遇FeCl3溶液显紫色,利用这一反应可用于检验苯酚或Fe3+的存在.6C6H5OH+Fe3+→Fe(C6H5O)6]3-+6H+小结:受苯环的影响,酚羟基上的H原子比醇羟基上的H原子要活泼2)苯环的性质:③苯环上的取代反应--与浓溴水的反应:有白色沉淀产生;与苯及同系物类似,苯酚也可以与卤素、硝酸、硫酸等在苯环上发生取代反应.说明:1″因三溴苯酚可溶于苯酚,所以实验时应向少量苯酚稀溶液中滴入过量浓溴水;2″溴取代在苯环的邻、对位;3″此反应很灵敏,常用于苯酚的定性检验和定量测定.苯酚与苯取代反应的比较:苯苯酚反应物液溴浓溴水反应条件使用催化剂不用催化剂取代苯环上的氢原子数1个氢原子3个氢原子(邻、对位)反应速率初始缓慢,后加快瞬时完成结论羟基使苯环上的氢原子变得更活泼了小结:由于羟基对苯环的影响,使苯环上与羟基处在邻位和对位上的氢原子活性增强,容易被取代④加成反应:因苯酚中含有苯环,所以苯酚可以和氢气发生加成3)苯环与酚羟基的共同性质⑤氧化反应A.常温下在空气中被氧气逐渐氧化而显粉红色B.可使KMnO4溶液褪色苯酚的保存:苯酚易被空气氧化,应隔绝空气,密封保存.【重难点指数】★★【重难点考向一】苯酚与浓溴水的反应【例1】关于苯和苯酚分别与溴反应的比较中不正确的是( )A.苯和液溴反应而苯酚和浓溴水反应B.二者都需要催化剂C.苯生成一溴代产物而苯酚生成三溴代产物D.反应都不需要加热【答案】B【重难点点睛】考查苯和苯酚分别与溴反应对比,苯必须与液溴反应,苯酚和浓溴水就可以发生反应且不需要催化剂,苯与液溴生成一溴苯,苯酚与溴水生成三溴苯酚,据此分析解答。

高中化学学习材料(灿若寒星**整理制作)章末系统总结一、重点知识梳理二、实验专项探究——有机物的分离和提纯1.分离与提纯的区别。
分离是把混合物中的各物质逐一分开,得到各种纯净物,分开后的物质应该尽量减少损失,各组分要尽量纯净。
提纯是将物质中的杂质除掉而得到纯净物质,除掉的杂质可以不进行恢复。
2.分离提纯的原则。
(1)不增:不增加新的杂质。
(2)不减:不减少被提纯的物质。
(3)易分离:被提纯物质与杂质易分离。
(4)易复原:被提纯物质转变成其他物质后,易恢复到原来的状态。
3.分离提纯的几种思路。
(1)杂转纯:如除去Na2CO3中的NaHCO3,将混合物加热使NaHCO3全部转化为Na2CO3。
(2)杂变沉:如除去NaCl溶液中的BaCl2,先加过量Na2CO3使BaCl2转化为BaCO3沉淀,过滤后再在滤液中加盐酸。
(3)杂转气:如除去NaCl溶液中的Na2CO3,加盐酸使Na2CO3转化为CO2。
(4)萃取分:如用CCl4将碘水中的碘萃取出来并分液。
4.有机物分离提纯的常用方法。
(1)物理方法。
方法适用范围主要仪器名称实例过滤不溶性固体与液体的分离烧杯、漏斗、玻璃棒硬脂酸(氯化钠)分液互不相溶的液体混合物分离分液漏斗硝基苯(水)蒸馏沸点差别较大的互溶液体混合物的分离蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计、酒精灯乙醇(乙醛)渗析胶粒与溶液中小分子或离子的分离半透膜、烧杯淀粉溶液(葡萄糖)盐析个别有机物的提纯—硬脂酸钠(甘油)洗气气体混合物洗气装置甲烷(甲醛)萃取分液溶质在互不相溶溶剂中溶解度不同分液漏斗溴乙烷(乙醇)、乙酸乙酯(乙醇)(2)化学方法(外加试剂法)。
方法混合物试剂洗气乙烷(乙烯) 溴的CCl4溶液乙炔(硫化氢) CuSO4溶液或NaOH溶液分液乙酸乙酯(乙酸) 饱和Na2CO3溶液溴苯(溴) NaOH溶液硝基苯(硝酸、硫酸) NaOH溶液苯(苯甲酸) NaOH溶液苯(苯酚) NaOH溶液苯(甲苯) KMnO4酸性溶液蒸馏乙醇(水) CaO乙醛(乙酸) NaOH溶液易错提醒在分离和提纯物质时,应依据被提纯物质的性质,选择适当的物理方法和化学方法,同时还应注意以下几个方面:(1)除杂试剂需过量。