试剂配制记录
- 格式:doc
- 大小:39.50 KB
- 文档页数:1

edta标准溶液的配制和标定数据记录EDTA(乙二胺四乙酸)是一种常用的络合剂,可以与金属离子形成稳定的络合物。
在分析化学中,EDTA常用于配制标准溶液并进行标定,以确定待测溶液中金属离子的浓度。
本文将介绍EDTA标准溶液的配制方法和标定数据记录。
一、EDTA标准溶液的配制1. 实验仪器和试剂准备首先准备所需的实验仪器和试剂:电子天平、容量瓶、酸洗瓶、一定浓度的EDTA四钠盐、去离子水等。
2. 配制过程(1)准备一定浓度的EDTA四钠盐溶液。
根据需要配制的浓度,称取适量的EDTA四钠盐,溶解于一定体积的去离子水中,搅拌使其充分溶解。
(2)将溶液转移至容量瓶中,用去离子水定容至刻度线,摇匀,得到EDTA标准溶液。
二、EDTA标定数据记录1. 实验仪器和试剂准备准备所需的实验仪器和试剂:容量瓶、滴定管、锥形瓶、酸洗瓶、待测金属离子溶液、甲基橙指示剂、稀硫酸等。
2. 标定过程(1)准备一定体积的待测金属离子溶液,转移至锥形瓶中。
(2)加入适量的甲基橙指示剂,使溶液呈现橙黄色。
(3)取一定体积的EDTA标准溶液,加入锥形瓶中,开始滴定。
(4)滴定时,EDTA与金属离子发生络合反应,溶液中的金属离子逐渐被EDTA配体络合,溶液颜色由橙黄色变为红色。
(5)当溶液颜色由红色变为淡红色时,表示EDTA与金属离子的配位反应已达到终点。
记录滴定所用的EDTA标准溶液的体积。
3. 数据计算(1)根据滴定所用的EDTA标准溶液的体积,计算待测金属离子的浓度。
(2)根据待测金属离子的浓度和滴定所用的待测金属离子溶液的体积,计算待测溶液中金属离子的摩尔浓度。
4. 数据记录将实验所得的数据进行记录,包括待测金属离子溶液的体积、EDTA 标准溶液的体积、计算所得的待测金属离子浓度和待测溶液中金属离子的摩尔浓度等。
总结:本文介绍了EDTA标准溶液的配制和标定数据记录方法。
配制EDTA 标准溶液时,需准备实验仪器和试剂,并按一定的配制过程进行操作。
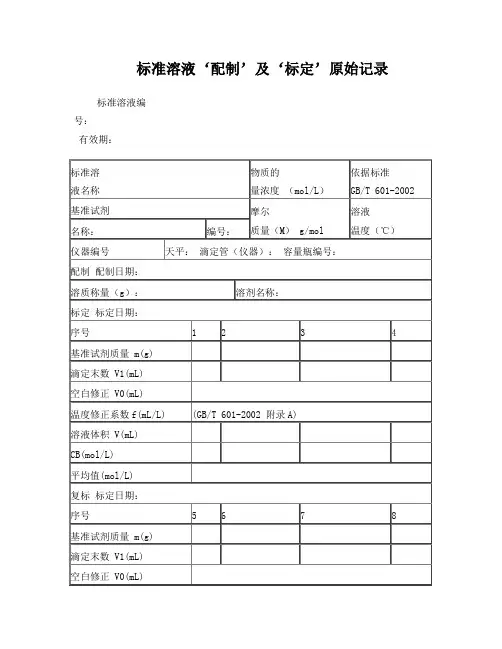
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:温度修正系数f(mL/L) (GB/T 601-2002 附录A)溶液体积 V(mL)CB(mol/L)平均值(mol/L)计算式:V=(V1-V0)×(1+f/1000)CB=1000m/(M×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度 %RH配制:取定溶 mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃ 、湿度: %RH 标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009.1-2003二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定。
2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0.0530]0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g2、数据配制人:复核人:配制日期:复核日期:稀释记录表标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理。