第2-3章玻璃的形成规律,熔体和玻璃相变分解
- 格式:ppt
- 大小:2.07 MB
- 文档页数:47








第二章 玻璃的形成规律1、混合键性为何易于形成玻璃?因为混合键既具有离子键易改变键角、易形成无对称变形的趋势,又具有共价键的方向和饱和性,不易改变键长和键角的倾向。
前者造成玻璃的长程无序;后者赋予玻璃的短程有序,因此极性共价键化合较易形成玻璃。
2、什么是3T 图?3T 图是通过T-T-T (即温度-时间-转变)曲线法,以确定物质形成玻璃的能力的大小。
3、三元系统玻璃形成区共有多少种类型?三元玻璃的形成区种类繁多,根据网络形成体的种类可以分为以下三种情况:(1)仅含有一种网络形成体(F )的三元系统,该三元系统有15种。
(2)含有两种网络形成体(F 和F ’)的三元系统。
该三元系统有五种。
(3)含有三种网络形成体的三元系统。
该三元系统只有F-F ’-F ”一种。
4、画出M 1-M 1’—F 、M 1-M 2-F 、M 1-I-F 三元系统玻璃形成区,并用文字详细说明。
(1).F-M 1-M 1’ (Li-Na-Si)M 1熔点低,M 1’场强大(2)F-M 1-M 2 (Na-Ca-Si)11*>22*(M 1场强小)M 1熔点低M 150%FM 1’(3)F-M 1-I (Li-Al-Si)在F-M 1的高M 1一端加入I 可使断网得到连接,故呈滴状突出。
5、从单键能的角度谈氧化物的分类。
根据单键强度的大小,将氧化物分为三类:键强在80kcal/mol 以上的称为玻璃形成氧化物(或网络形成体),它们自身能形成玻璃,如SiO 2、B 2O 3、P 2O 5、GeO 2等;键强在60kcal/mol 以下的称为玻璃调整氧化物(或网络外体),在通常条件下不能形成玻璃,但能改变玻璃的性能,一般使结构变弱,如Na 2O 、K 2O 、CaO 等;键强在60~80kcal/mol 之间的称为中间体氧化物(或网络中间体),其玻璃形成能力介于玻璃形成氧化物与玻璃调整氧化物之间,但自身不能单独形成玻璃,将其加入玻璃中能改善玻璃的性能,如AlO 、BeO 、ZnO 、TiO 2等。
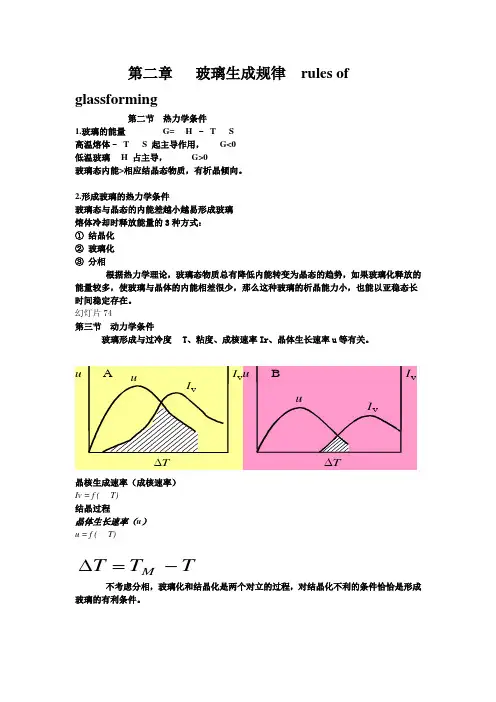
第二章 玻璃生成规律 rules ofglassforming第二节 热力学条件 1.玻璃的能量 G=H – T S 高温熔体– T S 起主导作用, G<0 低温玻璃H 占主导, G>0玻璃态内能>相应结晶态物质,有析晶倾向。
2.形成玻璃的热力学条件玻璃态与晶态的内能差越小越易形成玻璃 熔体冷却时释放能量的3种方式: ① 结晶化 ② 玻璃化 ③ 分相根据热力学理论,玻璃态物质总有降低内能转变为晶态的趋势,如果玻璃化释放的能量较多,使玻璃与晶体的内能相差很少,那么这种玻璃的析晶能力小,也能以亚稳态长时间稳定存在。
幻灯片74第三节 动力学条件玻璃形成与过冷度T 、粘度、成核速率Ir 、晶体生长速率u 等有关。
∆Tuu I vI v A∆TuuI vI vB晶核生成速率(成核速率) Iv = f (T) 结晶过程晶体生长速率(u ) u = f (T)TT T M -=∆不考虑分相,玻璃化和结晶化是两个对立的过程,对结晶化不利的条件恰恰是形成玻璃的有利条件。
当熔融体从状态A 以较慢的速度冷却至结晶温度 Tm 时,若从熔体析出晶体,体积就会突然减小,从M 点直线下降至C 点,而后晶体的体积随温度降低而缓慢减小,整个冷却过程的曲线为AMCC ′。
如果熔融体的冷却速度足够快,则达到M 点时将不会析出晶体,而沿M-G 连续变化,温度降至Tg 时成为过冷液体,继续降温形成玻璃体。
整个冷却成玻璃体的过程中,体积没有突变,V-T 曲线为AMGG ′。
熔体冷却速率非常关键。
如冷却速度达到106C /s ,金属也可变成非晶态 1.三T 图(Temperature-Time-Transformation)(1)临界冷却速率——可防止玻璃产生能被测得出结晶量的最小冷却速率。
可测出的最小晶体体积与熔体体积之比约为10-6 即容积分率VL/ V=/3 Ir u3 t4= 10-6(dT/dt)C = TN /N=(Tm-TN)/N Tm — 熔化温度 TN —鼻尖点温度 N —鼻尖点时间临界冷却速率越小,越易成玻过冷度(K )时间(s)玻璃晶体AB C10101010101011040100120806020如何解释3T 图的形状?比较不同物质形成玻璃的能力n n c/t T dt dT ∆≈⎪⎭⎫ ⎝⎛nM n T T T -=∆三T 图时间温度 NTN(2)可得样品厚度 Yc=(DTh N)0.5DTh —样品热扩散系数Yc 越大越易成玻 2.粘度规则粘度越大,越易成玻。

第2章玻璃的形成规律既然玻璃是物质的一种存在状态,那么是否任何物质都可以形成玻璃呢?塔曼曾经断言过,几乎任何物质都可以转变成无定形态,但这一著名论断至今还不能给以充分证明。
就目前而言,并非一切物质都能形成玻璃。
实践证明:有些物质如石英(SiO2)熔融后容易形成玻璃,而食盐(NaCl)却不能形成玻璃。
究竟怎样的物质才能形成玻璃?玻璃形成的条件和影响因素又是什么?这些正是研究玻璃形成规律的对象。
研究玻璃形成规律不仅对研究玻璃结构有深刻的影响,而且也是寻找更多具有特殊性能的新型玻璃的必要途径。
因此,研究和认识玻璃形成规律在理论和实践上都有重要的意义。
2.1 玻璃的形成方法为了合成更多的新型无机非晶态固体材料,以适应科学技术发展的需要,材料科学家进行了大量的探索,发现了许多新的制备玻璃态物质 (非晶态固体)的工艺和方法。
目前,除传统的熔体冷却法外,还出现了气相和电沉积,真空蒸发和溅射,液体中分解合成等非熔融的方法。
因此,过去许多用传统的熔体冷却法不能得到的玻璃态物质,现在都可以成功地制备了。
形成玻璃的方法很多。
总的可分为熔体冷却(熔融)法和非熔融法两类。
熔体冷却(熔融)法是形成玻璃的传统方法,是把单组分或多组分物质加热熔融后冷却固化而不析出晶体。
近年来冷却工艺已得到迅速发展,冷却速度可达106~107℃/s以上,使过去认为不能形成玻璃的物质也能形成玻璃,如金属玻璃和水及水溶液玻璃的出现。
对于加热时易挥发、蒸发或分解的物质,现已有加压熔制淬冷新工艺,获得了许多新型玻璃。
非熔融法形成玻璃是近些年才发展起来的新型工艺。
它包括气相和电沉积,真空蒸发和溅射,液体中分解合成等方法。
表2-1列出了非熔融法形成玻璃的一些方法。
表2-1 非熔融法形成玻璃一览表原始物质形成原因获得方法实例固体(晶体)剪切应力冲击波石英、长石等晶体,通过爆炸,夹于铝板中受600kb的冲击波而非晶化,石英变为d=2.22、N d=1.46接近于玻璃,350kb不发生晶化磨碎晶体通过磨碎,粒子表面逐渐非晶化反射线辐射高速中子射线或α射线石英晶体,1.5×1020cm-2中子照射而非晶化,d=2.26、N d=1.47液体形成络合物金属醇盐的水解Si、B、P、Al、Zn、Na、K等醇盐的酒精溶液,水解得到凝胶,加热(T<Tg)形成单组分、多组分氧化物玻璃气体升华真空蒸发沉积低温极板上气相沉积非晶态薄膜,有Bi、Ga、Si、Ge、B、Sb、MgO、Al2O3、ZrO2、TiO2、Ta2O5、Nb2O5、MgF2、SiC及其它各种化合物阴极溅射及氧化反应低压氧化气氛中,将金属或合金进行阴极溅射,极板上沉积氧化物,有SiO2、PbO-TeO2薄膜、PbO- SiO2薄膜、莫来石薄膜、ZnO 气相反应气相反应SiCl4水解,SiH4氧化而形成SiO2玻璃;B(OC2H5)3真空加热700~900℃形成B2O3玻璃辉光放电辉光放电形成原子态氧,低压中金属有机化合物分解,基板上形成非晶态氧化物薄膜。
玻璃的熔制过程及玻璃的形成玻璃是一种非晶态物质,在固体状态下具有高度的无序性。
与晶体不同,玻璃的原子或分子没有规则的排列方式,而是呈现出一种类似液体的结构。
玻璃的制作过程通常涉及以下几个步骤:原料的准备、混合、熔融、成型和退火。
首先,玻璃的原料通常包括硅酸盐、碳酸盐、氟化物、氧化物等。
这些原料需要经过精细的筛选和准备,以确保最终的玻璃制品具有高质量和一致性。
接下来,原料会被混合在一起。
这个过程中,可以添加一些助熔剂来降低玻璃的熔点,并提高其流动性。
同时,还可以添加一些颜料或着色剂,使玻璃获得不同的颜色。
然后,混合后的原料会被放置在熔炉中进行加热熔化。
熔化温度通常在1000℃-1600℃之间,具体取决于玻璃的成分。
在熔化过程中,原料中的化合物会逐渐分解并混合在一起,形成一个均匀的、粘稠的玻璃熔体。
当玻璃熔体达到适当的粘度后,可以进行成型。
一种常见的方法是通过将玻璃熔体倒入预先设计好的模具中,并迅速冷却,使得玻璃凝固成所需的形状。
也可以使用玻璃纤维或吹塑技术来制作不同形状的玻璃制品。
最后,将成型后的玻璃进行退火处理。
退火是将玻璃制品加热至较低的温度,然后缓慢冷却。
这个过程有助于减少玻璃内部的残余应力,增强玻璃的强度和稳定性。
关于玻璃形成的机制,有几种理论被提出。
其中最常被引用的是针对硅酸盐玻璃的聚集-聚合-凝胶理论。
根据这个理论,玻璃形成过程中的原子或分子聚集在一起形成聚集体,然后通过聚合反应形成更大的聚合体,并最终凝胶化形成玻璃。
除此之外,还有一些其他的理论,如液体-液体相分离理论和无限长寿命理论。
这些理论试图解释玻璃形成过程中原子或分子的排列和结构。
总的来说,玻璃的熔制过程包括原料的准备、混合、熔融、成型和退火。
而玻璃的形成机制仍然存在一定的争议,但聚集-聚合-凝胶理论是目前被广泛接受和引用的解释之一。