新药转正中药标准第19册
- 格式:doc
- 大小:76.50 KB
- 文档页数:18

卫生部药品标准中药成方制剂第十九册卫生部药品标准中药成方制剂第十九册在医药行业中,中药成方制剂一直是备受关注的话题。
而卫生部药品标准中药成方制剂第十九册更是备受瞩目,因为它包含了许多重要的药方和制剂标准。
在本文中,我们将针对这个主题展开全面的评估,深入探讨其中的内容和意义,并分享个人观点和理解。
让我们了解一下卫生部药品标准中药成方制剂第十九册的概况。
这个标准是针对中药成方制剂的,旨在规范其中药材的选择、加工、配伍和制备方法,以及质量控制等方面的要求。
这对于保证中药成方制剂的质量和安全具有重要意义,也为中药制剂的临床应用提供了可靠的依据。
在这个标准中,我们可以看到许多常见的中药成方制剂,比如逍遥散、伤风败毒散、柴黄丸等。
通过对这些药方的深入分析,我们可以了解到它们的组成、功效、适应症和禁忌症等信息,这对于临床应用和药品监管具有非常重要的意义。
当然,这个标准中还包括了对中药成方制剂的质量控制要求。
这涉及到药材的质量标准、生产工艺和技术要求、成品的质量控制和标签用语等内容。
这些规定的实施,可以有效保证中药成方制剂的质量和安全,为患者的用药提供了保障。
针对这个主题,我个人认为,卫生部药品标准中药成方制剂第十九册的发布是中药行业的一大进步,它为中药成方制剂的生产、使用和监管提供了明确的指导和标准。
它也反映了我国对于中药质量和安全的高度重视,为中药行业的健康发展奠定了基础。
卫生部药品标准中药成方制剂第十九册是一个具有重要意义的文件,它对于规范中药成方制剂的质量、安全和临床应用具有重要的作用。
我们应该认真对待这个标准,不断加强对中药质量和安全的监管,为患者提供更加安全有效的药品。
在本文中,我们对卫生部药品标准中药成方制剂第十九册进行了深入探讨,并分享了个人观点和理解。
希望这能够对您有所帮助,也期待未来中药行业能够不断进步,为人民的健康保驾护航。
卫生部药品标准中药成方制剂第十九册的发布,对于中药行业的发展和规范具有重要的意义。

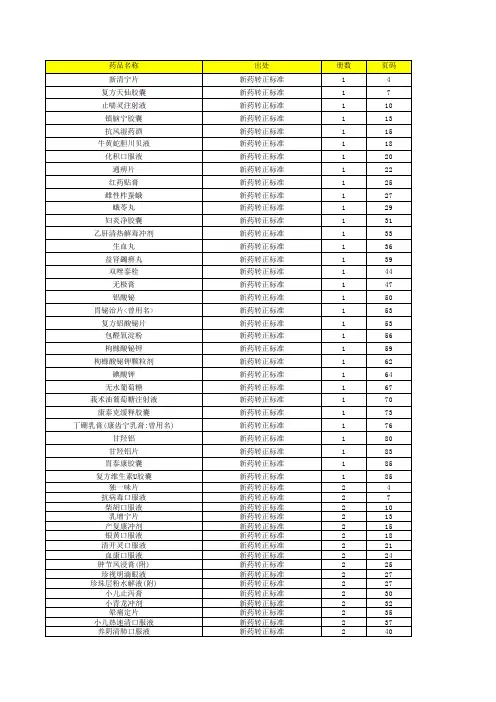
新药转正西药标准卫生部颁药品标准(新药转正标准西药第十五册)12种复方盐酸阿米洛利片拼音名:Fufang Yansuan Amiluoli Pian英文名:Compound Amiloride Hydrochloride Tablets书页号:x15-71 标准编号:WS1?X?220?98Z批准文号:(90)卫药准字X-138号(90)卫药准字X-138-2号本品每片含盐酸阿米洛利C6H8ClN7O?HCl应为2.25~2.75mg;含氢氯噻嗪C7H8ClNO4S2应为22.5~27.5mg。
【处方】盐酸阿米洛利 2.5g 氢氯噻嗪 25g 制成 1000片【性状】本品为类白色片。
【鉴别】在含量测定项下记录的色谱图中,供试品峰的保留时间应与对照品峰的保留时间一致。
【检查】含量均匀度取本品1片,置50ml 量瓶中,照含量测定项下的方法测定,应符合规定中国药典1995年版二部附录Ⅹ E。
溶出度取本品,照溶出度测定法中国药典1995年版二部附录Ⅹ C第一法,以0.1mol/L盐酸溶液900ml为溶剂,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml,滤过,滤液备用。
盐酸阿米洛利取上述溶液,照分光光度法中国药典1995年版二部附录Ⅳ A在365nm的波长处测定吸收度,另取经100℃减压干燥3小时的盐酸阿米洛利对照晶适量,加0.1ml/L盐酸溶液制成每1ml含2.5μg的溶液,同法测定吸收度,计算出每片的溶出量,限度为标示量的80%,应符合规定。
氢氯噻嗪取上述溶液1ml,置10ml量瓶中,加0.1mol/L盐酸溶液稀释至刻度,摇匀,照分光光度法中国药典1995年版二部附录Ⅳ A,在272nm波长处测定吸收度。
另取经105℃干燥1小时的氢氯噻嗪对照品,加0.1mol/L盐酸溶液制成每1ml含2.5μg的溶液;同法测定吸收度,计算出每片的溶出量,限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定中国药典1995年版二部附录Ⅰ A。

国家药品标准《新药转正标准》第77册至88册国家药典编委会主编规格:全12册大16开总定价:1920元优惠价:1180元国家药品标准《新药转正标准》第77册至88册新药转正标准77-88现货低价关于国家药品标准《新药转正标准》第77册至88册征订的通知本次汇编的转正标准共计587个品种(中药545个品种,化药42个品种),共分12册(77册至88册),并定于2011年9月5日前出版发行。
望从事药品科研、生产、检验单位及流通企业关注并认购。
该汇编定价为160元/册。
总定价:1920元国家药品标准《新药转正标准》第77册至88册国家药典编委会主编规格:全12册大16开总定价:1920元优惠价:1180元国家药品标准《新药转正标准》第77册至88册新药转正标准77-88现货低价关于国家药品标准《新药转正标准》第77册至88册征订的通知本次汇编的转正标准共计587个品种(中药545个品种,化药42个品种),共分12册(77册至88册),并定于2011年9月5日前出版发行。
望从事药品科研、生产、检验单位及流通企业关注并认购。
该汇编定价为160元/册。
总定价:1920元国家药品标准《新药转正标准》第77册至88册国家药典编委会主编规格:全12册大16开总定价:1920元优惠价:1180元国家药品标准《新药转正标准》第77册至88册新药转正标准77-88现货低价关于国家药品标准《新药转正标准》第77册至88册征订的通知本次汇编的转正标准共计587个品种(中药545个品种,化药42个品种),共分12册(77册至88册),并定于2011年9月5日前出版发行。
望从事药品科研、生产、检验单位及流通企业关注并认购。
该汇编定价为160元/册。
总定价:1920元国家药品标准《新药转正标准》第77册至88册国家药典编委会主编规格:全12册大16开总定价:1920元优惠价:1180元国家药品标准《新药转正标准》第77册至88册新药转正标准77-88现货低价关于国家药品标准《新药转正标准》第77册至88册征订的通知本次汇编的转正标准共计587个品种(中药545个品种,化药42个品种),共分12册(77册至88册),并定于2011年9月5日前出版发行。
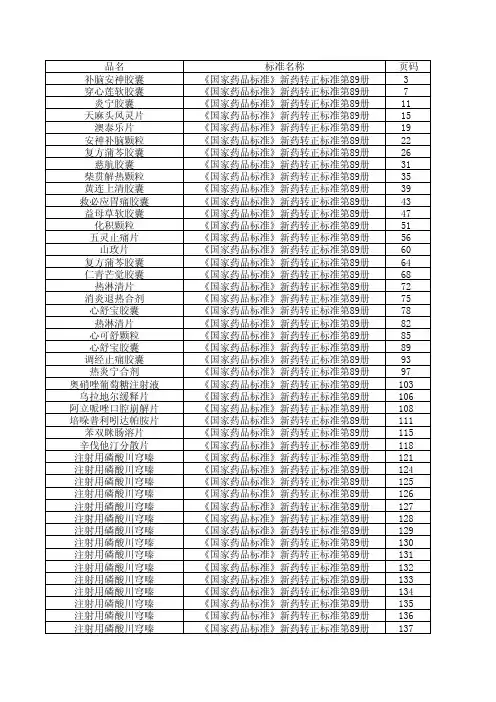


新药转正中药标准卫生部颁药品标准(新药转正标准中药第一册)(15种)雌性柞蚕蛾拼音名:Cixingzuocane英文名:书页号:X1-27 标准编号:WS3-125(Z-31)-92(Z)批准文号:(90)卫药准字Z-19号本品为天蚕蛾科昆虫柞蚕Antheraea Pernyi Guerin-Meneville的未交配的雌性蚕蛾,经排尿、去翅、去足的干燥体。
【性状】本品由头、胸、腹三部分组成。
全身披覆深浅不同的黄褐色短毛。
体长约4cm,头部小,复眼一双,呈深褐色,口器退化,胸部由前胸、中胸、后胸三部组成腹部肥硕,末端较圆,可认出七个环节。
【鉴别】取本品4g,研细,加无水乙醇40ml,振摇5分钟,滤过,取滤液,加无水乙醇稀释至50ml,摇匀,吸取1ml置10ml量瓶中,加无水乙醇稀释至刻度,摇匀后照分光光度法(中国药典1990年版一部附录52页)测定,在269nm波长处有最大吸收。
【检查】水分取本品15g,照水分测定法(中国药典1990年版一部附录30页烘干法)测定。
不得过8%。
【炮制】除去杂质,粉碎成细粉。
【性味与归经】咸、温,归肝、肾经。
【功能与主治】补肾益肾,温脾助胃,宁心安神,调气活血。
用于调整内分泌紊乱。
【用法与用量】2~3g,入丸、散用。
【贮藏】置0~-10℃保存。
蛾苓丸拼音名:Eling Wan英文名:书页号:X1-29 标准编号:WS3-125(Z-31)-92(Z)批准文号:(90)卫药准字Z-19号本品为雌性柞蚕蛾等经加工制成的水丸。
【制法】以上药味,粉碎成细粉,混匀,用水泛丸,制成1000粒,烘干,用煅赭石粉挂衣,硅腊粉打光,即得。
【性状】本品为暗红色的水泛丸,除去外衣,显灰黄色或棕黄色;味甘。
【鉴别】(1) 取本品,置显微镜下观察:不规则分枝状团块无色,遇水合氯醛液溶化,菌丝无色或淡棕色,直径4~6μm,细长,稍弯曲有分枝。
(2) 取本品15粒,研细,加无水乙醇30ml,振摇提取5分钟,滤过,取滤液置50ml量瓶中,加乙醇稀释至刻度,摇匀,精密吸取1.0ml,置10ml量瓶中,加乙醇稀释至刻度,摇匀后照分光光度法(中国药典1990年版一部附录52页)测定,在269nm波长处有最大吸收。

新药转正标准中药第44册新药转正中药标准卫生部颁药品标准(新药转正标准中药第四十四册)(23种)八珍胶囊拼音名:Bazhen Jiaonang英文名:书页号:X44-73 标准编号:WS3-156(Z-022)-2003(Z)【处方】党参白术(炒) 茯苓甘草当归白芍川芎熟地黄【性状】本品为胶囊剂,内容物为深棕色的颗粒及粉末;气微香,味微甜、苦。
【鉴别】(1)取本品,置显微镜下观察:草酸钙晶体存在于薄壁细胞中,呈类圆形或类簇晶状,直径10,25μm,常数个排列成行。
韧皮薄壁细胞纺锤形,壁略厚,表面有极微细的斜向交错纹理。
(2)取本品内容物2.4g,加乙醇40ml,在水浴上浸渍1小时,时时振摇,滤过,滤液蒸干,残渣加水20ml使溶解,用水饱和的正丁醇振摇提取3次,每次20ml,合并正丁醇液,用水洗涤3次,每次15ml,弃去水液,正丁醇液蒸干,残渣加乙醇1ml使溶解,作为供试品溶液。
另取芍药苷对照品,加乙醇制成每1ml含2mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典2000年版一部附录? B)试验,吸取上述两种溶液各5,10μl,分别点于同一硅胶G薄层板上,以氯仿-醋酸乙酯-甲醇-甲酸(40:5:10:0.2)为展开剂,展开,取出,晾干,喷以5, 香草醛硫酸溶液,加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(3)取本品内容物4g,加乙醚60ml,超声处理20分钟,滤过,滤液挥干,残渣加乙醇1ml使溶解,作为供试品溶液。
另取当归、川芎对照药材0.2g,同法制成对照药材溶液。
照薄层色谱法(中国药典2000年版一部附录? B)试验,吸取上述两种溶液各2μl,分别点于同一硅胶H薄层板上,以石油醚(30,60?)-醋酸乙酯-冰醋酸(9:1:0.1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,分别显相同颜色的荧光斑点。

新药转正西药标准 卫生部颁药品标准(新药转正标准西药第九册) (15 种)对乙酰氨基酚滴剂 拼音名: Duiyixian ※ anjifen Diji 英文名: Paracetamol Drops 书页号: X9-60 批准文号:( 92)卫药准字 X-76 号本品含对乙酰氨基酚(C3H9NO2)应为标示量的90.0〜110.0%。
【性状】 本品为淡红色或红色的澄清液体;臭芳香,味微苦,可加 适宜调味剂。
【鉴别】 在含量测定项下记录的色谱图中,供试品峰的保留时间应 与对照品峰的保留时间一致。
【检查】 对氨基酚 取本品,加水制成每 1ml 中含对乙酰氨基酚 2.0mg 的供试品溶液;另取对氨基酚对照品,加水制成每1ml 中含10卩g 的对照品溶液。
照含量测定项下的色谱条件,用外标法 (中国药典1995年版二部附录V D )测定,精密量取上述两种溶液各 10卩I,分别注入液相色谱仪,记录色谱图。
供试品溶液的色谱图中如出现与对照品溶液相应的对氨基酚峰,其峰面积 不得大于对照品溶液主成分峰的峰面积(0.5% )。
相对密度本品的相对密度(中国药典1995年版二部附录W A )为1.070〜1.150。
pH 值 应为4.7〜7.0(中国药典1995年版二部附录W H )。
装量 取本品,依法检查(中国药典1995年版二部附录XF ),应符合 规定。
【含量测定】 照高效液相色谱法(中国药典1995年版二部附录VD ) 测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂,甲醇-0.05mol/L 醋酸铵溶液(15:85)为流动相,检测波长为 257nm 。
理论板数按对乙酰氨基酚峰计算应不低于 5000,对乙酰氨基酚峰与内标物质峰的分离度应 符合要求。
内标溶液的制备 取茶碱,加水制成每 1ml 中含 1.0mg 的溶液,摇匀,即 得。
测定法 精密量取本品适量,加水定量稀释制成每 1ml 中约含对乙酰氨 基酚0.6mg 的溶液,精密量取此溶液与内标溶液各 5ml ,置50ml 量瓶中,用水稀释至刻度,摇匀,取 10卩l 注入液相色谱仪,记录色谱图;另精密称取在 105 C干燥至恒重的对乙酰氨基酚对照品适量,加水溶解并定量稀释制成每1ml 中 约含 0.6mg 的溶液,同法测定。
第一部分:引言1. 介绍卫生部药品标准中药成方制剂第十九册的背景和概述在我国,中药是一种重要的医疗资源,卫生部药品标准中药成方制剂第十九册是中药制剂的重要文件。
本文将针对该册标准进行深入探讨,旨在帮助读者更全面地了解中药成方制剂以及卫生部的药品标准。
第二部分:中药成方制剂的概念及其重要性2. 对中药成方制剂的定义和意义进行介绍中药成方制剂是指由多种中草药按一定比例组合而成的药剂,其具有较好的疗效和安全性,对中医药临床治疗具有重要意义。
卫生部的药品标准对于中药成方制剂的规范化和标准化起到了关键作用,有助于确保中药制剂的质量和疗效。
第三部分:卫生部药品标准中药成方制剂第十九册的内容概述3. 论述卫生部药品标准中药成方制剂第十九册的主要内容和范围在这部分,我们将详细介绍卫生部药品标准中药成方制剂第十九册的内容概况,包括颗粒剂、丸剂、糖浆剂等各类型制剂的标准要求,以及对于包括质量控制、生产工艺、贮藏、包装等方面的规定。
第四部分:中药成方制剂的质量控制和标准化生产4. 探讨中药成方制剂的质量控制和标准化生产的意义和方法中药成方制剂的质量控制和标准化生产是确保中药制剂质量与疗效的关键。
卫生部的药品标准对中药成方制剂的质量控制和生产标准化提出了严格要求,有助于保证中药制剂在临床应用中的安全性和有效性。
第五部分:对卫生部药品标准中药成方制剂第十九册的个人观点和理解5. 共享个人对于卫生部药品标准中药成方制剂第十九册的个人观点和理解作为一名中药制剂的写手,我深知卫生部第十九册的标准对中药制剂行业的重要性。
我认为这些标准的制定和实施,有助于提升中药制剂的整体质量水平,保障患者的用药安全。
第六部分:总结及回顾6. 总结卫生部药品标准中药成方制剂第十九册的重要作用和影响卫生部第十九册的标准对中药成方制剂的质量管理和规范化生产具有重要意义,对中医药行业的发展和中药制剂的国际化有重要推动作用。
在未来的工作中,我们需要进一步深化对这些规范的理解,不断提高中药成方制剂的质量水平。
新药转正中药标准卫生部颁药品标准(新药转正标准中药第十一册)(15种)阿胶补血口服液拼音名:Ejiao Buxue Koufuye英文名:书页号:X11-20 标准编号:WS3-74(Z-64)-96(Z)批准文号:(92)卫药准字Z-22号【处方】阿胶熟地黄党参黄芪枸杞子白术【性状】本品为深棕色液体;味微甜。
【鉴别】取本品5ml,加水15ml,搅匀,滤过,取滤液2ml,加茚三酮试液2滴,置沸水浴中加热5分钟,显紫红色。
【检查】相对密度应不低于1.05(中国药典1995年版一部附录ⅦA)。
pH值应为4.0~6.0(中国药典1995年版一部附录ⅦG)。
其他应符合合剂项下有关的各项规定(中国药典1995年版一部附录ⅠJ)。
【含量测定】精密量取本品0.2ml,照氮测定法(中国药典1995年版一部附录ⅨL第二法)测定,总氮量应不少于7.0mg/ml。
【功能与主治】滋阴补血,补中益气,健脾润肺。
用于久病体弱,血亏目眩,虚痨咳嗽。
【用法与用量】口服,一次20ml,早晚各一次或遵医嘱。
【规格】每支20ml【贮藏】密封,置阴凉处。
【使用期限】2年。
阿胶颗粒拼音名:Ejiao Keli英文名:书页号:X11-11 标准编号:WS3-88(Z-13)-96(Z)批准文号:(92)卫药准字Z-01号本品为阿胶经干燥、粉碎,制成的颗粒。
【性状】本品为棕色颗粒或粉末;气香,味微甘。
【检查】水分取本品1g,精密称定,照水分测定法(中国药典1995年版一部附录ⅨH烘干法)测定,不得过7.0%。
总灰分取本品1g,精密称定,照灰分测定法(中国药典1995年版一部附录ⅨK)测定,不得过1.1%。
重金属砷盐应符合阿胶项下有关的各项规定(中国药典1995年版一部513页)。
挥发性碱性物质精密称取本品5g,置100ml量瓶中,加水使溶解并稀释至刻度,摇匀,精密量取5ml置凯式蒸馏瓶中,立刻加1%氢氧化镁混悬溶液5ml,迅速密塞,通入水蒸气进行蒸馏,以2%硼酸溶液5ml为接收液,加甲基红-溴甲酚绿混合指示液5滴,从滴出第一滴凝结水珠时起,蒸馏7分钟停止,馏出液照氮测定法(中国药典1995年版一部附录ⅨL第二法)滴定,即得。
中药药剂学复习题及参考答案1、混悬液型气雾剂是A、药物溶解在抛射剂中或药物借助于潜溶剂与抛射剂混溶而制成的气雾剂B、通过乳化作用而制成的气雾剂C、药物的水溶液与抛射剂互不混溶而分层,密度较大的抛射剂沉在容器底部D、药物与抛射剂填充在带有阀门系统的耐压容器中,所制成的液体制剂E、药物的固体粉末混悬在抛射剂中所形成的气雾剂答案:E2、川蜡在糖衣片中用于A、打光B、糖衣层C、有色糖衣层D、粉衣层E、隔离层答案:A3、适用于注射剂偏碱性药液的抗氧剂应为A、硫代硫酸钠B、焦亚硫酸钠C、亚硫酸氢钠D、抗坏血酸E、硫脲答案:A4、下列属于中成药非处方药遴选范围的是A、《中国药典》一部、《局(部)颁药品标准》中药成方制剂各分册及《局(部)颁药品标准》新药转正标准各分册收载的中成药品种B、治疗大病的中成药品种C、上市时间不久,但疗效特好的新药D、处方中虽含有毒性中药,但没有麻醉中药的中成药品种E、治疗重病的中成药品种答案:A5、一般10~20ml的中药注射剂灭菌多采用A、低温间歇灭菌B、流通蒸汽灭菌100℃,45minC、热压灭菌115℃,45minD、流通蒸汽灭菌100℃,30minE、热压灭菌121℃,45min答案:B6、霞天胶A、皮胶类B、甲胶类C、骨胶类D、角胶类E、其他类答案:E7、下列关于蜜丸制备叙述错误的是A、根据药粉性质选择适当的合药蜜温B、药材经提取浓缩后制丸C、根据药粉性质选择适当的炼蜜程度D、药材经炮制粉碎成细粉后制丸E、炼蜜与药粉的比例一般是1:1~1:1.5答案:B8、膜剂的厚度,一般约为A、0.5~1mmB、0.1mmC、0.5mmD、0.1~1mmE、1mm答案:D9、制成的颗粒有一定棱角的制颗粒方法是A、一步制颗粒B、湿法制颗粒C、干法制颗粒D、快速搅拌制颗粒E、挤出制颗粒答案:D10、注射剂按下列给药途径,不能添加抑菌剂的是A、皮内注射B、静脉注射C、肌肉注射D、穴位注射E、皮下注射答案:B11、在膏药制备过程中,加入细料药的工艺环节是A、摊涂前B、去火毒时C、炼油时D、下丹前E、炸料后答案:A12、《局颁药品标准》所收载的处方属于A、法定处方B、时方C、医师处方D、局方E、协定处方答案:A13、《中国药典》2005年版一部规定,注射液标示量为2ml的易流动液体增加的装量为A、0.30mlB、0.15mlC、0.60mlD、0.50mlE、0.10ml答案:B14、以松香等为基质与药物混合而制成的膏剂称为A、橡胶膏剂B、松香膏药C、贴膏剂D、黑膏药E、软膏剂答案:B15、药品标准收载的药名称A、俗名B、别名D、正名E、并开药名答案:D16、滴眼剂中,常选用的pH调节剂应为A、氯化钠B、卵磷脂C、聚维酮D、1%~2%苯甲醇E、磷酸二氢钠和磷酸氢二钠答案:E17、下列有关喷雾干燥特点的叙述,不正确的是A、是用流化技术干燥液态物料B、能保持中药的色香味C、干燥表面积增大D、须加入助溶剂以增加干燥制品的溶解度E、干燥速度快,适于含热敏性成分物料的干燥答案:D18、需要加入干燥黏合剂的制颗粒方法是A、干法制颗粒B、一步制颗粒C、挤出制颗粒D、快速搅拌制颗粒E、湿法制颗粒答案:A19、适宜制备脂质体混悬型注射剂的方法是A、薄膜分散法B、注入法C、冷冻干燥法D、超声波分散法E、空气悬浮法答案:D20、制备黄明胶所用的牛皮,一般认为质量较好的是A、黄白花奶牛B、北方黑牛D、黑白花奶牛E、北方黄牛答案:E21、利用饱和水蒸气或沸水灭菌A、消毒剂消毒B、防腐剂C、干热灭菌D、湿热灭菌E、化学气体灭菌答案:D22、用于皮试或临床疾病诊断,剂量在0.2ml以下A、肌肉注射B、脊椎腔注射C、皮下注射D、皮内注射E、静脉注射答案:D23、颗粒剂标示装量为1.5g以上至6g时,装差异限度为A、±6%B、±9%C、±8%D、±5%E、±7%答案:E24、气雾剂中抛射药物的动力是A、抛射剂B、推动钮C、弹簧D、浸入管E、阀门杆答案:A25、通过膜包衣技术制备包衣脉冲系统的。
新药转正中药标准卫生部颁药品标准(新药转正标准中药第十九册)(14种)安替可胶囊拼音名:Antike Jiaonang英文名:书页号:x19-324 标准编号:WS3—496(Z —072)—98(Z)本品为当归、蟾皮经加工制成的胶囊。
【性状】本品为胶囊剂,内容物为灰黄色的粉末;气清香,味甘、苦,有麻感。
【鉴别】(1)取本品,置显微镜下观察:韧皮薄壁细胞纺缍形,表面有微细的斜向交错的纹理。
不规则黄绿色团块,表面细颗粒状,边缘稍整齐。
表皮细胞无色或黄绿色,细胞界限不清楚,布有暗棕色色素颗粒,多聚集成团或连成网状。
(2)取本品内容物约7g,加氯仿50ml,加热回流1小时,放冷,滤过,滤液浓缩至5ml,作为供试品溶液。
另取蜡皮细粉2g,加氯仿25ml,同法制成对照药材溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验,吸取上述两种溶液各10μl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以苯-丙酮(7:3)为展开剂,展开,取出,晾干,喷以20%硫酸乙醇溶液,在105℃烘约7分钟。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
【检查】应符合胶囊剂项下有关的各项规定(中国药典1995年版一部附录ⅠL)。
【含量测定】照高效液相色谱法(中国药典1995年版一部附录ⅥD))测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填料;甲醇-1%冰醋酸溶液(30:70)为流动相;检测波长320nm。
理论板数按阿魏酸峰计算应不低于3500。
对照品溶液的制备精密称取阿魏酸对照品10mg,置100ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取1ml,置10ml量瓶中,加甲醇稀释至刻度,摇匀,即得(每1ml含阿魏酸0.01mg)。
供试品溶液的制备取装量差异项下的内容物适量,混匀,精密称定,称取约0.6g,精密称定,精密加入甲醇-甲酸(95:5)溶液25ml,密塞,超声提取30分钟,滤过,弃去初滤液,取续滤液作为供试品溶液。
测定法分别精密吸取对照品溶液和供试品溶液各10μl,注入液相色谱仪,测得峰面积,计算,即得。
本品每粒含当归以阿魏酸(C10H10O4)计,不得少于63μg。
注:对照品溶液和供试品溶液在24小时内稳定,不宜久置。
【功能与主治】软坚散结,解毒定痛,养血活血。
用于食管癌瘀毒证,与放疗合用可增强对食管癌的疗效。
【用法与用量】口服,一次2粒,一日3次,饭后服用,疗程5周,或遵医嘱。
【不良反应】少数患者使用后可出现恶心、血降低。
过量,连续久服致心慌。
【注意事项】(1)心脏病患者慎用;(2)孕妇忌服;(3)注意观察血象;(4)注意掌握服用剂量。
【规格】每粒装0.22g【贮藏】密封。
【使用期限】 1.5年。
复方益母口服液拼音名:Fufang Yimu Koufuye英文名:书页号:x19-312 标准编号:WS3—255(Z-047)—98(Z) 本品为益母草,当归、川芎等药味经加工制成的口服液。
【性状】本品为黄棕色至棕色液体;味甜,微苦、辛。
【鉴别】(1)取本品20ml,加石油醚(30~60℃)30ml振摇提取,提取液蒸干,残渣加甲醇1ml使溶解,再加2%3,5-二硝基苯甲酸甲醇溶液2~3滴与氢氧化钾的甲醇饱和溶液5~6滴,即显紫红色。
(2)取本品10ml,加醋酸乙酯30ml振摇提取,提取液蒸干,残渣加乙醇2ml使溶解,作为供试品溶液。
另取当归对照药材0.2g,加乙醇10ml,超声处理5分钟,滤过,滤液作为对照药材溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验。
吸取上述两种溶液各10μl,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)-醋酸乙酯(85:15)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同的亮蓝白色荧光斑点。
【检查】相对密度应不低于1.05(中国药典1995年版一部附录ⅦA)。
pH值应为4.0~5.5(中国药典1995年版一部附录ⅦC)。
其他应符合合剂项下有关的各项规定(中国药典1995年版一部附录ⅠJ)。
【含量测定】精密量取本品10ml,用浓盐酸调节pH值至2,加入新制的2%雷氏盐溶液10ml,冰浴中放置1小时,用G5-3垂溶玻璃漏斗滤过,沉淀用冰水10mL洗涤后,用丙酮溶解,丙酮液中滴加0.5%硫酸银溶液至不再有沉淀生成,滤过,沉淀用丙酮10ml洗涤,合并洗液与滤液并浓缩至约1ml,滴加1%氯化钡溶液至不再有沉淀生成,滤过,沉淀用70%乙醇10ml洗涤,合并滤液与洗液,蒸干,残渣加乙醇使溶解,定量转移至2ml量瓶中,并稀释至刻度,摇匀,作为供试品溶液。
另取盐酸水苏碱对照品,加乙醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验,吸取供试品溶液8μl、对照品溶液6μl与10μl,分别交叉点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以丙酮-无水乙醇-盐酸(10:10:1)为展开剂,展开,取出,晾干,在100℃烘约10分钟,取出,喷以稀碘化铋钾试液与1%三氯化铁无水乙醇溶液(2:1)的混合液,冷风吹至斑点显色清晰,在薄层板上覆盖同样大小的玻璃板,周围用胶布固定,照薄层色谱法(中国药典1995年版一部附录ⅥB 薄层扫描法)进行扫描,波长:λS=510nm,λR=700nm,测量供试品吸收度积分值与对照品吸收度积分值,计算,即得。
本品每1ml含益母草以盐酸水苏碱(C7H13CINO2)计,不得少于0.15mg。
【功能与主治】活血行气,化瘀止痛。
用于气滞血瘀所致的痛经。
症见:月经期小腹胀痛、拒按、经血不畅、血色紫黯成块、乳房胀痛、腰部酸痛等。
【用法与用量】口服,一次20ml,一日2次。
【规格】每支10ml【贮藏】密封,置阴凉干燥处。
【使用期限】2年。
固本益肠片拼音名:Guben Yichang Pian英文名:书页号:x19-306 标准编号:WS3—050(Z—009)—98本品为党参、白术、补骨脂、山药、黄芪、炮姜、当归、白芍等药味经加工制成的片。
【性状】本品为棕黄色或棕色的片;气微香,味微苦。
【鉴别】(1)取本品5片,用水泡散,滤过,取少许残渣,用10%氢氧化钠溶液透化,置显微镜下观察;种皮栅状细胞棕红色,顶面观呈多角形,胞腔极小,孔沟细而清晰;底面观呈类多角形或类圆形,壁较薄,胞腔较大,内含红棕色物;侧面观类柱状,细胞壁顶部较厚,下部渐薄。
(2)取本品50片,研碎,加水50ml,超声处理30分钟,滤过,滤液用水饱和的正丁醇提取3次,每次20ml,合并正丁醇液,蒸干,残渣加甲醇20ml使溶解,加干已处理好的中性氧化铝柱(100~120目,5g,内径10~15mm)上,用40%甲醇100ml洗脱,收集洗脱液,置水浴上蒸至约30ml,用水饱和的正丁醇提取2次,每次20ml,合并正丁醇液,用水洗涤2次,每次20ml,正丁醇液置水浴上蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取黄芪甲甙对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以氯仿-甲醇-水(13:7:2)10℃以下放置的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃烘约5分钟,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。
(3)取本品10片,研碎,加乙醚30ml,水浴回流1小时,滤过,滤液挥干,残渣加醋酸乙酯1ml使溶解,作为供试品溶液。
另取当归对照药材1g,加乙醚20ml,同法制成对照药材溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验,吸取供试品溶液10μl、对照药材溶液2μl,分别点于同一硅胶G薄层板上,以正己烷-醋酸乙酯(9:1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
(4)取本品10片,研碎,加甲醇40ml,超声处理30分钟,滤过,滤液蒸干,残渣加盐酸溶液(1→50)10ml使溶解,加浓氨试液使其pH值为9~10,用乙醚提取2次,每次20ml,合并乙醚提取液,用盐酸溶液(1→50)提取2次,每次15ml,合并提取液,加浓氨试液使其pH值为9~10,用乙醚提取2次,每次20ml,合并乙醚提取液,挥干,残渣加乙醇1ml使溶解,作为供试品溶液。
另取延胡索乙素对照品,加乙醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典1995年版一部附录ⅥB)试验。
吸取供试品溶液10μl、对照品溶液1μl,分别点于同一硅胶G薄层板上,以正己烷-氯仿-甲醇(15:8:2)为展开剂,置以展开剂预饱和的层析缸内,展开,取出,晾干,置碘蒸气中熏至斑点清晰,挥净碘后,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。