
病毒中和抗体检测
1. 病毒TCID50 检测
TCID50 是指组织培养物(细胞)半数致死剂量。它有几个性质我们必须明白:1 )它表示的是计量,不是浓度;2)它是一个单位;3 )它的值等于1,实际上问它的值等于多少是一个
没有意义的问题,就像问km 的值等于多少一样,如果非要说出的的值等于多少,那我们只能说它的值在任何情况下都等于1。理解这三个性质对于理解TCID50 非常重要,但是这三个性质经
常被误解,所以导致对TCID50 的理解出现偏差。
8.2
首先我们来看一下这个表示法的意思:病毒滴度为108.2 TCID50/ml 。它表示的是每ml 病
毒溶液里含有108.2个TCID50 的病毒,这和氯化钠的浓度为4.5mol/L 表示每L 溶液中含有4.5 个mol 的氯化钠是一样的道理。经常可以听到人说我的病毒的TCID50 是10x.x。这个说法是不科学的,应该说我这个溶液里含有10x.x个TCID50 的病毒或者说我这个溶液的病毒滴度是xx -x.x
10 TCID50/ml 。也可以说病毒的TCID50 效价是10 。
TCID50=10A5.64/0.1ml。即:将病毒悬液作10人5.64稀释后,接种细胞0.1ml,可以使50%
的细胞产生CPE。(将病毒悬液作10A5.64稀释后,0.1ml中含1个TCID50,作其他一些实验时
(如中和试验),一般常用100TCID50/0.1ml 或者100TCID50/0.05ml )
本方法的优缺点:①.优点:岀现阳性结果时间较短,且较明显;②.缺点:有时候,在用枪头吸岀细胞生长液时,容易出现污染;
使用本方法时的注意事项:①.稀释病毒时,每做一个病毒稀释度都需要换枪头,减少浓度误差②.96孔板,每孔接种的细胞量:一般在此种测定病毒滴度的方法下,要将细胞密度适当调低,至少要比正常传代时低一些,否则细胞生长速度过快,未到7天则细胞岀现死亡対观察CPE不利.一般
情况下,小塑料瓶(8-9ml 液体为正常用量),培养长慢单层后,消化细胞,加入6ml 培养液,吹匀,吸岀其中的2ml, 到另外的瓶子,在该瓶中加入14-16ml 即可,如果不放心,可以用显微镜看一下,细胞数过多则补加培养液,少则补加剩余4ml 的细胞悬液;
维持液,即病毒培养液,配方为:①.MEM+2%小牛血清+3%谷氨酰胺+1%双抗+NaHCO3;
②.MEM+3%谷氨酰胺+1%双抗+NaHCO3;两种维持液的不同在于是否有FBS(小牛血清).我个人曾经做过实验,在状态很好的细胞上接种病毒,分别使用两种不同的维持液,最终结果是一样的, 没有什么不同,所以可以根据个人需要进行选择.另外,曾经请教过专门做中和实验的老师,他认为适当的FBS对细胞有保护作用,而且他说这是国外文献上的报道.
1 )细胞准备
1.1检查培养瓶中的单层细胞,以5ml胰酶-EDTA轻微冲洗
1.2 加入4-5ml 胰酶-EDTA 以覆盖单层细胞
1.3放平培养瓶,37 C 5% CO2培养箱中孵育10 —20min,直到细胞脱落
1.4 加入5-10ml 培养液,洗下细胞后移到离心管中
1.5 以PBS洗细胞两次(12000rpm, 5min )
1.6以D-MEM重悬细胞,并用血球计数板计数
1.7以D-MEM将将细胞浓度调整到1 X10A5/ml --1.5 10A5/ml
1.8在微量培养板的各孔中加入100卩细胞,相当于?X10A4细胞/孔
1.9在37 T 5 % CO2培养箱中过夜培养(18 —22h ),用处于生长相刚达到完全融合的细胞进行病毒的滴定
2)病毒制备
3)病毒稀释
3.1取冻存的病毒,以病毒生长培养液(VGM)稀释10倍,即100微升病毒液+900微升稀释液,共1毫升。(于1.5ML EP管中进行,将混合液充分吹打振荡,很重要!)
3.2做10倍稀释
3.3在另一新1.5ML EP管中加入100卩第一管稀释病毒液(1/10 ),按10的比例进行倍比稀释,再加入900卩稀释液,将混合液充分吹打振荡。以此类推共稀释至
10X3倍。
此过程中需要使用加样器和tip头。使用前用75%乙醇擦拭加样器,并用紫外线照射20min,确保无菌。使用新高压的tip头,外包装一定在超净台(或安全柜中打开)
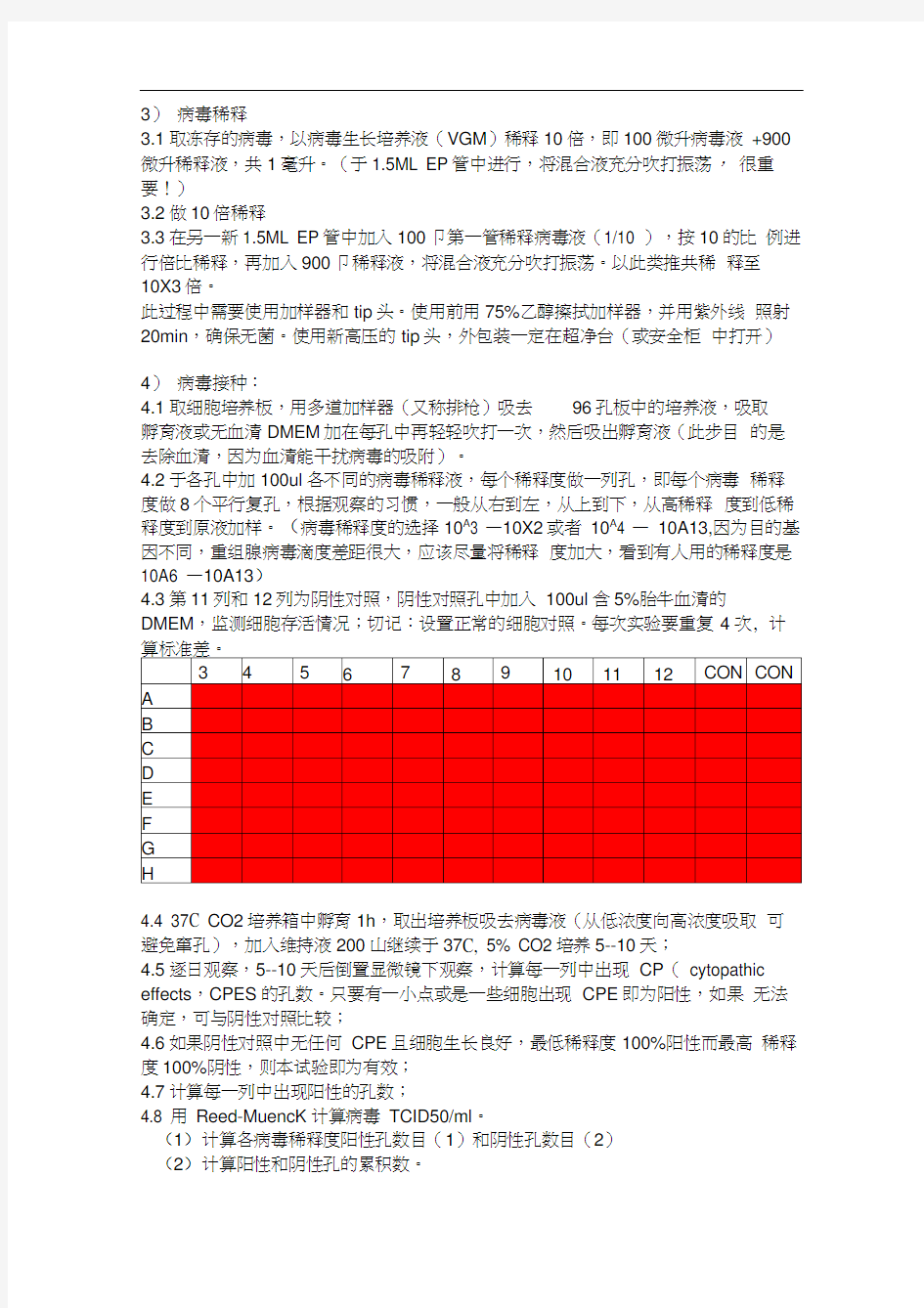
4)病毒接种:
4.1取细胞培养板,用多道加样器(又称排枪)吸去96孔板中的培养液,吸取
孵育液或无血清DMEM加在每孔中再轻轻吹打一次,然后吸出孵育液(此步目的是去除血清,因为血清能干扰病毒的吸附)。
4.2于各孔中加100ul各不同的病毒稀释液,每个稀释度做一列孔,即每个病毒稀释度做8个平行复孔,根据观察的习惯,一般从右到左,从上到下,从高稀释度到低稀释度到原液加样。(病毒稀释度的选择10A3 —10X2或者10A4 —10A13,因为目的基因不同,重组腺病毒滴度差距很大,应该尽量将稀释度加大,看到有人用的稀释度是10A6 —10A13)
4.3第11列和12列为阴性对照,阴性对照孔中加入100ul含5%胎牛血清的DMEM,监测细胞存活情况;切记:设置正常的细胞对照。每次实验要重复4次, 计
4.4 37C CO2培养箱中孵育1h,取出培养板吸去病毒液(从低浓度向高浓度吸取可避免窜孔),加入维持液200山继续于37C, 5% CO2培养5--10天;
4.5逐日观察,5--10天后倒置显微镜下观察,计算每一列中出现CP(cytopathic effects,CPES的孔数。只要有一小点或是一些细胞出现CPE即为阳性,如果无法确定,可与阴性对照比较;
4.6如果阴性对照中无任何CPE且细胞生长良好,最低稀释度100%阳性而最高稀释度100%阴性,则本试验即为有效;
4.7计算每一列中出现阳性的孔数;
4.8 用Reed-MuencK计算病毒TCID50/ml。
(1)计算各病毒稀释度阳性孔数目(1)和阴性孔数目(2)
(2)计算阳性和阴性孔的累积数。
阳性孔累积数由下向上累计(3);阴性孔累积数由上向下累计(4)
⑶计算阳性孔的百分比:比率(5)=(3)/〔(3)+(4)〕,(6)=(5)
x 100
⑷计算
距离比例(PD =(大于50%勺阳性百分比一50)/ (大于50%勺阳性百分比一小
于50%勺阳性百分比
TCID50的对数=大于50%勺阳性百分比的最高稀释对数+距离比例X稀释系数的对数
(稀释系数的对数1:10稀释为1,半对数稀释为0.5,倍比稀释为0.3 , 1:5稀释为0.7
举例计算:TCID5。的测定和计算(Reed-Muench法)
出现细胞病变(CPE以及血凝素等的细胞管数分别列于表14-2的第二和第三列它们的累计数分别列于第四和第五列(根据箭头所示方向),第六列为细胞管总数,第七列为出现细胞病变的细胞管数占细胞管总数的百分率。可见该病毒株的TCID50在10-3(91.6 %)和10-4(40%)之间,其确切稀释倍数可按下列公式计算:
91.6 (高于50%的百分数)-50
91.6 (高于50%的百分数)-40 (低于50%的百分数)
=41.6/51.6 = 0.8
将由上式获得0.8加在高于50溉亡的稀释度的对数(3)上,因此该病毒的TCID5。
-3.8
应是0.1ml 10 稀释的病毒液。查反对数得6310,即该病毒6310倍稀释液0.1ml 等于 1 个TCID50
2. 中和实验
1) 细胞准备
1.1检查培养瓶中的单层细胞,以5ml胰酶-EDTA轻微冲洗
1.2加入4—5ml胰酶—EDTA以覆盖单层细胞
1.3放平培养瓶,37 C 5% C02培养箱中孵育10 —20min,直到细胞脱落
1.4 加入5—10ml 培养液,洗下细胞后移到离心管中
1.5 以PBS洗细胞两次(12000rpm, 5min )
1.6以D-MEM重悬细胞,并用血球计数板计数
1.7以D-MEM将将细胞浓度调整到1 X10A5/ml --1.5 10<^5/ml
1.8在微量培养板的各孔中加入100卩细胞,相当于?X10A4细胞/孔
1.9在37 C 5 % CO2培养箱中过夜培养(18 —22h ),用处于生长相刚达到完全融合的细胞进行病毒的滴定
2) 待测血清准备
2.1 动物血清中,含有多种蛋白质成分对抗体中和病毒有辅助作用,如补体、免疫球蛋白和抗补体抗体等。为排除这些不耐热的非特异性反应因素,用于中和试验的血清须经加热灭活处理。各种不同来源的血清,须采用不同温度处理,猪、牛、猴、猫及小鼠血清为60 C;水牛、狗及地鼠血清为62 C;马兔血清为65 C;人和豚鼠血清为56C。加热时间为20-30min,60 C以上加热时,为防止蛋白质凝固,应先以生理盐水作适当稀释。
2.2 取已灭活处理的血清,在96 孔微量细胞培养板上,用稀释液作一系列倍比稀释,使其稀释度分别为原血清的1:2、1:4、1:8、1:16、1:32、1:64,或者按
1:10 ,1:20 ,1:40 ,1:80 ,1:160 ,1:320 ,1:640 ,1:1280 稀释,每个稀释度做3-4 个平行孔。
3) 加入病毒,感作
3.1 以VGM 将病毒稀释到100 TCID50/50 卩1(200 TCID50/100 卩)
3.2 除细胞对照孔外每孔中加入与血清量相等的病毒液,在细胞对照孔中加入与血清量相等的VGM
3.3轻混病毒—血清混和物,37 T 5 % CO2培养箱中孵育2h 4 )接种细胞
4.1准备用于接种的刚达到完全融合的细胞的培养板,吸掉培养液,加入350卩1无血清D-MEM 培养液以洗掉剩下的FBS
4.2病毒—血清混和物孵育2h结束后,各取100卩中和液到细胞培养板相应的孔中4.3 37 T 5 % CO2培养箱中孵育2h
4.4吸掉中和液,力卩250卩l DMEM洗涤
4.5加200卩l EMEM在37 C 5 % CO2培养箱中孵育3 —4d,检测培养液中血凝活性,以能保护50%细胞培养管不被感染的最高血清稀释度的倒数作为中和终点。
在制备细胞悬液时,其浓度以在24h 内长满单层为度:血清病毒中和1h 后取出,每孔加入100卩细胞悬液。置5%CO2 37 C温箱培养,自培养48h开始逐
日观察记录,14D 终判。由于各种病毒引起细胞病变时间不同,终判时间应根据病毒致细胞病变的快慢而定。
5)对照组对照的设定:包括细胞对照(培养液中仅含细胞,不含病毒和血清),阴性对照(培养液中含有l00TCID50 病毒、细胞及阴性血清)和空白对照(培养基中含有100TCID50 病毒及细胞,不含血清),各设3 个平行孔。
为保证试验结果的准确性,每次试验都必须设置下列对照,特别是在初次进行该种病毒的中和试验时,尤为重要。
阳性和阴性血清对照:阳性和阴性血清与待检血清进行平行试验,阳性血清对照应不出现细胞病变,而阴性血清对照应出现细胞病变。
病毒回归试验:每次试验每一块板上都设立病毒对照相馆,先将病毒作0.1、
1、10、100、1000 TCID50稀释,每个稀释度作4孔,每孔加50卩。1然后每孔100卩细胞悬液。0.1TCID TCID50应不引起细胞病变,而且100TCID TCID50 必须引起细胞病变,否则该试验不能成立。
血清毒性对照相:为检查被检血清本身对细胞有无任何毒性作用,设立被检血清毒性对照是必要的。即在组织细胞中加入低倍稀释的待检血清(相当于中和试验中被检血清的最低稀释度)。
正常细胞对照相:即不接种病毒和待检血清的细胞悬液孔。正常细胞对照应在整个中和试验中一直保持良好的形态和生活特征,为避免培养板本身引起试验误差,应在每块板上都设立这一对照。
6)结果判定和计算
当病毒回归试验,阳性、阴性、正常细胞对照相,血清毒性对照全部成立时,才能进行判定,被检血清孔出现100%CPE 判为阴性,50%以上细胞出现保护者为阳性;固定病毒稀释血清中和试验的结果计算,是计算出能保护50% 细胞孔不产生细胞病变的血清稀释度,该稀释度即为该份血清的中和抗体效价。
举例计算:用Reed 和Muench 两氏法(或Karber 法)计算结果,固定病毒-稀释血清法中和抗体效价计算如表2-26
血清稀释CPE数无积累CPE积累无CPE CPE比率百分数1:4(10-0.6)0/4040120/120
1:8(10-0.9)0/404080/80
1:16(101.2)1/413141/520
1:32(10-1.5)3/431414/580
1:64(101.8)4/440808/8100
80%-50%
距离比例= ------------ =0.5
80% -20%
Ig TCID50=高于50 %血清稀释度的对数—距离比例X稀释系数的对数
Ig TCID50 =—1.5 —0.5 X(—0.3)=—1.35
(稀释系数的对数1:10 稀释为1,半对数稀释为0.5 ,倍比稀释为0.3 ,1:5 稀释为0.7 )
则TCID50 = 10-1.36 , 50 卩1
因10-1.35=1/22 ,即1:22 的血清可保护50 %细胞不产生病变,1:22 就是该份血清的中和抗体效价。
影响中和试验的因素:
(1) 病毒毒价的准确性是中和试验成败的关键,毒价过高易出现假阴性能,过低会出现假阳性。在微量血清中和试验中,一般使用100-500 TCID50 。
(2) 用于试验的阳性血清规戒律,必须是用标准病毒接种易感动物制备的。
(3) 细胞量度的多少与试验有密切关系,细胞量过大或过小易造成判断上的错误,一般以在24h ,内形成单层为宜。
(4) 毒价测定的判定时间应与正式试验的判定时间相符
HIV抗体检测中心实验室样品登记 收样日期样本编号送检单位份数样本来源 或类别 样本性状初筛时间结果(详见报告) 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 1.县CDC; 2.1.VCT;2.看守所; 3. 盲样;4. 1.全血采集 2.血清 3.血浆 4. 阴性份;可疑份;复试阴性份,复试阳性 份;确证阴性份,确证阳性份。 小结 年月,共计份。其中, VCT 份;看守所份;HIV抗体阳性复试份;确证结果:阴性份,阳性份。 年月,共计份。其中, VCT 份;看守所份;HIV抗体阳性复试份;确证结果:阴性份,阳性份。
中和试验方法操作规程 1.目的:建立中合实验法,统一操作标准,确保产品质量。 2.适用范围:公司生物制品效价测定的中合实验。 3.责任:质检人员有按此程序进行操作的责任,质量管理部经理有检查监督的责任。 4.程序: 4.1:实验前准备 ①、9-10日龄的SPF鸡胚、病毒。 ②、样品稀释管、病毒稀释管、打孔器、镊子、5ml吸头、1ml、200ul吸头各一盒、废弃物缸、烧杯,以上物品均需灭菌处理 ③、照蛋器、电炉、旋涡混合器、5ml微量移液器、1ml微量移液器、200ul微量移液器、记号笔、酒精棉球、碘棉、打火机、蜡、玻璃棒、无菌手套 ④、实验开始前记得要使房间温度达到30摄氏度左右,房间要紫外照射30min,生物安全柜紫外照射30min准备要用的检测用品同步放在生物安全柜里紫外照射。 4.2:稀释 ①、将样品用生理盐水2倍系列稀释,使之成1:2;1:4;1:8;1:1;,1:32;1:64;1:128;1:256;1:512;1:1024......。 ②、病毒的稀释:将病毒稀释成每单位剂量含200ELD50.。例如:病毒ELD50=10-8.375/0.1ml,将病毒稀释成每单位剂量含200ELD50的稀释倍数=108.375/200=1.2*106。即将病毒稀释 1.2*106倍即为200ELD50/0.1ml。 ③、准备七根试管(或EP管),编号1-7,在1号管中加入 0.2ml灭菌生理盐水,2-7号管中各加入9ml 灭菌生理盐水.再将ELD50=108.375/0.1ml 的病毒取1ml加入1号管中震荡混匀,再从1号管中取1ml加入2号管中震荡混匀,依次10倍系列稀释至第7管。(依据最后接种量和接种鸡胚数计算出中和抗体用病毒的量,7号管可以多稀释几支备用。) 4.3:中和:将稀释成每单位剂量含200 ELD50的病毒与等量的2倍系列稀释的待检样品混合,37度中和1小时,准备接种鸡胚。
检测乙型脑炎病毒中和抗体的简化试验 摘要:在亚洲,乙型脑炎病毒是病毒性脑炎的常见病因,据统计,每年大约有45000例病例。它导致显着的发病率和死亡率。乙型脑炎病毒主要通过库蚊在鸟类和动物之间传播,而人类被认为是其终末宿主。由于登革热在乙型脑炎流行地区也很普遍,因此必须通过检测乙型脑炎病毒特异性中和抗体来证实乙型脑炎阳性血清。噬斑减少中和试验是检测以及量化乙型脑炎病毒中和抗体的黄金标准。然而,噬斑减少中和试验大约需要一个星期,并且在在6个或24孔板中进行,这对于大规模筛选具有局限性。因此有必要开发一种可用于检测和定量乙型脑炎病毒中和抗体的简化方案。该法在96孔板中进行,将适合用于大规模筛查人群的免疫水平以及疫苗的免疫效力研究。 关键词:乙型脑炎病毒;中和抗体;酶联免疫 引言 在亚洲,主要由节肢动物传播的乙型脑炎病毒是病毒性脑炎的常见病原。据统计,每年大约有45000个病例,死亡率为25%;并且有高达50%的患者留有神经系统后遗症(世界卫生组织,1996年)。 乙型脑炎病毒为RNA正链病毒,属于黄病毒科。病毒发生表现有地方性周期性特点,库蚊和猪为其主要的宿主,病毒在其体内大量复制。然而,人类被认为是其终末宿主。(Sabchareon和Yoksan,1998) 在亚洲许多地方乙型脑炎病毒都有流行,往往在这些地方都伴随有登革热病毒流行。因此,为了与登革热区分,就必须通过检测乙型脑炎病毒特异性中和抗体来证实其确为乙型脑炎病毒阳性血清。此外,检测中和抗体也可作为检测乙型脑炎疫苗效力的合理的替代措施。(Markofff L.,2000)。“斑减少中和试验是检测和量化乙型脑炎病毒中和抗体的标准方法(Shyu等.1997)。然而,斑减少中和试验需要一周才能完成并且仅在6或24孔板中进行,从而对于大规模的筛选表现出一定的局限性,在疫苗的效力学研究以及血清流行病学调查方面其局限性表现得更加突出。结果通过肉眼计数斑块的数量来获得,而这,也有一定的主观偏差。一种简便有效的检测和测定与病毒或疫苗反应后的中和抗体含量的方法显得尤为重要。 已经研究出了几种方法来改善蚀斑减少中和试验。在微焦点减少中和试验(Jirakanjanakit等,1997)和荧光灶抑制试验(Thacker等,1978),聚焦灶可分别通过过氧化物酶以及抗过氧化物酶荧光染色技术看到。然而,与噬斑减少中和试验相似,聚焦灶也必须人工计数。另一组通过竞争ELISA来检测乙型脑炎病毒的特异性抗体(Chow等,1997)。该法用三种单克隆抗体与测试血清竞争性结合包被在微滴度板上的乙型脑炎抗原。此法虽然能够区分登革热抗体与日本脑炎病毒中和抗体,但不能检测所有类型的乙型脑炎病毒中和抗体。 为了解决上述缺点,经过多次改进研究出了一种简捷的方法,中和酶联免疫法,这种方法在其他病毒如麻疹(Lee等,1999)的检测中已经得到了应用。 方案如下:Vero细胞购自美国模式培养物保藏中心(ATCC编号:CRL-1586,Vero细胞-1008)。乙型脑炎病毒(中山株)由陈佑昌教授提供。(新加坡国立大学)。细胞培养在199培养基(Gibco公司),加入0.042%的钠碳酸氢钠(Merck)和2mM HEPES(Gibco公司)并添加8%胎牛血清(Hyclone公司)。 维持液由1X的199培养基,0.028%碳酸氢钠和2mM HEPES并添加2%胎牛血清(FCS)配置成。所用的血清在新加坡一个离岸的岛屿上从26头野生的猪体内取样获得。本次试验进行了重复。
常用的单克隆抗体检测方法 通过杂交瘤技术制备单克隆抗体,在杂交瘤制备完成后,需要对抗体进行一个检测,本文介绍了几种常用的抗体检测的方法(1)免疫酶技术免疫酶技术是将抗原抗体反应的特异性和酶对底物显色反应的高效催化作用有机结合而 成的免疫学技术。由于它特异性强,灵敏度高,现已广泛用于筛选和鉴定单抗。①器材和试剂a、包被缓冲液:碳酸盐缓冲液:取0.2mol/L Na2CO3 8ml,0.2mol/L NaHCO3 17ml 混合,再加75ml蒸馏水,调PH至9.6。Tris-HCl缓冲液(PH8.0,0.02mol/L):取0.1mol/L Tris 100ml,0.1mol/L HCl 58.4ml混合,加蒸馏水至1000ml。b、洗涤缓冲液(PH7.2的PBS):KH2PO4 0.2g,KCl 0.2g,Na2HPO4·12H2O 2.9g,NaCl 8.0g,Tween-20 0.5ml,加蒸馏水至1000ml。c、稀释液和封闭液:牛血清白蛋白(BSA)0.1g,加洗涤液至100ml;或用洗涤液将小牛血清配成5-10%使用。d、酶反应终止液(2mol/L H2SO4):取蒸馏水178.3ml,滴加浓硫酸(98%)21.7ml。e、底物缓冲液(PH5.0,磷酸盐-柠檬酸缓冲液):取0.2mol/L Na2HPO4 25.7ml,0.1ml/L柠檬酸24.3ml,再加50ml蒸馏水。柠檬酸溶液及配成的底物缓冲液不稳定,易形成沉淀,因此一次不宜配制过多。f、底物使用液:OPD底物使用液(测490nm的OD值):OPD 5mg,底物缓冲液10ml,3% H2O2
0.15ml。TMBS或TMB底物使用液(测450nm的OD值):TMBS或TMB(1mg/ml)1.0ml,底物缓冲液10ml,1% H2O2 25ul。ABTS底物使用液(测410nm的OD值):ABTS 0.5mg,底物缓冲液1ml,3% H2O2 2ul。g、抗体对照:以骨髓瘤细胞培养上清作为阴性对照,以免疫鼠血清作为阳性血清。h、抗原:可溶性抗原:尽量纯化,以获得高特异性。病毒感染的传代细胞或全菌抗原。淋巴细胞等悬液。i、酶标抗鼠抗体或酶标SPA或其他类似试剂。j、细胞固定液:-20℃丙酮;或丙酮-甲醛固定液:Na2HPO4 100mg,KH2PO4 500mg,蒸馏水150ml,丙酮225ml,甲醛125ml;或丙酮-甲醛溶液(1;1);或-20℃甲醇。k、聚苯乙烯微孔板:40孔、96孔、或条孔;硬板或软板均可使用。l、酶联免疫阅读仪;或光镜。m、吸管、加样器及水浴箱、离心机等。②可溶性抗原的酶联免疫吸附试验(ELISA)a、纯化抗原用包被液稀释至1-20ug/ml。 b、以50-100ul/孔量加入酶标板孔中,置4℃过夜或37℃吸附2小时。 c、弃去孔内的液体,同时用洗涤液洗3次,每次3-5分钟,拍干。 d、每孔加200ul封闭液4℃过夜或37℃封闭2小时;该步骤对于一些抗原,可省略。 e、洗涤液洗3次;此时包被板可-20℃或4℃保存备用。 f、每孔加50-100ul 待检杂交瘤细胞培养上清,同时设立阳性、阴性对照和空白对照;37℃孵育1-2小时;洗涤,拍干。 g、加酶标第二抗体,每孔50-100ul,37℃孵育1-2小时,洗涤,拍干。 h、加底物
禽流感病毒中和实验及其他方法 (一)实验材料 1、中和反应实验材料 (1)病毒: )的滴定。 一般为鸡胚尿囊病毒液,进行中和实验前,需要进行病毒滴度(TCID 50 (2)血清样品 包括待检血清和阳性以及阴性对照血清。人血清实验前需要56℃ 30分钟灭活,动物血清需RDE处理。-20℃储存,避免多次反复冻融。 (3)MDCK细胞和细胞培养试剂 1)MDCK细胞(狗肾上皮细胞) 2)MDCK细胞培养液:DMEM+5%牛血清+抗生素,过滤除菌 500毫升 DMEM(修饰的Eagles培养基) 5.5毫升 100×抗生素(100单位/毫升青霉素+100微克/毫升链霉素) 5.5毫升 100×L-Glutamine(2毫摩尔) 25.5毫升 56℃、30分钟加热灭活的牛血清 3)胰酶 / EDTA (4)其它
1)平底96孔微量培养板 2)病毒稀释液:DMEM+1%牛血清白蛋白+抗生素,即配即用。 429毫升 DMEM 66毫升 7.5%牛血清白蛋白(BSA) 5毫升 100×抗生素 3)TPCK-胰酶(使用浓度为2微克/毫升) 4)固定液:80%的丙酮,即配即用,4℃保存 400毫升丙酮 100毫升 PBS,PH 7.2 2、ELISA实验材料 (1)抗体1:鼠抗流感病毒甲型核蛋白克隆抗体 (2)抗体2:辣根过氧化物酶标记的羊抗鼠IgG (3)洗涤液:PBS+0.05%TWEEN-20 4升 PBS,PH 7.2 2毫升 TWEEN-20 (4)封闭液:PBS+1%牛血清白蛋白+0.05%TWEEN-20 867毫升PBS,PH 7.2 132毫升牛血清白蛋白 1毫升TWEEN-20
第23章病毒感染的实验诊断 一、教学大纲要求 (1)标本的采集、处理与运送注意事项 (2)病毒形态学检查方法 (3)病毒的分离与鉴定程序及方法 (4)病毒感染的快速诊断方法 二、教材内容精要 (一)标本的采集、处理与运送 根据临床诊断及病期采集不同的标本,用于病毒学分离和鉴定的标本应在病程初期或急性期采集,要进行预处理才能用于接种和其他方法的检测。病毒的抵抗力通常较弱,在室温下很快灭活,标本采集后应立即送到病毒实验室,暂时不能检查或分离培养时,应将标本放入冻存液并加入甘油或二甲基亚砜(DMSO)以防止反复冻溶使病毒灭活,存放在-70℃低温冰箱内保存。 (二)病毒形态学检查 1.光学显微镜 仅用于大病毒颗粒(如痘类病毒)和病毒包涵体的检查。 2.电子显微镜检查法 (1)电镜直接检查法 某些病毒感染的早期,临床标本中就可出现病毒颗粒。标本经粗提浓缩后用磷钨酸盐负染,电镜下直接观察,可发现病毒颗粒,获得诊断。 (2)免疫电镜检查法 将病毒标本制成悬液,加入特异性抗体、混匀,使标本中的病毒颗粒凝集成团,再用电镜观察,可提高病毒的检测率。本法比电镜直接检查法更特异,更敏感。 3.超过滤法 用不同孔径的火棉胶滤膜过滤病毒悬液,将获得的滤液接种于组织细胞、实验动物或鸡胚,或用血凝试验来测定病毒是否通过滤膜,从而估计病毒的大小。 4.超速离心法 根据病毒大小的不同,其沉降速度也不同。可用超速离心法测得病毒的沉降系数(S),借以计算病毒的大小。 5.X线晶体衍射法 根据X线衍射图谱,用数学方式处理来研究病毒结构亚单位和分子结构等。但标本必须为结晶,
可用于无包膜病毒的研究。 (三)病毒的分离与鉴定 1.病毒分离培养 实验室分离培养病毒的方法主要有三种:动物接种、鸡胚接种和组织培养。根据细胞的来源、染色体特性和传代次数的不同,可分为:原代和次代细胞培养,二倍体细胞培养,传代细胞培养。 2.病毒在培养细胞中增殖的指标 (1)细胞病变效应(cytopathic effect,CPE)。 (2)红细胞吸附 (3)干扰现象 (4)细胞代谢的改变 3.新分离病毒的鉴定 (1)病毒核酸类型的测定用RNA酶及DNA酶可鉴定出病毒核酸的类型。另外,DNA病毒受5-氟尿嘧啶的抑制,而RNA病毒不受影响。用此方法亦可区分DNA与RNA病毒。 (2)理化性状的检测对脂溶剂的敏感性:有包膜的病毒(如正粘病毒、副粘病毒、逆转录病毒等)含有脂类,对乙醚、氯仿和胆盐等脂溶剂均敏感,经作用后病毒失去感染性,而无包膜的病毒对脂溶剂有抵抗。耐酸性试验:肠道病毒与鼻病毒均属于小RNA病毒科,均耐乙醚。但前者可耐pH3,而后者在pH3~5环境中很快被灭活,故可将两者相区别。 (3)血清学鉴定病毒型别的最后鉴定必须依靠血清学方法。将分离的病毒与已知的诊断血清作各种试验进行鉴定。 (四)病毒的血清学检测 血清学试验是诊断病毒感染和鉴定病毒的重要手段,也是研究病毒的主要方法之一。血清学试验的方法很多,最常用的如中和试验、补体结合试验、血凝及血凝抑制试验等。 1.中和试验 中和试验是病毒型特异性反应,是指应用特异性抗体中和病毒的致病性或感染性的试验。将病人血清与一定量的已知病毒混合,作用一定时间后,接种于实验动物、鸡胚或细胞培养中,观察病毒的致病作用是否被中和而不出现感染指标。以此判断病人血清中有无特异性抗体存在。本法特异性高,但操作比较复杂,费时。主要用于鉴定病毒;分析病毒抗原的性质;测定免疫血清的抗体效价和疫苗接种后的效果;测定病人血清中的抗体,用于诊断病毒性疾病。 2.补体结合试验 特异性病毒抗原和相应的抗体结合形成免疫复合物时能结合补体。本实验操作繁琐,特异性较
万方数据
中国生物制品学杂志2008年9Y]第21卷第9期ChinJBiologicalsSeptember2008。V01.21No.9.811. 1.2试剂 DMEM培养基、胎牛血清和转染试剂Lipofec—tamine2000均购自美国GIBCO公司;HIV.1阳性血清分离自广西艾滋病患者;碱性磷酸酶标记的羊抗人IgG购自JacksonImmunoResearchlaboratories,INC;BCIP/NBT购自福建迈新生物技术公司。 1.3细胞培养和转染 于转染前一天将2.5X105个293T细胞接种于6孔板,至第2天达70%一80%单层时,将质粒pNL4-3.Luc.R.E(9¨g)分别与带有HIV.1Envelope基因的真核表达质粒peDNA3.1EnvB/C亚型(1斗g)和VRl012EnvC亚型(1斗g)共转染293T细胞,两种质粒按9:1摩尔比稀释于250Ixl无血清无抗性DMEM溶液中,温和混匀;用前混匀Lipo—fectamine2000,取6Ixl溶于无血清无抗性DMEM,温和混匀,室温作用5min;将上述两种溶液混匀,室温作用20rain;加入细胞培养液内,混匀,置37℃5%CO:培养箱中培养48h。Westernblot检测目的基因在293T细胞中的表达,同时检测荧光素酶含量。 1.4假病毒感染 转染48h后,收集瞬时转染的细胞培养上清,3000r/rain离心10min,用O.45¨m滤器去除细胞残渣,获得HIV.1假病毒。 将靶细胞HOS.CD舡CCR5/CXCR4接种6孔板,8×104个/孔,37℃5%C02培养24h,每孔加入200山假病毒,置37℃5%CO:细胞培养箱孵育lh;再向各孔中加入DEAE,终浓度17VLg/ml,置37℃细胞培养箱培养5h后,向各孔中补加无抗性完全DMEM培养基,至终体积为IInl,培养72h后裂解细胞,检测荧光素酶含量。 1.5WesternbIot检测 收集感染后的细胞,进行SDS.PAGE,将蛋白电转移到硝酸纤维素膜上,加入PBS溶解的3%脱脂奶粉,室温封闭lh;用PBsT(Tween.20终浓度为o.2%)洗涤1次,5min/次;加入含HIV-1阳性血清的PBS(含l%脱脂奶粉),振摇1.5h;用PBsT洗膜3次,5min/次;加入含碱性磷酸酶标记的羊抗人IgG的PBS(含l%脱脂奶粉),振摇30—45Illin;用PBST洗膜3次,5rain/次;用PBS洗涤1次;取66¨lNBT和33斗lBCIP溶液,与10Inl碱性磷酸酶缓冲液混匀,浸泡膜显色。 1.6荧光素酶检测 吸弃待检细胞培养基,用PBS漂洗细胞2—3次;加入1×裂解缓冲液覆盖细胞;将细胞从培养皿刮下,漩涡振荡5—10s,12000g离心15s(室温);取上清液80仙l,加入荧光仪器专用检测板中,并加平衡至室温的荧光反应底物,30斗l/孔,仪器读数检测荧光素酶含量(样品须在20min内检测,否则影响酶活力;暂时不测的样品保存于-80℃)。 1.7统计学分析 实验数据应用统计学软件SPSSIO.0进行统计学分析,样本显著性分析用配对t检验。 2.结果 2.1目的蛋白在293T细胞中的表达 Westernblot结果显示,共转染质粒peDNA3.1EnvB/C与pNL4.3.Luc.R.E和VRl012EnvC与pNL4.3.Luc.R.E的293T细胞均有HIV.1结构蛋白G/lg:pol和Env的表达,相对分子质量分别为55000和160000;而单独转染pNIA.3.Luc.R.E及pNIA.3.Luc.R.E+VRl012质粒的细胞只有结构蛋白Ga91)ol的表达,见图1。 l:pr岫marker;2:pNL4-3.Lug.R.E+pcDNA3.1EnvB/C;3:pNL4-3.Luc.R-E4-VRl012EnvC;4:blankcontrol;5:pNIA-3.Luc.R-E+VRl012;6:pNIA-3.Luc.R-Il图1目的蛋白在293T细胞中表达的Westernblot检测№1.Westernblottingofexpressedproductin293Tcells 2.2转染的293T细胞荧光素酶含量 将表达荧光素酶的pNL4.3.Luc.R.E质粒单独转染或与表达Env基因的质粒共转染293T细胞后,均有很强的荧光素酶的表达。peDNA3.1EnvB/C共转染组和VRl012EnvC共转染组与空白对照组(293T细胞)相比,其荧光素酶表达强度均显著升高(tl-1.570,t2=1.189,P均小于0.01),见图2。2.3假病毒感染HoS-CD4?CCI巧/CXCR4细胞后的荧光素酶含量 结果表明,pNL4.3.Luc.R.E和pcDNA3.1EnvB/C以及pNIA.3.Lue.R.E和VRl012EnvC共转 染后的细胞上清均能检测到荧光素酶表达,证明荧 万方数据
蛋鸡抗体检测实验室建设方法 一、面积、台面、墙面 面积至少要有6平方,放置一张操作台(桌子,面要平,长1.5米,宽1米),一张凳子,墙用彩钢板隔开,制作一个门,保持空间独立。 二、器材 1、一台小高压锅,用于灭菌。 2、冰箱,用于盛放易耗品等。 3、离心机(5000转以下)一台,用于制作红细胞。 4、移液枪两把,一把为1毫升的,另一把为200微升的。 5、电子天平一台。 三、耗材 1、枪头,1毫升的及200微升的,各500个。 2、盛放枪头的盒子,两种规格,各5个。 3、Ependorf管100个,Ependorf管架2个。 4、葡萄糖瓶子10各。 5、量筒2个。 6、记号笔一支。 四、 血凝试验(HA) 定义:某此病毒或病毒的血凝素,能选择性地使某种或某几种动物的红细胞发生凝集,这种凝集红细胞的现象称为血凝(hemagglutination,HA),也称直接血凝反应,利用这种特性设计的试验称血凝试验 (HA) 血凝抑制试验(HI) 定义:当病毒的悬液中先加入特异性抗体,且这种抗体的量足以抑制病毒颗粒或其血凝素,则红细胞表面的受体就不能与病毒颗粒或其血凝素直接接触。这时红细胞的凝集现象就被抑制,称为红细胞凝集抑制(hemagglutination inhibiion,HI)反应,也称血凝抑制反应,利用这种特性设计的试验称血凝试验 (HI) 。 原理:特异性抗体与相应病毒结合,使病毒失去凝集红细胞的能力,从而抑制血凝现象。 用于禽流感、新城疫等具有血凝性病毒的鉴定 根据抗原与相应抗体的特异性中和反应原理,给未知病毒悬液中加入已知的抗禽流感病毒阳性血清或已知的抗新城疫病毒阳性血清,相应病毒便丧失了其凝集红细胞的能力。因此,可利用从发病的鸡、鸭、鹅体内分离的病毒作HA和HI试验。病毒悬液能凝集红细胞,并且能被已知的抗血清(阳性血清)所抑制,那么该病毒即是已知阳性血清相对应的病毒。如用新城疫阳性血清完全抑制了未知病毒培养物的血凝性,那么,这个未知病毒培养物就是新城疫病毒;如果病毒悬液虽然能凝集鸡红细胞,但不能被鸡新城疫血清所抑制,说明不是鸡新城疫病毒,可能是其他有血凝性的病毒。 阿氏(Alsevers)液配制
口蹄疫O型间接血凝抗体检测试验 一、原理: 用已知血凝抗原检测未知血清抗体的试验,称为正向间接血凝试验(IHA)。 抗原与其对应的抗体相遇,在一条件下形成抗原—抗体复合物。但这种复合物的分子团很小,肉眼看不见。将抗原吸附(致敏)在红细胞表面,制成口蹄疫血凝抗原,用于检测免疫动物血清中的口蹄疫抗体水平。这种经过口蹄疫抗原致敏的红细胞与口蹄疫抗体相遇,红细胞便出现清晰的凝集现象。 二、主要组分: 1.口蹄疫O型血凝抗原5ml/瓶,5瓶/盒; 2.口蹄疫O型阳性对照血清0.5ml/管,1管/盒,阳性血清已1:4稀释; 3.口蹄疫O型阴性对照血清0.5ml/管,1管/盒; 4.稀释液50ml/瓶,2瓶/盒; 5.封板膜10张/盒。 三、试验器材: 1.96孔110°V型医用血凝板; 2.8道或12道移液器; 3.微量振荡器。 四、物理性状: 1.抗原摇匀呈棕红色(或咖啡色),静置后,血球逐渐沉入瓶底; 2.阴性对照血清淡黄色清亮稍带粘性的液体; 3.阳性对照血清微红或淡黄色稍浑浊带粘性的液体; 4.稀释液淡黄或无色透明液体,低温下放置,瓶底易析出少量结晶,在水浴中加温后即可全溶,不影响使用。 五、作用与用途: 用于检测口蹄疫O型疫苗免疫动物血清抗体效价。 六、用法与判定: 1、用法 1.1加稀释液 在血凝板上1~7排的1~10孔、第8排的1~4孔和第5~7孔;加稀释液50μl/孔。 1.2稀释待检血清 待检血清使用前,需经过56℃水浴灭活30分钟,取待检灭活血清样品50μl,分别加入反应板1~6排的第1孔中,与稀释液混匀后,吸取50μl,加于第2孔中,依次作2倍系列稀释至第10孔,第10孔混匀后取出50μl弃去。 1.3稀释阳性对照血清 在血凝板的第7排第1孔加阳性血清50μl,2倍系列稀释至第10孔,混匀后从该孔取出50μl丢弃。此时被检血清和阳性血清的稀释倍数依次为1:2~1:1024。
第十三章 中和试验(neutralization test) 学习要点: 毒价滴定; 终点法中和试验; 空斑减少试验。 病毒或毒素与相应的抗体结合,抗体中和了病毒或毒素,失去了对易感动物的致病力,这种试验称为中和试验。 一、简单定性中和试验——毒价滴定 主要用于鉴定病料中病毒及病毒的类型,亦可用于毒素的鉴定。试验方法:根据病毒的易感性选定试验动物(鸡胚或细胞)及接种途径。将动物分为对照组与实验组。试验组:取待检病料磨碎,加生理盐水稀释,加双抗,在冰箱中作用1h或经过滤器过滤,与已知的抗血清等量混合,置于37℃中作用1h后接种动物。对照组则用正常血清加入稀释病料,作用后,接种另一种动物。对照组动物发病死亡,而试验组动物不死,即证实病料中含有与已知抗血清相应的病毒。
二、终点法中和试验 1、固定血清稀释病毒法 将病毒用2倍递增稀释,分置二列试管:第一列加入正常血清(对照组);第二列加入待检血清(试验组)。二列试管分别振荡均匀,置370C中作用1h,将各管混合液分别接种试管动物,每管用3-5只动物。接种后观察数目,并记录死亡数。观察结束后,计算起LD50及中和指数。
2、固定病毒稀释血清法 本法用以测定抗病毒的血清中和效价。将待检血清稀释,加等量已知毒价的病毒液,在试管内中和湖接种动物,观察动物发病及死亡情况,计算其只能中和效价。
三、空斑减少试验 在细胞培养时作中和试验可采用空斑减少法。一种能使细胞致病变的病毒,在细胞培养上生长后,因其致病变作用使细胞单层脱落,pH与无病变地方也不一样,该处与周围明显不同的、一个局限性的变性细胞区称为空斑。一个空斑可以当作一个病毒生长的集落,一个单位内空斑数多,病毒就多,故可测出病毒空斑形成单位。这样,加抗血清与不加抗血清的病毒空斑形成单位之差,就称为空斑减少试验。使空斑减少50%的血清西式度,就是该血清的中和价。
ELISA(酶联免疫吸附测定,enzyme linked immunosorbent assay)指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体结合专一性进行免疫反应的定性和定量检测方法。 基本原理: ①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。 ②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。 ③在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。 ④加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅有无定性或定量分析。由于酶的催化效率很高,故可极大地放大反应效果,从而使测定方法达到很高的敏感度。 双抗夹心法 夹心法常用于检测大分子抗原,一般的操作步骤为: ①将具有专一性的抗体固著于塑胶孔盘上,完成后洗去多余抗体; ②加入待测检体,检体中若含有待测的抗原,则其会与塑胶孔盘上的抗体进行专一性键结; ③洗去多余待测检体,加入另一种对抗原专一的一次抗体,与待测抗原进行键结; ④洗去多余未键结一次抗体,加入带有酶的二次抗体,与一次抗体键结; ⑤洗去多余未键结二次抗体,加入酶底物使酵素呈色,以肉眼或仪器读取呈色结果。 间接法 间接法常用于检测抗体,一般的操作步骤为: ①将已知的抗原固著于塑胶孔盘上,完成后洗去多余的抗原。
②加入待测检体,检体中若含有待测的一次抗体,则其会与塑胶孔盘上的抗原进行专一性键结。 ③洗去多余待测检体,加入带有酶的二次抗体,与待测的一次抗体键结。 ④洗去多余未键结二次抗体,加入酶底物使酶呈色,藉仪器(ELISA reader)测定塑胶盘中的吸光值(OD值),以评估有色终产物的含量即可测量待测抗体的含量。 竞争法 竞争法是一种较少用到的ELISA检测机制,一般用于检测小分子抗原,其操作步骤为: ①将具有专一性的抗体固著于塑胶孔盘上,完成后洗去多余抗体; ②加入待测检体,使检体中的待测抗原与塑胶孔盘上的抗体进行专一性键结; ③加入带有酶的抗原,此抗原也可与塑胶孔盘上的抗体进行专一性键结,由于塑胶孔盘上固著的抗体数量有限,因此当检体中抗原的量越多,则带有酶的抗原可键结的固著抗体就越少,亦即,两种抗原皆竞相与塑胶孔盘上抗体键结,即所谓竞争法之由来。 ④洗去检体与带有酶的抗原,加入酶底物使酶呈色,当检体中抗原量越多,代表塑胶孔盘内留下之带有酶的抗原越少,显色也就越浅。 注:当需要侦测无法获得两种以上单一性抗体的抗原,或是不易得到足够的纯化抗体以固著于孔盘上时,一般会考虑使用竞争法ELISA。
病毒中和试验测定法 1.固定病毒稀释血清法(α法) 本法用于抗血清的中和价。试验需先滴定病毒 毒价,试验时将其稀释成每一单位剂量含200个TCID 50 ,再将待检血清倍比稀释 加等量200个TCID 50 /ml的病毒液,混匀后37℃1h,每一稀释度接种24孔细胞 培养板4孔,每孔。5%C0 2 培养箱培养一定时间后,记录出现CPE孔数,以不出现CPE数和接种数的比为中和比值。按Karber法计算中和价。其公式如下: Log TCID 50 =L+d() (TCID50用对数计算,L为病毒最低稀释度的对数。d为组距,即稀释系数,在10倍系列稀释则为-1,S为各组CPE与接种数比值之和) 50%中和试验举例 每一接种剂量含病毒 100TCID50或 100LD50或100EID50或100ID50 L=-1,d=,S=4/4+4/4+4/4+4/4+2/4= 代入Karber公式:LogND 50= -1-* 该抗血清ND 50 (半数中和单位)为,即1/160, 则其中和价为160 ND 50 /ml,可以简写成160。 2.固定血清稀释病毒法(β法) 本法用于测定抗血清的中和指数。将病毒原液10倍系列稀释,分列于2排无菌管,第一排加等量正常血清(对照组);第二排加待检血清(中和组),混匀后,置37℃1h,分别接种细胞板孔(或鸡胚、实验 动物)进行培养,记录CPE(鸡胚、动物死亡数),计算TCID 50(或LD 50 ),按下 式计算中和指数。 中和组TCID 50(或LD 50 ) 中和指数= ———————————— 对照组TCID 50(或LD 50 ) 查反对数,即得该待检血清的中和指数。通常中和指数>50者判为阳性,
市面上唯一的人的IL-17中和抗体—R&D systems公司 白细胞介素家17族(Interleukin 17 family,IL-17家族),是与白细胞介素17(Interleukin 17,IL-17)具有较高同源性、在脊椎动物进化中高度保守的一组蛋白质,目前共有六个成员,IL-17A (原IL-17)、B、C、D、E和F[1]。其中,IL-17B、C、D、E、F的编码基因,是在人类基因组大规模测序过程中,通过同源性分析、EST序列拼接得到的。 白细胞介素17E(Interleukin 17E,IL-17E),又称作IL-25,是由活化的记忆T细胞产生的一种前炎细胞因子,可诱导多种趋化因子和细胞因子的表达,在炎症和造血过程中发挥重要作用。 优宁维代理的R&Dsystems公司的人的IL-17中和抗体(MAB13352)是市面上唯一的人的IL-12中和抗体,其ND50值在0.1-0.6ug/ml的范围。 Cell Il-6 Secretion Induced by IL-17F and Neutralization by Human IL-17F Antibody.Recombinant Human IL-17F induces IL-6 secretion in the NIH-3T3 mouse embryonic fibroblast cell line in the presence of in a dose-dependent manner (orange line), as measured by the Mouse IL-6 Quantikine kit (Catalog # M6000B). Under these conditions, IL-6 secretion elicited by IL-17F is neutralized (green line) by increasing concentrations of Mouse Anti-Human IL-17F Monoclonal Antibody (Catalog # MAB13352). The ND50 is typically 0.1-0.6 ug/mL.
流感病毒作用机理及抗流感药物研究进展 S1130556 田玉伟 摘要:流感病毒是人类健康的一大威胁。应对流感病毒的主要方式是疫苗和药物治疗。对可能大规模爆发的流感疫情来讲, 药物治疗是最好的控制流感病毒传播的手段。本文主要从流感病毒致病机理及抗流感病毒药物研究最新进展方面进行阐述。 关键词:流感病毒;抗病毒作用机制;抗流感病毒药物; The mechanism of influenza virus and the development of anti-influenza virus agent Abstract : Influenza is a major threat to millions of people worldwide. Vaccines and antiviral agents are two main options available to reduce the impact of the influenza virus, while anti-influenza agents are the most effective means to prevent the transmission of the highly contagious virus and to treat the epidemics of disease. In this article, recent progress in the research of the action mechanisms and structure-activity relationships of these anti-influenza virus agents were reviewed. Keywords: influenza virus ;anti-viral mechanism;anti-influenza virus agent; 1 流感病毒生物学结构 流行性感冒病毒[1-3](influenza virus)简称流感病毒,属正粘病毒科(orthomyxoviridae),呈球状或丝状,是一种有包膜和分节段的单链、负链RNA病毒。它可分为甲、乙、丙3型。甲型流感病毒常以流行形式出现,特点是传染性强,发病率高,传播快,可引起爆发流行乃至世界大流行,并可在动物中引起流行和造成大量动物死亡。乙型流感病毒,常引起流感局部爆发,不引起大流行。丙型流感病毒主要以散在形式出现。 流感病毒的基因由8个单链RNA片段组成,分别为NA、HA、NP、M、NS、PB1、PB2和PA基因。它们编码10种蛋白:膜蛋白血凝素(Hemagglutinin HA),神经氨酸酶(Neuraminidase NA),基质蛋白(Matrix protein1 M1,核蛋白(Nucleoprotein NP),3种RNA依赖多聚糖(RNA-dependent RNApolymerase PB1、PB2和PA)离子通道蛋白(Ion channel protein M2)和非结构蛋白(Non-structural protein NS1和NS2)。
第十一章血清学试验 第五节中和试验 根据抗体能否中和病毒的感染性而建立的免疫学试验,称中和试验(Neutralization test)。中和试验极为特异和敏感,既能定性又能定量,主要用于病毒感染的血清学诊断、病毒分离株的鉴定、病毒抗原性的分析、疫苗免疫原性的评价、血清抗体效价的检测等。中和试验可在体内进行也可在体外进行。 体内中和试验也称保护试验,试验时先对实验动物接种疫苗或抗血清,间隔一定时间后,再用一定量病毒攻击,最后根据动物是否得到保护来判定结果。常用于疫苗免疫原性的评价和抗血清的质量评价。 体外中和试验是将抗血清与病毒混合,在适当条件下作用一定时间后,接种于敏感细胞、鸡胚或动物,以检测混合液中病毒的感染力。根据保护效果的差异,判断该病毒是否已被中和,并可计算中和指数,即中和抗体的效价。根据测定方法不同,中和试验有终点法中和试验和空斑减数法中和试验等方法。 毒素和抗毒素也可进行中和试验。其方法与病毒的中和试验基本相同。 一、终点法中和试验 终点法中和试验(Endpoint neutralization test)是滴定使病毒感染力减少至50%时,血清的中和效价或中和指数。有固定病毒稀释血清和固定血清稀释病毒两种方法。 (一)固定病毒稀释血清法将已知的病毒量固定,血清作倍比稀释,常用于测定抗血清的中和效价。 1.病毒毒价单位病毒毒价(毒力)的单位过去多用最小致死量(MLD),但由于剂量的递增与死亡率递增的关系不是一条直线,而是呈S形曲线,在越接近100%死亡时,对剂量的递增越不敏感。而死亡率愈接近50%时,剂量与死亡率呈 直线关系,所以现基本上采用半数致死量(LD 50)作为毒价单位,而且LD 50 的计算应 用了统计学方法,减少了个体差异的影响,因此比较准确。以感染发病作为指标 的,可用半数感染量(ID 50)。用鸡胚测定时,可用鸡胚半数致死量(ELD 50 )或鸡胚 半数感染量(EID 50);用细胞培养测定时,可用组织细胞半数感染量(TCID 50 )。在 测定疫苗的免疫性能时,则用半数免疫量(IMD 50)或半数保护量(PD 50 )。 2.病毒毒价测定将病毒原液作10倍递进稀释即10-1、10-2、10-3……,选择4~6个稀释倍数接种一定体重的试验动物(或鸡胚、细胞),每组3~6只(个、孔)。接种后,观察一定时间内的死亡(或出现细胞病变)数和生存数。根据累计死亡数和生存数计算致死百分率。然后按Reed-Muench法、内插法或Karber法计算半数剂量。 以TCID 50 测定为例说明如下: 按Karber法计算,其公式为lgTCID 50 =L+d(S-0.5),L为病毒最低稀释度的对数;d为组距,即稀释系数,10倍递进稀释时d为-1;S为死亡比值之和(计算固定病毒稀释血清法中和试验效价时,S应为保护比值之和),即各组死亡(感染)数/试验数相加。
中和试验 中和试验是病毒或毒素与相应的抗体结合后,失去对易感动物的致病力的试验方法。 所属分类:免疫学 概述 动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。 中和试验(Neutralization Test)是以测定病毒的感染力为基础,以比较病毒受免疫血清中和后的残存感染力为依据,来判定免疫血清中和病毒的能力。 两种试验方法介绍 中和试验常用的有两种方法:一种是固定病毒量与等量系列倍比稀释的血清混合,另一种是固定血清用量与等量系列对数稀释(即十倍递次稀释)的病毒混合。 (一) 定血清-稀释病毒法(病毒中和试验) 1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途 径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量(EID50)。用细胞培养测定时,用组织细胞半数感染量(TCID50)。在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。 (1) LD50的测定(以流行性乙型脑炎病毒为例)。 测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10、10、10……10,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
病毒中和抗体检测 1.病毒TCID50检测 TCID50是指组织培养物(细胞)半数致死剂量。它有几个性质我们必须明白:1)它表示 的是计量,不是浓度;2)它是一个单位;3)它的值等于1,实际上问它的值等于多少是一个 没有意义的问题,就像问km的值等于多少一样,如果非要说岀的的值等于多少,那我们只能说 它的值在任何情况下都等于1。理解这三个性质对于理解TCID50非常重要,但是这三个性质经 常被误解,所以导致对TCID50的理解岀现偏差。 首先我们来看一下这个表示法的意思:病毒滴度为108.2TCID50/ml 。它表示的是每ml病 毒溶液里含有108.2个TCID50的病毒,这和氯化钠的浓度为 4.5mol/L表示每L溶液中含有4.5 个mol的氯化钠是一样的道理。经常可以听到人说我的病毒的TCID50是10xx。这个说法是不 科学的,应该说我这个溶液里含有10x.x个TCID50的病毒或者说我这个溶液的病毒滴度是 10xx TCID50/ml。也可以说病毒的TCID50效价是10-x.x。 TCID50=10A5.64/0.1ml。即:将病毒悬液作10A5.64稀释后,接种细胞0.1ml,可以使50% 的细胞产生CPE。(将病毒悬液作10A5.64稀释后,0.1ml中含1个TCID50,作其他一些实验时 (如中和试验),一般常用100TCID50/0.1ml 或者100TCID50/0.05ml ) 本方法的优缺点:①.优点:岀现阳性结果时间较短,且较明显;②.缺点:有时候,在用枪头吸岀细胞生长液时,容易岀现污染; 使用本方法时的注意事项:①.稀释病毒时,每做一个病毒稀释度都需要换枪头,减少浓度误差②.96孔板,每孔接种的细胞量:一般在此种测定病毒滴度的方法下,要将细胞密度适当调低,至少要比正常传代时低一些,否则细胞生长速度过快,未到7天则细胞岀现死亡対观察CPE不利.一般情况下,小塑料瓶(8-9ml液体为正常用量),培养长慢单层后,消化细胞,加入6ml培养液,吹匀,吸岀其中的2ml,到另外的瓶子,在该瓶中加入14-16ml即可,如果不放心,可以用显微镜看一下,细胞数过多则补加培养液,少则补加剩余4ml的细胞悬液; 维持液,即病毒培养液,配方为:①.MEM+2%小牛血清+3%谷氨酰胺+1%双抗+NaHC03; ②.MEM+3%谷氨酰胺+1%双抗+NaHCO3;两种维持液的不同在于是否有FBS(小牛血清).我个人曾经做过实验,在状态很好的细胞上接种病毒,分别使用两种不同的维持液,最终结果是一样的,没有什么不同,所以可以根据个人需要进行选择.另外,曾经请教过专门做中和实验的老师,他认为适当的FBS对细胞有保护作用,而且他说这是国外文献上的报道. 1 )细胞准备 1.1检查培养瓶中的单层细胞,以5ml胰酶-EDTA轻微冲洗 1.2加入4—5ml胰酶—EDTA以覆盖单层细胞 1.3放平培养瓶,37 C 5% CO2培养箱中孵育10 —20min,直到细胞脱落 1.4加入5—10ml培养液,洗下细胞后移到离心管中 1.5 以PBS洗细胞两次(12000rpm, 5min ) 1.6以D-MEM重悬细胞,并用血球计数板计数 1.7以D-MEM将将细胞浓度调整到1 X10A5/ml --1.5 10A5/ml 1.8在微量培养板的各孔中加入100卩细胞,相当于?X10A4细胞/孔 1.9在37 T 5 % CO2培养箱中过夜培养(18 —22h ),用处于生长相刚达到完全融合的细胞进行病毒的滴定