鱼丙酮酸脱氢酶(PDH)说明书
- 格式:doc
- 大小:145.50 KB
- 文档页数:5

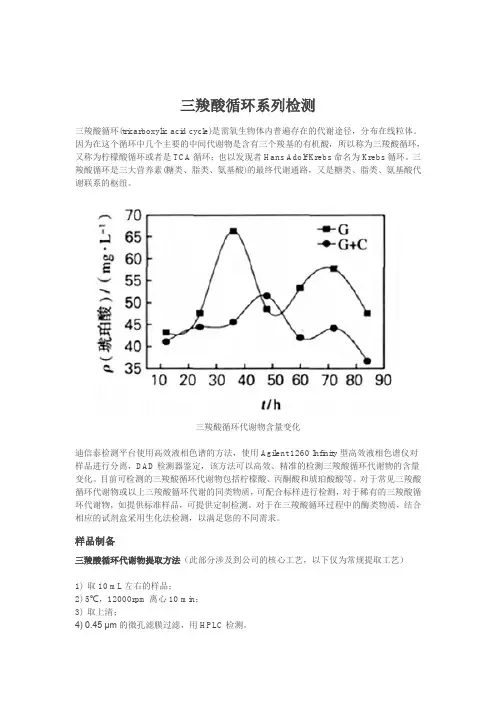
三羧酸循环系列检测三羧酸循环(tricarboxylic acid cycle)是需氧生物体内普遍存在的代谢途径,分布在线粒体。
因为在这个循环中几个主要的中间代谢物是含有三个羧基的有机酸,所以称为三羧酸循环,又称为柠檬酸循环或者是TCA循环;也以发现者Hans Adolf Krebs命名为Krebs循环。
三羧酸循环是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类、脂类、氨基酸代谢联系的枢纽。
三羧酸循环代谢物含量变化迪信泰检测平台使用高效液相色谱的方法,使用Agilent 1260 Infinity型高效液相色谱仪对样品进行分离,DAD检测器鉴定,该方法可以高效、精准的检测三羧酸循环代谢物的含量变化。
目前可检测的三羧酸循环代谢物包括柠檬酸、丙酮酸和琥珀酸酸等。
对于常见三羧酸循环代谢物或以上三羧酸循环代谢的同类物质,可配合标样进行检测,对于稀有的三羧酸循环代谢物,如提供标准样品,可提供定制检测。
对于在三羧酸循环过程中的酶类物质,结合相应的试剂盒采用生化法检测,以满足您的不同需求。
样品制备三羧酸循环代谢物提取方法(此部分涉及到公司的核心工艺,以下仅为常规提取工艺)1) 取10 mL左右的样品;2) 5℃,12000rpm离心10 min;3) 取上清;4) 0.45 μm的微孔滤膜过滤,用HPLC检测。
迪信泰检测平台可检测三羧酸循环类项目柠檬酸(CA)含量检测异柠檬酸含量检测苹果酸含量检测琥珀酸含量检测α-酮戊二酸含量检测草酰乙酸含量检测丙酮酸(PA)含量检测乳酸(LA)含量检测线粒体柠檬酸(MCA)含量检测乙酰辅酶A活性检测线粒体异柠檬酸脱氢酶(ICDHm) 活性检测α-酮戊二酸脱氢酶(α-KGDH)活性检测琥珀酸脱氢酶(SDH) 活性检测丙酮酸脱氢酶(PDH) 活性检测总酸含量检测2-磷酸甘油酸/3-磷酸甘油酸含量检测葡萄糖腺苷二磷酸含量检测DL-α-羟基戊二酸含量检测乙醇酸含量检测磷酸烯醇丙酮酸含量检测6-磷酸葡萄糖酸酯含量检测磷酸二羟丙酮含量检测3-磷酸甘油醛含量检测3-磷酸甘油含量检测葡萄糖含量检测4-磷酸-赤藓糖含量检测1, 6-二磷酸果糖含量检测1-磷酸果糖含量检测6-磷酸果糖含量检测1, 6-二磷酸葡萄糖含量检测1-磷酸葡萄糖含量检测6-磷酸葡萄糖含量检测1-磷酸甘露糖含量检测6-磷酸甘露糖含量检测5-磷酸核糖含量检测5-磷酸核酮糖含量检测7-磷酸景天庚糖含量检测二磷酸尿苷葡糖含量检测5-磷酸木糖含量检测丙二酰辅酶A含量检测琥珀酰辅酶A含量检测乙酰辅酶A含量检测线粒体异柠檬酸脱氢酶(ICDHm)含量检测α-酮戊二酸脱氢酶(α-KGDH)含量检测琥珀酸脱氢酶(SDH)含量检测丙酮酸脱氢酶(PDH)含量检测NAD+含量检测NADH含量检测NADP+含量检测NADPH含量检测ATP含量检测ADP含量检测AMP含量检测cAMP含量检测GTP含量检测GDP含量检测UDP含量检测HPLC测定三羧酸循环系列样本要求:1. 请确保样本量大于0.2g或者0.2mL,测定样品不返还,请您保留备份。

SIRT3分子量1. 简介SIRT3是一种重要的酶,属于Sirtuin家族的成员之一。
Sirtuins是一类在真核生物中高度保守的NAD^+-依赖性蛋白去乙酰化酶。
SIRT3主要存在于线粒体内,对于调控细胞能量代谢、抗氧化应激和细胞凋亡等生物学过程起到关键作用。
2. 结构SIRT3的分子量为44 kDa(千达尔顿)。
它由274个氨基酸残基组成,具有一个线粒体定位信号序列,这使得它能够定位到线粒体内。
SIRT3的分子结构包括一个N末端结构域、一个保守的sirtuin结构域和一个C末端结构域。
3. 功能3.1 能量代谢调节SIRT3通过去乙酰化调节多个与能量代谢相关的蛋白,从而对细胞能量代谢起到重要调控作用。
例如,SIRT3可以去乙酰化并激活丙酮酸脱氢酶2(ACLY),促进脂肪酸合成和氧化磷酸化。
此外,SIRT3还可以去乙酰化并激活丙酮酸脱氢酶1(PDH),从而促进糖原的分解和线粒体呼吸链的活性。
3.2 抗氧化应激SIRT3通过去乙酰化调节多个与抗氧化应激相关的蛋白,从而发挥抗氧化应激作用。
例如,SIRT3可以去乙酰化并激活超氧化物歧化酶2(SOD2),增强细胞对自由基损伤的抵抗能力。
此外,SIRT3还可以去乙酰化并激活谷胱甘肽过氧化物酶2(GPX2),增强细胞对过氧化物的清除能力。
3.3 细胞凋亡调控SIRT3通过调节多个与细胞凋亡相关的蛋白,发挥对细胞凋亡的调控作用。
例如,SIRT3可以去乙酰化并激活FOXO3a转录因子,促进细胞周期阻滞和凋亡。
此外,SIRT3还可以去乙酰化并激活BCL2相关蛋白X(Bax),增强线粒体通透性转换蛋白的活性,导致细胞凋亡。
4. 调控机制SIRT3的活性受到多个因素的调控。
首先,SIRT3的表达水平受到基因转录的调控。
研究发现,多个转录因子可以调节SIRT3基因的表达,包括PPARα、PGC-1α等。
其次,SIRT3的活性还受到底物和辅因子的影响。
SIRT3是一种NAD+-依赖性酶,在细胞中NAD+/NADH比值升高时,SIRT3的活性会增加。

乳酸脱氢酶781. 引言乳酸脱氢酶(Lactate Dehydrogenase,简称LDH)是一种重要的酶类,广泛存在于动物和植物细胞中。
它在细胞内发挥着关键的代谢功能,参与乳酸代谢和能量供应等生理过程。
本文将重点介绍乳酸脱氢酶78(LDH-78),包括其结构、功能、生理意义以及与疾病的关系。
2. 乳酸脱氢酶78的结构LDH-78属于LDH家族的一员,是由四个亚基组成的四聚体。
每个亚基都包含一个催化结构域和一个辅助结构域。
催化结构域中含有亲核位点和辅助结构域中含有NAD+或NADH等辅因子。
3. 乳酸脱氢酶78的功能LDH-78主要参与乳酸代谢过程。
它能够将产生的乳酸转化为丙酮酸,同时还可以将丙酮酸转化为乳酸。
这个过程被称为乳酸-丙酮酸循环,是维持细胞内能量平衡的重要途径之一。
此外,LDH-78的功能还与氧化还原反应有关。
它能够在细胞内进行NAD+和NADH之间的氧化还原转化,参与糖代谢和脂肪代谢等重要生理过程。
4. 乳酸脱氢酶78的生理意义LDH-78在人体中广泛存在于多种组织和器官中,如肝脏、心肌、肌肉等。
其正常功能对于维持机体的能量平衡、代谢平衡以及身体健康具有重要作用。
LDH-78在肌肉中的活性水平可以反映运动状态和耐力水平。
当人体进行高强度运动时,乳酸产生增加,LDH-78能够快速将乳酸转化为丙酮酸,减少乳酸积累,延缓疲劳。
此外,在某些疾病状态下,LDH-78的活性水平也会发生改变。
例如,在心肌梗死、肝炎等疾病中,LDH-78的活性明显升高,可以作为相关疾病的一个生物标志物。
5. 乳酸脱氢酶78与疾病的关系LDH-78与一些疾病的发生和发展密切相关。
在某些肿瘤中,LDH-78的活性水平明显升高。
这是因为肿瘤细胞具有高度代谢活性,产生大量乳酸,并且表达了更多的LDH-78来支持其能量需求。
另外,一些遗传性疾病也与LDH-78突变有关。
例如,乳酸血症(Lactic Acidosis)是一种由于乳酸代谢障碍引起的临床综合征,其中一部分患者具有LDH-78基因突变。

代谢性酸中毒,代谢性酸中毒的症状,代谢性酸中毒治疗【专业知识】疾病简介代谢性酸中毒是最常见的一种酸碱平衡紊乱,是细胞外液H+增加或HCO3-丢失而引起的以原发性HCO3-降低(小于21mmol/L)和PH值降低(小于7.35)为特征。
在代谢性酸中毒的临床判断中,阴离子间隙(AG)有重要的临床价值。
按不同的AG值可分为高AG正常氯型及正常AG高氯型代谢性酸中毒。
疾病病因一、发病原因1.高AG正常氯性代谢性酸中毒(1)乳酸性酸中毒:乳酸性酸中毒是代谢性酸中毒的常见原因。
正常乳酸是由丙酮酸在乳酸脱氢酶(LDH)的作用下,经NADH加氢转化而成,NADH则转变为NAD 。
乳酸也能在LDH作用下当NAD 转化为NADH时转变为丙酮酸。
因此决定上述反应方向的主要为丙酮酸和乳酸两者作为反应底物的浓度以及NADH和NAD 的比例情况。
正常葡萄糖酵解时可以产生NADH,但是生成的NADH可以到线粒体而生成NAD ,另外丙酮酸在丙酮酸脱氢酶(PDH)作用下转化成乙酰辅酶A,后者再通过三羧酸循环转化为CO2及H2O。
在正常氧化条件下,乳酸盐可以进入肝脏或肾脏细胞内的线粒体,经过α代谢途径而生成酮酸,后者再分解为H2O和CO2并生成HCO3-。
当线粒体因为组织缺O2等而功能不全时,丙酮酸容易积聚在胞浆中代谢成为乳酸盐。
正常人血乳酸水平甚低,为1~2mmol/L,当超过4mmol/L时称为乳酸性酸中毒。
乳酸性酸中毒临床上分为A、B两型。
A型为组织灌注不足或急性缺氧所致,如癫痫发作、抽搐、剧烈运动、严重哮喘等可以造成高代谢状态,组织代谢明显过高;或者在休克、心脏骤停、急性肺水肿、CO中毒、贫血、严重低氧血症等时组织供氧不足,这些情况都可使NADH不能转化为NAD ,从而大量丙酮酸转化为乳酸,产生乳酸性酸中毒。
B型为一些常见病、药物或毒物及某些遗传性疾病所致。
如肝脏疾病,以肝硬化为最常见。
由于肝实质细胞减少,乳酸转变为丙酮酸减少,导致乳酸性酸中毒。

【疾病名】代谢性酸中毒【英文名】metabolic acidosis【缩写】【别名】【ICD号】E87.2【概述】代谢性酸中毒是细胞外液H增加或HCO丢失而引起的以血浆HCO浓度原发性减少为特征的酸碱平衡紊乱类型。
在代谢性酸中毒的临床判断中,阴离子间隙(AG)有重要的临床价值。
在血浆蛋白正常时AG上升,一般为非氯(Cl)的酸性物质增加所致,HCO被消耗,由伴随的阴离子所替代以平衡阳离子,此时Cl 无变化,表现为高AG代谢性酸中毒。
如伴随的阴离子通过代谢重新生成HCO (如乳酸等),AG及酸碱平衡可恢复正常。
若阴离子在滤过后不能重吸收(如SO),则细胞外液容易收缩,Cl重吸收增加,出现高氯性酸中毒,此时Cl正常。
内源性酸产生过多,HCO丢失过多或肾排泌障碍而致内源性酸积累过多均可导致代谢性酸中毒。
按不同的AG值可分为高AG正常氯型及正常AG高氯型代谢性酸中毒。
【流行病学】代谢性酸中毒主要见于酸性物质产生过多,排出过少,(AG增高型代谢性酸中毒)或HCO丢失过多(高氯性酸中毒)的患者。
【病因】1.高AG正常氯性代谢性酸中毒(1)乳酸性酸中毒:乳酸性酸中毒是代谢性酸中毒的常见原因。
正常乳酸是由丙酮酸在乳酸脱氢酶(LDH)的作用下,经NADH加氢转化而成,NADH则转变为NAD。
乳酸也能在LDH作用下当NAD转化为NADH时转变为丙酮酸。
因此决定上述反应方向的主要为丙酮酸和乳酸两者作为反应底物的浓度以及NADH和NAD的比例情况。
正常葡萄糖酵解时可以产生NADH,但是生成的NADH可以到线粒体而生成NAD,另外丙酮酸在丙酮酸脱氢酶(PDH)作用下转化成乙酰辅酶A,后者再通过三羧酸循环转化为CO及H O(图1)。
在正常氧化条件下,乳酸盐可以进入肝脏或肾脏细胞内的线粒体,经过α代谢途径而生成酮酸,后者再分解为H O和CO并生成HCO。
当线粒体因为组织缺O等而功能不全时,丙酮酸容易积聚在胞浆中代谢成为乳酸盐。

fluorescence molecular imaging methods to future multi-modality imaging technology.Theranostics.2014. 4(11):1072-1084.27.Lu Y, Yang K, Zhou K, et al. An integrated quad-modality molecular imaging system forsmall animals. J Nucl Med. 2014.55: 1375-1379.四、细胞代谢酶抑制剂研究赵健元1赵世民1,21. 复旦大学生命科学学院2. 四川大学华西医院(一)前言及背景随着代谢研究近年来的复兴,代谢失调与疾病的关系的认识近年来获得大幅深入。
代谢相关疾病的范围已经又最初的单个代谢酶突变导致的代谢物异常,到后来的胰岛素抵抗及肥胖,发展到如今的包括肿瘤、心血管疾病,以及退行性疾病在内的多种重大人类疾病。
和代谢研究类似,代谢酶调控小分子,尤其是代谢酶抑制剂的研究在经过一段时间沉寂后,重新得到充分的重视。
围绕糖尿病、肿瘤控制等目标,一些新发现的代谢酶抑制剂已经显示出在疾病防控及治疗中的价值。
我们总结相关领域到目前为止的已有进展,同时预测未来代谢慢抑制剂的发展方向。
(二)发展历程及最新进展代谢网络将摄入的外源营养物质转化为自生物质(物质代谢)并生产足够的能量(能量代谢)供身体各种活动的需要。
人体摄入的外源营养物质主要包括糖类(碳水化合物),蛋白质(氨基酸)和脂肪。
这些营养物质通过不同的代谢通路进行代谢,抑制不同的代谢酶产生不同的生理效果并且具有不同的疾病干预效果。
早期的代谢酶抑制剂以抑制某个代谢酶相关的代谢物的产生为目的,以此作为可以进行临床干预的小分子化学药物。
很多该类药物目前在临床仍然有广泛应用。
近年来的代谢酶抑制剂聚焦于复杂代谢疾病。
很多新研发的代谢酶抑制剂专注于葡萄糖的摄取,有氧糖酵解的抑制,肿瘤代谢物产生的抑制等与糖尿病和肿瘤密切相关的领域并取得新的进展。




代谢性酸中毒疾病代谢性酸中毒是最常见的一种酸碱平衡紊乱,是细胞外液H+增加或HCO3-丢失而引起的以原发性HCO3-降低(21mmol/L)和PH值降低(7.35)为特征。
在代谢性酸中毒的临床推断中,阴离子间隙(AG)有重要的临床价值。
按不同的AG值可分为高AG正常氯型及正常AG高氯型代谢性酸中毒。
病因代谢性酸中毒是由什么缘由引起的?(一)发病缘由1.高AG正常氯性代谢性酸中毒(1)乳酸性酸中毒:乳酸性酸中毒是代谢性酸中毒的常见缘由。
正常乳酸是由丙酮酸在乳酸脱氢酶(LDH)的作用下,经NADH加氢转化而成,NADH则转变为NAD 。
乳酸也能在LDH作用下当NAD 转化为NADH时转变为丙酮酸。
因此打算上述反应方向的主要为丙酮酸和乳酸两者作为反应底物的浓度以及NADH和NAD 的比例状况。
正常葡萄糖酵解时可以产生NADH,但是生成的NADH可以到线粒体而生成NAD ,另外丙酮酸在丙酮酸脱氢酶(PDH)作用下转化成乙酰辅酶A,后者再通过三羧酸循环转化为CO2及H2O。
在正常氧化条件下,乳酸盐可以进入肝脏或肾脏细胞内的线粒体,经过α代谢途径而生成酮酸,后者再分解为H2O和CO2并生成HCO3-。
当线粒体由于组织缺O2等而功能不全时,丙酮酸简单积聚在胞浆中代谢成为乳酸盐。
正常人血乳酸水平甚低,为1~2mmol/L,当超过4mmol/L时称为乳酸性酸中毒。
乳酸性酸中毒临床上分为A、B两型。
A型为组织灌注不足或急性缺氧所致,如癫痫发作、抽搐、猛烈运动、严峻哮喘等可以造成高代谢状态,组织代谢明显过高;或者在休克、心脏骤停、急性肺水肿、CO中毒、贫血、严峻低氧血症等时组织供氧不足,这些状况都可使NADH不能转化为NAD ,从而大量丙酮酸转化为乳酸,产生乳酸性酸中毒。
B型为一些常见病、药物或毒物及某些遗传性疾病所致。
如肝脏疾病,以肝硬化为最常见。
由于肝实质细胞削减,乳酸转变为丙酮酸削减,导致乳酸性酸中毒。
这型乳酸性酸中毒进展常较慢,但假如在合并有组织灌注不足等状况时,酸中毒可非常严峻;如存在慢性酒精中毒则更易消失,可能是饮酒使肝糖原再生削减,乳酸利用障碍所致。
第1篇一、引言大肠杆菌(Escherichia coli)是一种广泛存在于自然界和人体肠道中的革兰氏阴性细菌。
由于其代谢途径的多样性,大肠杆菌在生物工程、生物制药和生物能源等领域具有广泛的应用价值。
乙酸盐是微生物代谢过程中的一种重要中间产物,在大肠杆菌的代谢网络中占据重要地位。
本文将重点介绍大肠杆菌乙酸盐代谢的机制、调控以及生物技术应用。
二、大肠杆菌乙酸盐代谢途径1. 乙酸盐的来源乙酸盐主要来源于以下几个方面:(1)碳源:有机碳源,如葡萄糖、乳糖等,在微生物的代谢过程中可以产生乙酸盐。
(2)氨基酸:某些氨基酸在微生物的代谢过程中可以产生乙酸盐,如赖氨酸、组氨酸等。
(3)脂肪酸:某些脂肪酸在微生物的代谢过程中可以产生乙酸盐,如硬脂酸、油酸等。
2. 乙酸盐代谢途径(1)乙酸盐的生成在微生物的代谢过程中,乙酸盐主要通过以下途径生成:①糖酵解途径:葡萄糖在糖酵解过程中生成丙酮酸,丙酮酸经丙酮酸脱氢酶复合物催化,转化为乙酰辅酶A(Acetyl-CoA),进而生成乙酸盐。
②脂肪酸β-氧化途径:脂肪酸在β-氧化过程中生成乙酰辅酶A,乙酰辅酶A经乙酰辅酶A合成酶催化,转化为乙酸盐。
(2)乙酸盐的利用乙酸盐在大肠杆菌中的主要利用途径如下:①乙酸盐的异化作用:乙酸盐在乙酸盐脱氢酶的催化下,转化为乙醛,再转化为乙酸,最终通过柠檬酸循环进入三羧酸循环。
②乙酸盐的合成作用:乙酸盐在乙酸盐合酶的催化下,转化为草酰乙酸,进而参与糖异生途径。
③乙酸盐的储存:乙酸盐在大肠杆菌中可以转化为乙酸盐盐,储存于细胞内。
三、大肠杆菌乙酸盐代谢的调控1. 酶水平的调控(1)乙酸盐脱氢酶:乙酸盐脱氢酶是乙酸盐代谢途径中的关键酶,其活性受到多种因素的调控,如NADH/NAD+比例、ATP/ADP比例等。
(2)乙酰辅酶A合成酶:乙酰辅酶A合成酶是乙酸盐生成途径中的关键酶,其活性受到ATP、NADH/NAD+等因素的调控。
2. 转录水平的调控(1)基因表达调控:大肠杆菌乙酸盐代谢相关基因的表达受到多种转录因子的调控,如CycA、CycB、CycC等。
糖酵解通路和代谢酶糖酵解通路是一种广泛存在于生物界的重要代谢途径,可以将葡萄糖等碳水化合物分解为能量和有机物。
这个通路包括一系列的化学反应,其中的关键步骤由多种酶催化。
正是这些酶的作用,才使得糖酵解过程能够顺利进行。
在糖酵解通路中,糖分子首先被磷酸化,形成果糖-1,6-二磷酸。
这一步骤由磷酸果糖激酶(PFK)催化。
随后,果糖-1,6-二磷酸被分解为两个三碳分子--酮糖和磷酸二酮糖。
这个反应由果糖-1,6-二磷酸酶(FBPase)催化。
接着,酮糖和磷酸二酮糖经过一系列反应被继续分解和转化,最终产生苹果酸和丙酮酸。
除了PFK和FBPase,糖酵解通路中还有一些其他重要的代谢酶。
葡萄糖激酶(GK)是将葡萄糖磷酸化成果糖-6-磷酸的关键酶。
乳酸脱氢酶(LDH)是将酮糖转化为乳酸的酶。
在有氧条件下,细胞内的氧气充足时,丙酮酸会进一步被氧化为二氧化碳和水,释放更多能量,这需要丙酮酸脱氢酶(PDH)和三羧酸循环中的酶参与。
糖酵解通路和代谢酶的协同作用,使得生物体能够高效地将葡萄糖等碳水化合物转化为能量。
糖酵解通路的中间产物也可以用来合成其他生物分子,例如脂肪酸和氨基酸等。
此外,糖酵解通路还参与调节细胞内能量平衡和产生调节细胞生长发育的信号分子。
需要注意的是,糖酵解通路和代谢酶的活性受到多种因素的调控。
例如,糖酵解通路的速率受到底物浓度和酶的活性调节的影响。
另外,调节糖酵解通路的信号通路和能量状态等因素也能对代谢酶的表达和活性产生影响。
总之,糖酵解通路和代谢酶在生物体的能量和物质代谢中起着重要的作用。
通过理解这些通路和酶的机制和调控,我们可以更好地理解生物体的能量平衡和代谢调节,并为疾病治疗和生物工程等领域的应用提供理论依据。
鱼丙酮酸脱氢酶(PDH)酶联免疫分析
试剂盒使用说明书
本试剂盒仅供研究使用。
检测范围:
96T
0.3U/L -15 U/L
使用目的:
本试剂盒用于测定鱼血清、血浆及相关液体样本中丙酮酸脱氢酶(PDH)含量。
实验原理
本试剂盒应用双抗体夹心法测定标本中鱼丙酮酸脱氢酶(PDH)水平。用纯化的鱼丙酮
酸脱氢酶(PDH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入丙酮酸脱
氢酶(PDH),再与 HRP 标记的丙酮酸脱氢酶(PDH)抗体结合,形成抗体-抗原-酶标抗体
复合物,经过彻底洗涤后加底物 TMB 显色。TMB 在 HRP 酶的催化下转化成蓝色,并在酸
的作用下转化成最终的黄色。颜色的深浅和样品中的丙酮酸脱氢酶(PDH)呈正相关。用酶
标仪在 450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中鱼丙酮酸脱氢酶(PDH)
浓度。
试剂盒组成
1 30 倍浓缩洗涤液 20ml×1 瓶 7
终止液
6ml×1 瓶
2 酶标试剂 6ml×1 瓶 8
标准品(24U/L) 0.5ml×1 瓶
3 酶标包被板 12 孔×8 条 9 标准品稀释液
1.5ml×1 瓶
4 样品稀释液 6ml×1 瓶 10 说明书
1 份
5 显色剂 A 液 6ml×1 瓶 11 封板膜
2 张
6 显色剂 B 液 6ml×1/瓶 12 密封袋
1 个
标本要求
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。若不能
马上进行试验,可将标本放于-20℃保存,但应避免反复冻融
2.不能检测含 NaN3 的样品,因 NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤
1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀
释。
12 U/L
5 号标准品 150µl 的原倍标准品加入 150µl 标准品稀释液
6 U/L
4 号标准品 150µl 的 5 号标准品加入 150µl 标准品稀释液
3 U/L
3 号标准品 150µl 的 4 号标准品加入 150µl 标准品稀释液
1.5U/L 2 号标准品 150µl 的 3 号标准品加入 150µl 标准品稀释液
0.75U/L
1 号标准品 150µl 的 2 号标准品加入 150µl 标准品稀释液
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
待测样品孔。在酶标包被板上标准品准确加样 50µl,待测样品孔中先加样品稀释液 40µl,
然后再加待测样品 10µl(样品最终稀释度为 5 倍)。加样将样品加于酶标板孔底部,尽
量不触及孔壁,轻轻晃动混匀。
3. 温育:用封板膜封板后置 37℃温育 30 分钟。
4. 配液:将 30 倍浓缩洗涤液用蒸馏水 30 倍稀释后备用
5. 洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 秒后弃去,如
此重复 5 次,拍干。
6. 加酶:每孔加入酶标试剂 50µl,空白孔除外。
7. 温育:操作同 3。
8. 洗涤:操作同 5。
9. 显色:每孔先加入显色剂 A50µl,再加入显色剂 B50µl,轻轻震荡混匀,37℃避光显色
10 分钟.
10. 终止:每孔加终止液 50µl,终止反应(此时蓝色立转黄色)。
11. 测定:以空白空调零,450nm 波长依序测量各孔的吸光度(OD 值)。 测定应在加
终止液后 15 分钟以内进行。
操作程序总结:
计算
以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的
OD 值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与 OD 值计算出标
准曲线的直线回归方程式,将样品的 OD 值代入方程式,计算出样品浓度,再乘以稀释倍数,
即为样品的实际浓度。
注意事项
1.试剂盒从冷藏环境中取出应在室温平衡 15-30 分钟后方可使用,酶标包被板开封后如未
用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
控制在 5 分钟内,如标本数量多,推荐使用排枪加样。
4. 请每次测定的同时做标准曲线,最好做复孔。如标本中待测物质含量过高(样本 OD 值
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计
算时请最后乘以总稀释倍数(×n×5)。
5. 封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
保存条件及有效期
1.试剂盒保存:;2-8℃。
2.有效期:6 个月