阿尔茨海默病的发病机制 2008-06-04
- 格式:ppt
- 大小:12.28 MB
- 文档页数:65

阿尔茨海默病的病理机制及治疗方法概述阿尔茨海默病(Alzheimer's disease,AD)是一种进行性神经退行性疾病,其主要特征是认知功能丧失和记忆障碍。
该疾病在老年人群中非常常见,对患者及其家庭带来重大负担。
虽然目前尚无根治的治疗方法,但了解该疾病的病理机制可以为患者提供更好的支持和护理,并推动新药物和干预策略的发展。
一、病理机制1. 淀粉样β-蛋白斑块形成淀粉样β-蛋白(amyloid-beta protein,Aβ)聚集形成斑块是AD最明显的特征之一。
正常情况下,髓质细胞通过清除代谢产物来控制Aβ水平。
然而,在AD患者中,这种清除过程受到干扰,导致Aβ在大脑中积累并形成斑块。
2. 神经原纤维缠结与Tau蛋白异常另一个关键特征是神经原纤维缠结和Tau蛋白异常。
Tau蛋白在正常情况下维持神经元细胞骨架结构的稳定性。
然而,在AD患者中,磷酸化异常导致Tau蛋白聚集成缠结,并最终损害神经元功能。
3. 氧化应激和炎症反应AD患者大脑中存在氧化应激和炎症反应的迹象。
这些异常生理过程可能进一步加剧Aβ聚集和Tau蛋白异常。
二、治疗方法1. 药物治疗目前已有几种针对阿尔茨海默病的药物可供选择。
乙酰胆碱酯酶抑制剂(acetylcholinesterase inhibitors, AChEI)是常用的一类药物,用于改善认知功能和延缓AD进展。
另外,Glutamate NMDA受体拮抗剂也可用于改善记忆障碍。
2. 干预策略除了药物治疗外,干预策略也被广泛研究作为阿尔茨海默病的治疗方法。
其中包括认知训练,如记忆锻炼和注意力训练,可以帮助患者保持较好的认知功能。
此外,规律的体育锻炼和心理社交互动也被证明有助于延缓AD进展。
3. 免疫治疗近年来,免疫治疗作为AD治疗的新策略取得了一些重要突破。
例如,抗Aβ抗体通过清除大脑中的Aβ积累物而显示出一定的效果。
此外,针对Tau蛋白异常聚集的免疫治疗也在实验室阶段取得了初步成功。

阿尔茨海默病的发生机理研究阿尔茨海默病,又称老年痴呆症,是老年人常见的一种神经系统退行性疾病。
其病理表现主要为脑萎缩、核团灰质变性和神经纤维缠结等,导致认知功能减退、行为障碍、语言障碍、自理能力下降等表现。
阿尔茨海默病的发生机理至今尚未完全明确,但学者们已经在多个方面展开了深入研究。
1、遗传因素的影响阿尔茨海默病的遗传病例约占所有病例的5-10%。
目前已经确定的与该病发生有关的主要基因包括APP、PSEN1、PSEN2等。
研究表明,这些基因的突变会导致beta-淀粉样蛋白的过度积累,从而形成淀粉样斑块,是阿尔茨海默病的主要病理特征之一。
2、神经炎症反应神经炎症反应是机体对抗感染等外界侵袭的免疫防御过程,在阿尔茨海默病的病理形成中也有着一定的作用。
炎症细胞和细胞因子的释放会引起神经元的死亡和神经元突触失调,进而导致脑内淀粉样斑块和神经纤维缠结的产生和积累。
另外,炎症反应还与周围淋巴细胞的活化和肿瘤坏死因子等因素的分泌相关。
3、氧化损伤氧化损伤是生物体在氧化应激状态下所产生的一些反应,其中的自由基、过氧化物和氧化酶等物质会导致脂质过氧化、DNA断裂、蛋白降解等细胞损伤现象。
在阿尔茨海默病发生的过程中,氧化损伤与淀粉样斑块和神经纤维缠结的形成有着一定的关联。
4、脑淀粉样物质沉积脑淀粉样物质沉积是阿尔茨海默病主要病理学特征之一,其主要成份是beta-淀粉样蛋白。
实验证明,淀粉样物质的沉积是由该蛋白被水解后形成的beta一-42和beta-一40等多肽分子的沉积所致。
它会导致神经元色素沉着、炎症反应和神经元死亡等现象,导致严重的失智后果。
5、抑郁症和心理压力研究者认为,长期的抑郁症和心理压力可以导致阿尔茨海默病的发生。
抑郁症患者会产生大量的催化荷尔蒙,对人体器官功能有一定的影响。
此外,心理压力还会导致神经系统节律和穿透力发生改变,进而导致神经元死亡,最终引发阿尔茨海默病等神经系统疾病。
以上就是目前人们认为与阿尔茨海默病发生直接相关的一些因素。

解析阿尔茨海默病的发病机制和治疗前景阿尔茨海默病(Alzheimer's disease, AD)是一种常见的神经退行性疾病,主要特征是进行性的认知功能损害,包括记忆力下降、思维能力减退和行为异常等。
据统计,全球约有5000万人患有阿尔茨海默病。
随着人口老龄化的加剧,阿尔茨海默病的病例数量预计将会大幅度增加。
阿尔茨海默病的发病机制至今尚未完全明确,但目前的研究认为主要包括两个方面的因素:神经元损伤和脑部异常蛋白质沉积。
首先,神经元损伤是阿尔茨海默病的早期事件之一、神经元损伤可能源于慢性炎症或氧化应激等因素,这些因素会促使微胶质细胞(microglia)激活并释放炎症因子,导致神经元的脆弱性增加。
此外,一些遗传因素也与神经元损伤有关,如APOE基因的ε4等突变与阿尔茨海默病的发病风险相关。
其次,阿尔茨海默病的特征性病理变化是β-淀粉样蛋白(Aβ)沉积和Tau蛋白异常聚集。
Aβ沉积主要发生在大脑皮质和海马体中,形成淀粉样斑块。
Tau蛋白异常聚集则形成神经原纤维缠结,存于神经细胞内。
这些异常蛋白质沉积会破坏神经元通信以及过程重塑的能力,最终导致神经元的死亡和脑组织的萎缩。
阿尔茨海默病的治疗前景目前仍然相对较为有限,大多数现有疗法只能缓解病情或控制症状,而不能从根本上逆转疾病进程。
药物治疗方面,阿尔茨海默病最常用的药物是乙酰胆碱酯酶抑制剂(acetylcholinesterase inhibitors, AChEIs)和N-甲基-D-天冬氨酸(NMDA)受体拮抗剂。
AChEIs可以提高乙酰胆碱水平,从而增强记忆和认知功能。
而NMDA受体拮抗剂则用于调节神经递质谷氨酸的释放。
然而,这些药物的疗效只是症状性的,不能治愈疾病。
另外,光学和音频的刺激也被认为对阿尔茨海默病患者的认知功能恢复有一定的帮助。
随着对阿尔茨海默病分子机制的进一步了解,一些新的治疗方法也在研究中。
例如,近年来基于确切与阿尔茨海默病相关的异常蛋白质(Aβ和Tau)的新药研发取得了一些进展。

阿尔兹海默病因及发病机制分析阿尔兹海默病(Alzheimer's disease)是一种进行性、不可逆的神经退行性疾病,主要影响老年人的大脑功能。
其主要特征是记忆力逐渐减退,并伴随认知功能的进行性丧失。
至今为止,阿尔兹海默病的确切病因还不完全清楚,但研究表明,遗传因素、异常蛋白沉积以及神经递质异常等因素都可能涉及到疾病的发生和发展。
遗传因素是阿尔兹海默病的重要风险因素之一。
近年来,研究工作揭示了阿尔兹海默病与一些基因的关联。
APOE基因是最重要的遗传风险因素之一。
APOEε4等位基因是阿尔兹海默病患者中最常见的高危基因型,携带该等位基因的个体患上阿尔兹海默病的风险相对较高。
还有其他与阿尔兹海默病相关的基因,如PSEN1、PSEN2和APP等。
这些基因突变会导致异常蛋白的产生,进而影响神经细胞的正常功能。
异常蛋白沉积也是阿尔兹海默病的重要特征之一。
大多数阿尔兹海默病患者的大脑组织中都存在β-淀粉样蛋白(Aβ)斑块以及Tau蛋白纤维缠结。
Aβ沉积主要是由于Aβ蛋白正常代谢异常,导致其积聚形成具有毒性的斑块。
Tau蛋白的异常磷酸化和聚集也与阿尔兹海默病的发展密切相关。
这些异常蛋白沉积可导致神经元的退行性变和细胞死亡,进而引起阿尔兹海默病的病理改变。
神经递质异常也可能参与阿尔兹海默病的发病机制。
研究表明,阿尔兹海默病患者的大脑中乙酰胆碱含量显著降低。
乙酰胆碱是一种重要的神经递质,与记忆和学习有着密切关联。
通过乙酰胆碱能神经元的死亡,阿尔兹海默病患者大脑中乙酰胆碱水平的降低可能导致认知功能的损害。
炎症反应及氧化应激等机制也与阿尔兹海默病的发生和发展有关。
炎症反应在阿尔兹海默病的病理过程中起到重要作用,炎症反应物质的释放会促进异常蛋白沉积和神经元损伤。
氧化应激也是阿尔兹海默病神经损伤的关键机制之一,氧化应激可导致细胞膜脂质过氧化和DNA损伤。
尽管阿尔兹海默病的确切病因和发病机制尚未完全明确,但遗传因素、异常蛋白沉积、神经递质异常、炎症反应及氧化应激等因素都在阿尔兹海默病的发病过程中发挥着重要作用。

阿尔兹海默症发病机制阿尔兹海默症(Alzheimer's disease,AD)是一种神经退行性疾病,也是老年性痴呆最常见的形式之一。
该疾病以记忆障碍、认知下降和行为异常为特征,常常导致患者的独立生活能力和社交功能的丧失。
目前,全球大约有5000万人患有阿尔兹海默症,预计到2050年,这个数字将会翻倍。
尽管该病病因尚不完全清楚,但是许多研究已经揭示了阿尔兹海默症的发病机制。
阿尔兹海默症主要发生在脑部,特别是影响到海马体和额叶皮质等区域。
大多数阿尔兹海默症患者的脑部会出现β-淀粉样蛋白斑块和tau 蛋白神经纤维缠结,这些异常蛋白聚集会导致神经元的损失和炎症反应。
β-淀粉样蛋白(amyloid-β,Aβ)在正常情况下由β- 铜蛋白酶(β-secretase)和γ- 铜蛋白酶(γ-secretase)两种酶切割而成。
然而,阿尔兹海默症患者在Aβ切割过程中存在异常。
这些异常导致Aβ42 蛋白的积累,增加其在脑部沉淀的几率。
Aβ42 在黄斑区聚集形成斑块,进一步引发炎症和神经元损伤。
Tau 蛋白是另一个与阿尔兹海默症密切相关的蛋白。
在正常情况下,tau 蛋白通过磷酸化和去磷酸化等修饰方式,维持其稳定性和功能。
然而,在阿尔兹海默症患者的脑部中,tau 蛋白发生异常的磷酸化和聚集,导致神经纤维缠结。
这些纤维缠结会对神经元的结构和功能产生不利影响,最终导致神经元的死亡和退化。
阿尔兹海默症的发病机制还涉及到炎症反应。
在疾病的早期阶段,淋巴细胞和巨噬细胞等免疫细胞会在脑部产生过度的炎症反应。
这些炎症反应会进一步激活和吸引更多的免疫细胞进入脑部,形成炎症巨细胞和活化的星形胶质细胞。
这些细胞释放出一系列炎症介质,导致神经元的神经传导受损,并加速病理变化的发展。
除了以上几个主要因素外,一些遗传因素也与阿尔兹海默症的发病有关。
例如,突变的APP基因、PSEN1基因和PSEN2基因都被发现与早发型阿尔兹海默症有关。
这些基因突变会导致Aβ42蛋白的合成和清除失衡,从而促进斑块形成和炎症反应。


阿尔兹海默病因及发病机制分析阿尔兹海默病(Alzheimer's Disease,简称AD)是一种常见的老年痴呆症,是一种进行性神经系统退化性疾病,主要表现为认知功能障碍和记忆力衰退。
对于这种疾病,科学家们一直在不断探索其病因和发病机制,以便开发更有效的治疗和预防策略。
一、病因分析1. 遗传因素阿尔兹海默病患者中有大约5%到10%是由遗传因素引起的,这些患者通常在50岁左右即发病。
在研究家族遗传的AD患者时,科学家们发现患有该疾病的家族成员往往携带着与阿尔兹海默病相关的遗传因子。
与阿尔兹海默病相关的基因APOE4,是阿尔兹海默病的主要遗传风险因素之一。
PS1和PS2基因是遗传性早发性AD的另一个重要基因,它与阿尔兹海默病的发病有很强的关联。
2. 外部因素除了遗传因素外,一些外部因素也被认为和阿尔兹海默病的发病有关。
这些外部因素包括糖尿病、高血压、高胆固醇、抽烟、酗酒等生活方式因素。
这些因素可能通过影响血管健康、慢性炎症、细胞信号传导等途径,对大脑功能产生负面影响,从而增加患上阿尔兹海默病的风险。
二、发病机制分析1. 神经元退化阿尔兹海默病是由于大脑中神经元的死亡和突触连接的丧失所致。
这些病理学特征导致大脑皮质和海马体等关键脑区发生严重萎缩和变性,从而导致认知功能的下降。
研究表明,这种神经元退化可能与淀粉样斑块和神经原纤维缠结有关。
2. 淀粉样斑块和神经原纤维缠结淀粉样斑块主要由β-淀粉样蛋白(Aβ)聚集形成,而神经原纤维缠结则由磷酸化tau 蛋白的异常聚积所致。
Aβ和tau蛋白的异常聚集破坏了神经元的正常功能,导致神经元死亡和突触连接的丢失。
这些蛋白聚集还会引发炎症反应和氧化应激,从而加速疾病进展。
3. 炎症和氧化应激炎症反应和氧化应激在阿尔兹海默病的发病机制中也扮演着重要角色。
已有研究表明,慢性炎症反应和氧化应激可以刺激Aβ的产生和tau蛋白的异常磷酸化,进而促进神经元退化。
炎症和氧化应激还可以损伤血管系统,导致脑部血液循环不畅,加速神经元退化。


阿尔兹海默病因及发病机制分析【摘要】阿尔兹海默病是一种常见的老年痴呆症,其发病机制复杂且尚未完全明确。
遗传因素是导致该疾病的主要风险因素之一,蛋白异常聚集和神经元损伤也在发病过程中扮演重要角色。
炎症反应、氧化应激和钙离子稳态失衡也被认为与阿尔兹海默病的发病机制密切相关。
在阿尔兹海默病病因研究中面临诸多挑战,但治疗策略的展望仍然令人期待。
未来的研究方向包括深入探讨疾病的分子机制,寻找更有效的治疗靶点,以及开发早期诊断方法,为阿尔兹海默病的预防和治疗提供更多可能性。
【关键词】阿尔兹海默病, 病因, 发病机制, 遗传因素, 蛋白异常聚集, 神经元损伤, 炎症反应, 氧化应激, 钙离子稳态失衡, 研究挑战, 治疗策略, 研究展望, 未来方向1. 引言1.1 阿尔兹海默病因及发病机制分析阿尔茨海默病是一种常见的老年痴呆症,其病因和发病机制一直是医学界关注的焦点。
阿尔茨海默病的发病机制十分复杂,涉及多种因素的相互作用,包括遗传因素、蛋白异常聚集、炎症反应、氧化应激和钙离子稳态失衡等。
遗传因素在阿尔兹海默病的发病机制中发挥重要作用。
研究表明,一些基因突变与阿尔茨海默病的发病风险密切相关,如APP、PSEN1和PSEN2等基因的突变被认为是遗传性阿尔茨海默病的主要原因之一。
蛋白异常聚集和神经元损伤也是阿尔茨海默病发病机制中的重要环节。
β淀粉样蛋白的异常聚集会形成斑块,影响神经元的正常功能,导致神经元损伤和死亡。
炎症反应在阿尔兹海默病的病理过程中发挥重要作用。
炎症介质的释放会导致神经元毒性,并加速病变的发展。
氧化应激和钙离子稳态失衡也参与了阿尔兹海默病的发病机制。
氧化应激导致细胞膜和蛋白质的氧化损伤,而钙离子稳态失衡会引发神经元的异常兴奋和损害。
阿尔茨海默病的发病机制是一个复杂的过程,需要进一步的研究和探索。
深入了解阿尔茨海默病的病因和发病机制,对于早期诊断和治疗具有重要的指导意义。
2. 正文2.1 疾病背景介绍阿尔兹海默病是一种慢性进行性神经退行性疾病,也是老年痴呆的最常见形式。

阿尔兹海默病因及发病机制分析阿尔茨海默病(Alzheimer's disease,AD)是一种以进行性记忆障碍、认知功能受损为主要表现,伴有其他神经精神症状的慢性进行性神经系统疾病。
该病是一种常见的老年性疾病,临床症状主要为进行性认知功能障碍,但也伴有其他多系统的临床表现。
据统计,全世界约有3500万名阿尔茨海默病患者,据估计,到2050年此数字将增加到1.15亿。
阿尔茨海默病的确切病因尚不十分明确,一般认为与遗传、老化、环境因素等多种复杂因素相关。
在这篇文章中,我们将从遗传、生化、神经元损伤等多个角度分析阿尔茨海默病的发病机制,希望能够为该病的预防、治疗提供一些参考。
一、遗传因素的影响遗传因素是阿尔茨海默病发病的主要风险因素之一。
早发型阿尔茨海默病(EOAD)是一种遗传性疾病,由一些致病基因突变引起。
这些基因包括APP、PSEN1和PSEN2三个基因,它们的突变都会导致β淀粉样蛋白(Aβ)的代谢异常,从而引发AD的发病。
晚发型阿尔茨海默病(LOAD)也受遗传因素的影响,在其发病机制中,孤独基因、同工酶和介导蛋白都可能是潜在的风险因素。
APOE4等基因的多态性与阿尔茨海默病的发病风险密切相关。
通过对AD相关致病基因的研究,可以有助于了解AD的发病机制,为相关基因的治疗提供理论基础。
二、Aβ的代谢异常Aβ代谢异常是阿尔茨海默病发病机制中的一个关键环节。
正常情况下,Aβ是由APP 通过β-和γ-分泌酶酶解产生的。
但在AD患者中,Aβ的沉积成为了其主要病理特征之一。
与APP的过度活化、Aβ的异常聚集和沉积等都是AB过度产生、沉积的重要原因。
研究还发现,Aβ蛋白的异常沉积会引起神经细胞内外质膜破坏,干扰了神经元的正常代谢和功能,导致了神经元的死亡和功能受损。
通过干预Aβ代谢异常,有望为阿尔茨海默病的治疗和预防提供新思路。
三、神经元损伤在AD的发病机制中,神经元损伤是一个至关重要的因素。
研究表明,AD患者的大脑中,神经元丢失和突触受损是其主要的病理特征之一。
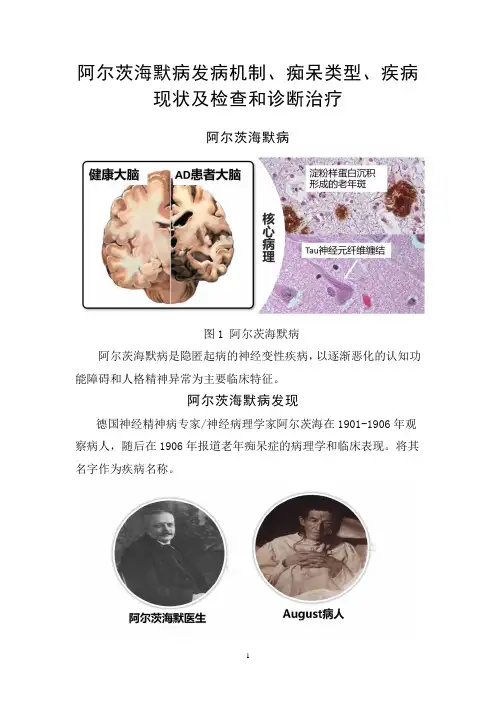
阿尔茨海默病发病机制、痴呆类型、疾病现状及检查和诊断治疗阿尔茨海默病图1 阿尔茨海默病阿尔茨海默病是隐匿起病的神经变性疾病,以逐渐恶化的认知功能障碍和人格精神异常为主要临床特征。
阿尔茨海默病发现德国神经精神病专家/神经病理学家阿尔茨海在1901-1906年观察病人,随后在1906年报道老年痴呆症的病理学和临床表现。
将其名字作为疾病名称。
图2 名为阿尔茨海默病的医生和他看诊的August病人痴呆类型图3 阿尔茨海默病是最常见的痴呆类型痴呆可以分为变性病痴呆和非变性病痴呆:变性病痴呆:阿尔茨海默病(AD):50%-70%;Lewy体痴呆(DLB):5%-10%;额颞叶痴呆(FTLD):5%-10%;帕金森痴呆(PDD):3.6%。
非变性病痴呆:血管性痴呆:15%-20%;正常压力性脑积水;其他继发疾病:感染、肿瘤、中毒和代谢性疾病等。
阿尔茨海默病现状图4 阿尔茨海默病严峻形势其他图5 阿尔茨海默病诊断标准表1 改善症状治疗表2 靶向调修治疗检查及诊断治疗根据病例1的病史,进行了神经心理检查(表3):表3 病例1患者的神经心理检从评分结果来看,认知功能未见异常,不合并焦虑抑郁等,可以认定为正常人或有轻度问题,为阿尔茨海默病的认知功能正常阶段/主观认知下降阶段,行头颅/海马MRI如下。
图6 病例1患者头颅/海马MRI头颅/海马MRI示,双侧海马体积未见明显缩小,双侧颞角未见明显扩大。
双侧海马未见明显异常信号。
脑室系统轻度扩大,脑沟、裂增宽。
中线结构无移位。
进一步行PET/CT。
图7 病例1患者PET/CT结果AV-45 PET:双侧额叶、顶叶、颞叶、后扣带回皮质淀粉样蛋白异常沉积。
脑萎缩。
FDG-PET:双侧额顶颞叶及扣带回皮质FDG代谢不均匀减低。
总体来看:①神经心理测验提示认知功能无明显受损;②无症状型淀粉样变:Aβ异常沉积;③无症状型神经退行性变:FDG代谢减低。
诊断临床前阿尔茨海默病;A+(N)+T未知。
阿尔兹海默病的发病机制摘要:阿尔茨海默病(AD)又称原发性老年痴呆症,是一种神经系统退行性疾病。
阿尔茨海默病主要有老年人患病,表现痴呆,并具有进行性和致命,使患者生活质量大幅下降,极大添加了家庭和社会负担,是一种对人类健康具有极大威胁的疾病。
阿尔茨海默病是当前医学亟待攻克的难题,科学家们正在探索AD的发病机理和治疗方法。
关键词:阿尔茨海默病、老年斑、神经元纤维缠结阿尔茨海默病(AD)是一种不可治愈的、进行性的、致命的退行性神经系统疾病。
临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征,病因迄今尚未明确。
AD会使得神经细胞大量死亡,脑组织明显萎缩、重量变轻,破坏人的记忆能力和思维能力。
阿尔茨海默病可分为早发性和晚发性两种。
早发性AD比较少见,主要是遗传因素导致的。
大多数患者属晚发性,直接致病因子尚不清楚,随着人体衰老和环境影响会导致患病。
临床上,AD划分为三个阶段:早期、中期、晚期。
早期患者出现记忆力减退;中期性格恶化,行为异常;到晚期病人生活已不能自理,无法正常活动[1]?。
据统计,全世界65岁以上人口中有500多万患有AD。
目前,中国阿尔茨海默病患者人数已居世界第一,同时也是全球增速最快的国家/地区之一,2010年中国阿尔茨海默病患者数就达到了569万,而只有21%的患者得到了规范诊断。
随着我国人口老龄化程度的不断加深,老年人口数量占全国总人口数量的比重将不断增长[2]?。
65岁以前发病者,称早老性痴呆;65岁以后发病者称老年性痴呆。
我国老年人口基数日益庞大,对AD的研究迫在眉睫。
一、阿尔茨海默病的脑病理?AD患者脑的宏观和微观均有明显形态改变,主要是脑萎缩,患者的脑回变窄、脑沟增宽、脑室变大。
脑萎缩始于内嗅皮层,随病情进展逐渐扩展至海马、内测颞叶、额顶区,而初级感觉和运动皮层(枕叶视皮层、中央前回和中央后回)相对保留[3]?。
但脑萎缩的病人不一定就是AD。
阿尔兹海默症的病理生理学变化与疾病机制阿尔茨海默症(Alzheimer's disease)是一种常见的神经退行性疾病,其主要特征是进行性的认知功能障碍与记忆受损。
本文旨在探讨阿尔茨海默症的病理生理学变化与疾病机制。
通过对病理学异常变化的深入研究,我们可以更好地理解该疾病的进展和治疗方法的探索。
1. 蛋白质异常沉积阿尔茨海默症的主要特征是脑内β-淀粉样蛋白(β-amyloid)斑块和Tau蛋白异常沉积。
β-淀粉样蛋白在正常情况下通过蛋白质代谢路径得到清除,但在阿尔茨海默症患者中,其过度聚集形成斑块。
这些斑块的积累会刺激神经元炎症反应和氧化应激,导致神经元的损伤和死亡。
另一方面,Tau蛋白的异常磷酸化会导致其在神经元内异常聚集形成神经原纤维缠结,进一步加剧病理学改变。
2. 神经递质异常在阿尔茨海默症患者脑组织中,乙酰胆碱水平显著下降。
乙酰胆碱是一种重要的神经递质,与学习记忆等认知功能密切相关。
其丢失会导致神经元之间的通信障碍,进而影响到认知能力。
此外,谷氨酰胺和多巴胺等其他神经递质也可能与阿尔茨海默症的发病机制有关,但具体机制尚不完全清楚。
3. 炎症和免疫反应在阿尔茨海默症患者的大脑中,可以观察到神经元周围胶质细胞的活化和炎症反应。
这些炎症细胞产生促炎细胞因子,如肿瘤坏死因子α(TNF-α)等,进一步激活炎症反应。
免疫细胞也参与了阿尔茨海默症的发展过程,如导致神经元损伤的β-淀粉样蛋白诱导B细胞和T细胞的异常激活。
4. 氧化应激和线粒体功能障碍氧化应激是指细胞内活性氧(ROS)生成过多而导致的一种紊乱状态。
在阿尔茨海默症患者中,由于β-淀粉样蛋白斑块的沉积和炎症反应的增加,氧化应激水平显著升高。
氧化应激可以引发线粒体功能障碍,导致能量代谢紊乱,进而损伤神经元。
此外,纤维化和神经元的线粒体DNA损伤也是阿尔茨海默症病理生理学变化的重要组成部分。
5. 基因和遗传风险阿尔茨海默症具有一定的遗传倾向,APOE基因ε4等多个基因缺陷与该疾病的发病风险密切相关。
阿尔兹海默病因及发病机制分析阿尔茨海默病(Alzheimer's disease, AD)是一种常见的中老年人神经退行变性疾病,主要表现为记忆力、思维能力、情感和行为的逐渐减退,严重影响患者的生活质量和社会功能。
其主要致病因素包括:遗传因素、老年退行性变、神经元炎症反应、脑内中毒物质积累等。
遗传因素是导致AD形成的重要因素之一。
其中,常见的遗传因素主要包括三类:APOE 基因、PSEN1基因和PSEN2基因。
APOE基因编码载脂蛋白E,其在大脑细胞膜和细胞外基质中有重要的定位和功能,研究表明,APOEε4等位基因是AD的遗传风险因素之一。
PSEN1基因和PSEN2基因分别编码PS1和PS2,是γ-分泌酶的主要组成部分之一。
γ-分泌酶是β-淀粉样蛋白(Aβ)前体的代谢酶,其中APP在γ-分泌酶的作用下被分解成Aβ蛋白质。
PSEN1和PSEN2基因突变与AD的发生密切相关。
老年退行性变和神经元炎症反应也被认为是导致AD的重要因素之一。
老年退行性变是一种常见的中老年人疾病,主要表现为神经细胞功能逐渐下降,造成大脑体积减小。
而神经元炎症反应是一种免疫细胞和神经细胞相互作用的过程。
多项研究发现,在AD患者中,慢性神经炎症反应被认为是导致大脑神经元病变和功能失调的主要机制之一。
此外,脑内神经毒素的积累也可能是导致AD的重要因素之一。
μ-淀粉样蛋白(Aβ)的聚集是导致AD发展的主要机制之一,其形成是因为Aβ前体经过γ-分泌酶的作用,形成Aβ单体,然后通过其与其他蛋白质的交互作用,形成Aβ密集斑块。
此外,tau蛋白的异常聚集也可能是导致AD的另一个重要机制,该蛋白的聚集不仅会导致神经元的损害,还可能影响正常的神经元功能。
综上所述,阿尔茨海默病的主要致病因素包括遗传因素、老年退行性变、神经元炎症反应和脑内毒素积累等,各种因素之间相互交织,共同导致神经细胞的严重损伤和功能障碍,最终造成AD的发展和进展。
因此,在AD的预防和治疗中,应综合考虑多种因素,采取多种治疗措施,以提高治疗效果,改善AD患者的生活质量。
阿尔兹海默病因及发病机制分析阿尔兹海默病是一种神经退行性疾病,主要影响老年人,尤其是超过65岁的人群。
该病主要表现为认知能力下降、记忆能力减退和语言障碍等症状,严重影响患者的生活质量和独立生活能力。
该疾病的发病机制十分复杂,具体原因还不十分清楚。
针对该病的研究主要集中在以下方面:1.脑细胞信号传递失常脑细胞之间的信息传递是病理发生的重要机制之一。
研究发现,阿尔兹海默病患者的脑细胞信号传递机制受到了严重干扰,造成了神经元射精和神经元死亡。
这种现象被认为是导致该病病理发生的主要原因之一。
2.神经炎症反应神经炎症反应也是导致阿尔兹海默病病理发生的另一种可能因素。
因为神经元无法再生或修复,当脑部受到不良刺激时,神经元周围的微胶质细胞可能分泌有害分子,例如细胞因子和自由基,从而引发对神经元的炎症反应。
神经元的死亡会释放出β-淀粉样蛋白,这可能会进一步加剧炎症反应。
3.淀粉样斑块淀粉样斑块也是阿尔兹海默病的明显特征之一。
该斑块受到了β-淀粉样蛋白的沉积,形成了一种固有蛋白质聚集体。
它们主要位于大脑皮层和海马区,这些区域对记忆和学习至关重要。
它们的积累继续影响神经元的各种生理过程,从而导致认知和语言问题。
4.磷酸化失衡脑中的磷酸化失衡可能是导致阿尔兹海默病的另一个主要机制。
磷酸化是神经元蛋白质活性的调节器,一旦失衡,神经元就不再充分运作。
不同类型的磷酸化失衡可能会导致针对特定脑区的神经缺陷。
总之,阿尔兹海默病是一个机制极其复杂的疾病。
尽管目前尚无治愈方法,但该病的治疗方案已经开始侧重于疾病的早期诊断和病理预防,以减缓病情的进展。
随着对阿尔兹海默病发病机制的认识的不断深入,我们可以期待更多的治疗方法和预防方法的发展。
阿尔兹海默病因及发病机制分析阿尔茨海默病(Alzheimer's disease, AD)是一种神经系统退行性疾病,为老年性痴呆的最常见病因。
阿尔茨海默病主要表现为认知能力逐渐减退,记忆力、智力和语言能力等多方面受损。
本文将对阿尔茨海默病的病因以及发病机制进行分析。
阿尔茨海默病的病因尚不完全清楚,但存在多种可能因素:1. 基因遗传:阿尔茨海默病具有明显的家族聚集性,大多数患者具有家族史。
研究发现,突变的APP(β-淀粉样前体蛋白)、PS1(前体蛋白酶1)和PS2(前体蛋白酶2)等基因与阿尔茨海默病有关,突变的APP会导致淀粉样β蛋白的沉积,进而诱发病变。
2. 脑组织的退行性变:阿尔茨海默病患者脑组织存在大量神经纤维缠结和淀粉样斑块,这可能是病变发生的重要机制。
淀粉样斑块主要由β-淀粉样蛋白形成,它们聚集在神经细胞外并堆积形成斑块。
淀粉样斑块的形成与β-淀粉样沉积相关。
阿尔茨海默病的发病机制涉及多个方面:1. β-淀粉样蛋白的异常代谢:正常情况下,APP在神经细胞表面被酶类切割为可溶性的APPβ和APPα。
而在阿尔茨海默病中,APP被酶类不正常切割,导致β-淀粉样蛋白的产生,大量的β-淀粉样蛋白会聚集形成斑块。
2. Tau蛋白的异常磷酸化:Tau蛋白是神经元内微管结构的支持物质。
在阿尔茨海默病中,Tau蛋白异常磷酸化,导致Tau蛋白的聚集和形成神经纤维缠结,进而干扰神经信号传递。
3. 氧化应激:阿尔茨海默病患者脑组织常见氧化应激,即细胞内自由基产生过多,造成细胞损伤和死亡。
4. 炎症反应:炎症反应也在阿尔茨海默病的发病中发挥重要作用。
大量的炎症介质释放导致神经元损伤,并进一步加剧病情。
5. 神经递质的异常释放和代谢:阿尔茨海默病患者的脑组织中常伴有神经递质水平的异常变化,如乙酰胆碱的减少,这会影响神经元之间的正常通讯。
阿尔茨海默病的病因可能与基因遗传、脑组织的退行性变等多种因素有关,病变的发生涉及到β-淀粉样蛋白异常代谢、Tau蛋白的异常磷酸化、氧化应激、炎症反应以及神经递质的异常释放和代谢。
阿尔茨海默病的发病机制解析阿尔茨海默病(Alzheimer's Disease, AD)是一种慢性进行性神经系统退行性疾病,主要表现为记忆力丧失、认知能力下降以及行为和人格改变等症状。
该疾病在老年人中非常常见,严重影响患者的生活质量。
虽然阿尔茨海默病已经被广泛研究,但其具体发生机制仍然不完全清楚。
本文将对阿尔茨海默病的发病机制进行深入解析。
一、Amyloid β 蛋白堆积:阿尔茨海默病的一个重要特征是大脑中Amyloid β (Aβ) 蛋白的聚集形成斑块,这些斑块称为β 淀粉样斑块。
Aβ 蛋白由Amyloid 前体蛋白 (APP) 经过酶切作用而产生,正常情况下会通过代谢途径维持平衡。
然而,在阿尔茨海默病患者中,出现了APP 异常代谢,导致Aβ 蛋白的异常积累。
这些Aβ 斑块在神经细胞之间沉积,并干扰了突触传递和神经元的正常功能。
二、Tau 蛋白异常磷酸化:除了Aβ 斑块,阿尔茨海默病还伴随着Tau 蛋白的异常聚集形成神经原纤维缠结。
Tau 蛋白是一种微管相关蛋白,它在正常情况下与微管结构相关,并促进神经细胞的正常功能。
然而,在阿尔茨海默病中,Tau 蛋白发生异常磷酸化,导致其失去对微管的结合能力及其它正常功能。
这些异常聚集的Tau 蛋白纤维缠结在大脑中形成堆积,影响神经元形态和功能。
三、氧化应激和炎症反应:氧化应激和炎症反应是许多慢性神经退行性疾病中普遍存在的现象。
阿尔茨海默病也不例外。
因高代谢活动和较低抵抗力,大脑更容易受到氧自由基损害。
这些自由基能够直接与DNA、脂质和蛋白质等细胞成分相互作用,导致它们的异常功能和结构改变。
另外,炎症反应也被广泛认为参与了阿尔茨海默病的发展过程。
激活的神经胶质细胞会释放炎性因子,如TNF-α 和IL-1β,进一步诱发脑内大量的炎症反应。
四、神经递质紊乱:神经递质是神经元间信息传递的关键因素,对于学习、记忆和认知功能至关重要。
在阿尔茨海默病中,多种神经递质如乙酰胆碱、谷氨酸以及多巴胺等发生损失或者异常分泌。