有机化学课件-第十一章杂环化合物及生物碱
- 格式:ppt
- 大小:3.42 MB
- 文档页数:33


汪小兰有机化学课件•有机化学概述•烃类化合物•烃衍生物目录•含氮化合物•杂环化合物与生物碱•周环反应与有机光化学•有机合成与绿色合成策略有机化学概述01有机化学定义与发展定义有机化学是研究有机化合物结构、性质、合成、反应机理及其应用的科学。
发展历程从18世纪末开始,随着化学学科的不断发展,有机化学逐渐从无机化学中分离出来,成为一门独立的学科。
有机化合物特点与分类特点有机化合物通常含有碳元素,具有多样性、复杂性和可变性等特点。
分类根据碳骨架的不同,有机化合物可分为烷烃、烯烃、炔烃、芳香烃等;根据官能团的不同,可分为醇、酚、醚、醛、酮、羧酸、酯等。
揭示生命现象促进材料科学发展推动医药事业发展拓展能源领域应用有机化学研究意义有机化合物是构成生命体的基本物质,研究有机化学有助于揭示生命现象的本质。
许多药物都是有机化合物,研究有机化学可以为药物设计和合成提供思路和方法。
有机材料在材料科学中占有重要地位,研究有机化学可以为材料科学的发展提供理论支持。
有机化合物在能源领域也有广泛应用,如石油、天然气等化石燃料以及太阳能电池等新能源技术。
烃类化合物02简单介绍烷烃的分子通式、结构特点以及命名规则。
烷烃的通式与结构特点烷烃的物理性质烷烃的化学性质烷烃的来源与用途详细阐述烷烃的颜色、状态、气味、密度、熔点、沸点等物理性质。
全面介绍烷烃的取代反应、氧化反应、异构化反应等化学性质,并配以实例说明。
简要说明烷烃在自然界中的存在形式、工业制备方法以及其在燃料、溶剂、化工原料等方面的应用。
介绍烯烃的分子通式、结构特点以及命名规则,特别强调双键的存在对分子性质的影响。
烯烃的通式与结构特点阐述烯烃的颜色、状态、气味、密度、熔点、沸点等物理性质,并与烷烃进行比较。
烯烃的物理性质详细介绍烯烃的加成反应、氧化反应、聚合反应等化学性质,配以实例说明,强调双键的反应活性。
烯烃的化学性质说明烯烃在自然界中的存在形式、工业制备方法以及其在合成橡胶、塑料、纤维等高分子化合物方面的应用。



---------------------------------------------------------------最新资料推荐------------------------------------------------------《有机化学》第十一章杂环化合物和生物碱教案首页课程名称有机化学 C Orgac Chemistry C 计划学时(2)授课章节第十一章杂环化合物和生物碱Heterocyclic Compound Alkaloid 教学目的和要求:1.了解一些常见的重要杂环化合物如糠醛,叶绿素,血红素 -吲哚乙酸、嘧啶和嘌呤衍生物,花青素,烟碱的物理和化学性质物命名规则性质 2.熟悉杂环化合 3.掌握吡咯和吡啶的物理和化学性质:。
教学基本内容:一、杂环化合物的分类和命名二、杂环化合物的结构三、杂环化合物的化学性质四、与生物有关的杂环化合物及其衍生物教学重点和难点:重点:一、杂环化合物的分类和命名二、杂环化合物的化学性质难点:杂环化合物的结构。
授课方式方法和手段:多媒体加板书作业与思考题:P259 1,2,6,10 第十一章杂环化合物和生物碱杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。
1 / 15本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。
第一节杂环化合物环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。
组成杂环的原子,除碳以外的都叫做杂原子。
常见的杂原子有氧、硫、氮等。
前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。
杂环化合物种类繁多,在自然界中分布很广。
具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。
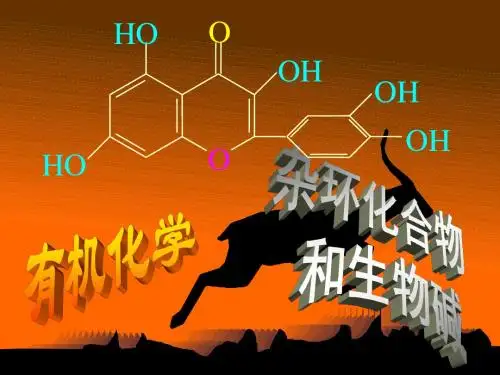
例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分生物碱等都是含氮杂环化合物。



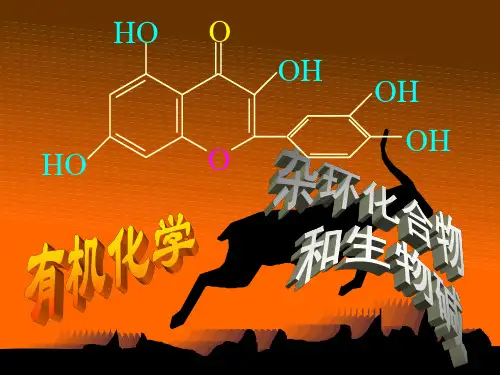

第十一章 杂环化合物和生物碱一、学习要求1.掌握杂环化合物的分类和命名2.掌握五元杂环、六元杂环和稠杂环的结构和性质 3.掌握生物碱的基本概念及分类4.了解生物碱的一般性质、提取方法及重要的生物碱二、本章要点(一)杂环化合物的分类和命名1.杂环化合物的概念 由碳原子和非碳原子所构成的环状有机化合物称为杂环化合物,环中的非碳原子称为杂原子,最常见的杂原子有氧、硫、氮等。
2.杂环化合物的分类 按环的数目不同,可分为单杂环和稠杂环两大类。
单杂环按环的大小不同又可分为五元杂环和六元杂环。
稠杂环通常由苯与单杂环或单杂环与单杂环稠合杂环化合物而成。
3.杂环化合物的命名 杂环化合物的命名比较复杂,目前我国常使用“音译法”,即按英文的读音,用同音汉字加上“口”字旁命名:O1234554321S54321N 54321N S 54321N NHH54321N NH呋喃 噻吩 吡咯 噻唑 吡唑 咪唑(furan ) (thiophene ) (pyrrole ) (thiazole ) (pyrazole ) (imidazole )654321O N N 123456N N 123456N N 123456654321N 吡啶 哒嗪 嘧啶 吡嗪 吡喃(pyridine ) (pyridazine) (pyrimidine) (pyrazine) (pyran)环上有取代基的杂环化合物的名称是以杂环为母体,并注明取代基的位置、数目和名称。
杂原子的编号,除个别稠杂环外,一般从杂原子开始编号,环上有不同不同杂原子时,按O 、S 、NH 和N 的顺序编号;某些杂环可能有互变异构体,为区别各异构体,需用大写斜体“H ”及其位置编号标明一个或多个氢原子所在的位置。
例如:2,4-二羟基嘧啶 2-氨基-6-氧嘌呤 4H -吡喃 2H -吡喃此外,还可以将杂环作为取代基,以官能团侧链为母体进行命名。
例如:N ,N-二乙基-3- 4-嘧啶甲酸 3-吲哚乙酸 2-呋喃甲醛吡啶甲酰胺(二)含氮六元杂环 1.吡啶的结构123456789NN N N H 2N OH N N OHOH123456O12345612345O6121CHOO CON(C 2H 5)2N23456COOH654321N N CH 2COOHN H1234567N..6987543211098763216587654321H N N N N N N 8765432N 74321H N 喹啉 异喹啉 吲哚 吖啶 嘌呤 ( quinoline) (isoquinoline) (indole) (acridine) (purine)吡啶为六原子六电子的闭关共轭体系,符合Hückel的4n+2规则,具有芳香性。
《有机化学》PPT课件•有机化学概述•烃类化合物•卤代烃和醇酚醚类化合物•醛酮醌类化合物目录•羧酸及其衍生物•含氮有机化合物•杂环化合物和生物碱01有机化学概述有机化学定义与发展定义研究有机化合物结构、性质、合成、反应机理及应用的科学发展历程从早期经验总结到现代科学理论体系的建立,经历了漫长的发展历程当前研究热点绿色合成、不对称合成、超分子化学等分类方法按碳骨架分类(开链化合物、碳环化合物、杂环化合物)、按官能团分类(烃类、醇类、酚类、醛类、酮类等)特点种类繁多,结构复杂,性质各异重要类别烃类、醇类、酚类、醛类、酮类、羧酸类、胺类等有机化合物特点与分类03发展趋势绿色化学合成方法的研究与应用,有机光电材料的研究与开发等01研究意义揭示有机化合物结构与性质关系,指导有机合成和新材料开发02应用领域医药、农药、染料、涂料、塑料、橡胶等化学工业领域,以及生命科学、环境科学等领域有机化学研究意义及应用领域02烃类化合物碳原子间以单键相连,其余价键被氢原子饱和。
结构特点物理性质化学性质随碳原子数增加,沸点、熔点逐渐升高,密度逐渐增大。
相对稳定,主要发生自由基取代反应,如卤代反应。
030201结构特点含有一个或多个碳碳双键。
物理性质随碳原子数增加,沸点、熔点逐渐升高,但密度比相应烷烃小。
化学性质较为活泼,可发生加成、氧化、聚合等反应。
结构特点含有一个或多个碳碳三键。
物理性质与烯烃相似,但更为活泼。
化学性质容易发生加成反应,也可发生氧化、聚合等反应。
含有苯环或其他芳香体系的烃类化合物。
结构特点具有特殊芳香气味,沸点、熔点较高。
物理性质相对稳定,可发生亲电取代反应,如硝化、磺化等反应。
化学性质芳香烃结构与性质03卤代烃和醇酚醚类化合物卤代烃命名、结构及物理性质命名卤代烃的命名遵循系统命名法,以烃为母体,卤素作为取代基进行命名。
结构卤代烃分子中,卤素原子与烃基通过共价键连接,形成极性分子。
物理性质卤代烃多为无色或淡黄色液体,具有特殊气味。