分光光度法测食品中的亚硝酸盐
- 格式:doc
- 大小:131.50 KB
- 文档页数:4

实验二食品中亚硝酸盐含量的测定一、实验目的1. 了解亚硝酸盐的危害,掌握测定食品中亚硝酸盐含量的方法。
2. 掌握色谱法和分光光度法的原理和操作方法,学会利用这两种方法测定食品中亚硝酸盐的含量。
二、实验原理1. 亚硝酸盐的危害亚硝酸盐是一种常见的致癌物质,它在在一定条件下可以转化为亚硝胺,而亚硝胺是一种强致癌物。
人体摄入过量的亚硝酸盐会导致亚硝胺的形成,从而增加患癌症的风险。
2. 色谱法测定亚硝酸盐含量色谱法测定亚硝酸盐含量的原理是利用反相色谱分离亚硝酸盐,并通过紫外检测器检测样品中亚硝酸盐的含量。
具体步骤如下:(1)样品制备:将待测样品加入水中,同时加入明矾和硫酸铜,使亚硝酸盐被还原为亚硝酸钠。
(2)色谱柱处理:用反相色谱柱,在样品进样口处注入样品,经过一定的进样残留时间后,以一定的流速进行柱洗脱。
柱洗脱时,先用无机盐水拉平基线,再用有机溶剂进行洗脱。
(3)检测:用紫外检测器检测亚硝酸盐的吸光度,从而得到亚硝酸盐的含量。
分光光度法测定亚硝酸盐含量的原理是利用亚硝酸盐和硫酸铁(Ⅱ)发生化学反应,在一定的酸性条件下生成的重氮化合物与磺基苯二胺反应,生成紫色产物,其最大吸收波长为540 nm。
具体步骤如下:(2)反应:加入磺基苯二胺后,放置反应10-30min,其间温度保持在5℃-25℃之间。
(3)检测:利用分光光度计测定紫色产物在540nm处的吸光度,计算出亚硝酸盐的含量。
三、实验步骤1. 应注意的问题(1)亚硝酸钠充分还原后,一定要在酸性环境下进行测定。
(2)在反应中要控制好温度,以保证反应的准确性。
(3)样品应尽量少受光照,以防止光照影响样品的含量。
2. 实验器材和试剂(1)色谱仪、分光光度计(2)无水乙醇、对乙酰胺、对乙酰苯胺等试剂(3)标准亚硝酸钠(4)食品样品(2)色谱柱处理:将反相柱的一端用具有无机盐的水洗涤,并用有机溶剂过渡洗脱,直到出现白色较少的沉淀为止,这表明柱已达到欧拉。
(1)样品准备:取适量待测样品,加入约150mL的水中,用硫酸酸化使亚硝酸盐转化为硝酸盐,加入对乙酰苯胺拌匀,静置10min。

熏肉制品中亚硝酸盐含量的测定华南师范大学09化一摘要:肉制品是一类深受人民群众喜爱的食品,在其生产过程中多采用亚硝酸盐作为发色剂,它不仅能使肉制品保持良好的色泽,还能抑制肉毒梭状芽孢杆菌,保证肉制品的后熟风味。
但近年来由于亚硝酸盐摄入量过多引起的食物时中毒时有发生,且加硝处理过的肉制品中的亚硝酸盐可与胺类生成强致癌物亚硝胺,对人体健康产生潜在的危害。
本实验用紫外分光光度法测定熏肉制品中亚硝酸盐的含量。
关键字:熏肉制品亚硝酸盐紫外分光光度法标准曲线法盐酸-萘乙胺引言盐的性质:亚硝酸和硝酸的钠盐和钾盐常被加入用于腌肉的混合物中,用来产生和保持色泽、抑制微生物和产生特殊的风味。
此外,亚硝酸盐(150-200mg/kg)可抑制罐装碎肉和腌肉中的梭状芽孢杆菌。
亚硝酸盐的抗微生物作用为它使用于可能生成长肉毒梭状芽孢杆菌的腌肉中提供了正当的理由。
亚硝酸盐含量只要控制在安全范围内使用不会对人体造成危害。
肉制品中,亚硝酸盐含量不得超过30mg/kg,这是因为亚硝酸盐的中毒剂量是200毫克以上,而正常膳食中的亚硝酸盐即使是大量用亚硝酸盐做食品添加剂的肉类,也不会超过50毫克。
中毒后症状:亚硝酸盐是不会蓄积在体内的,膳食中绝大部分亚硝酸盐随尿排出,不会对人体造成危害。
过量亚硝酸盐进入人体,会氧化血液中的血红蛋白为高铁血红蛋白,后者无携氧功能,导致组织缺氧,引起肠原性青紫症,皮肤青紫是本病的特征,尤以口唇青紫最为普遍。
口服亚硝酸盐10分钟至3小时后,可出现头晕、恶心、呕吐等症状。
严重者出现意识丧失、昏迷、呼吸衰竭,甚至死亡。
亚硝酸盐作用机理发色机理当血红蛋白中的铁处于+2(亚铁)并且缺乏配体键合所需的第6部位时,它被称为肌红蛋白,是由珠蛋白和血红素组成的络合物,位居血红蛋白中央的铁原子(d2sp3)具有6个配位部位,其中45个配位部位与珠蛋白的组氨酸残基键合,剩余的第6个配位部位可与各种配基提供的电负性原子络合。
亚硝酸盐为强氧化剂,进人人体后,可使血中低铁血红蛋白氧化成高铁血红蛋白,失去运氧的功能,导致组织缺氧。

亚硝酸盐对紫外分光光度法测定硝酸盐的影响
亚硝酸盐对紫外分光光度法测定硝酸盐的影响如下:
利用紫外分光光度计研究了紫外分光光度法测定硝酸盐过程中亚硝酸盐存在对测定结果的影响。
结果表明,若按照标准方法测定硝酸盐水样,测定出的硝酸盐浓度相对误差将随着亚硝酸盐浓度的升高而逐渐增大,亚硝酸盐的存在会对硝酸盐的测定值产生正偏离。
当水样中硝酸盐浓度达到100×10-6时,测得硝酸盐浓度为配制浓度的3倍多,相对误差达到230.5%。
虽然将掩蔽剂浓度增大到标准方法的10倍时能够更多地掩蔽亚硝酸。
但是当水样中亚硝酸盐浓度大于60×10-6时,仍会因掩蔽剂量不足导致相对误差再次增加。
同时,过度增加掩蔽浓度会影响吸光度,从而影响测定结果准确性。
建议当水样中亚硝酸盐浓度大于60×10-6时采用离子色谱法更为准确。


+本科毕业论文题目:几种蔬菜中亚硝酸盐含量的动态分析学院:食品科学与工程学院姓名:XXX学号:xxxxxxx专业:食品质量与安全班级:食安091班指导教师:xxx 职称:讲师二〇一三年四月目录摘要 (I)ABSTRACT (II)1 引言 (1)1.1概述 (1)1.2测定方法及研究的意义 (1)2 实验材料与方法 (2)2.1实验材料 (2)2.1.1 原材料 (2)2.1.2 主要仪器 (2)2.2实验方法 (3)2.2.1 亚硝酸盐的测定 (3)2.2.2 菌落总数的测定 (4)2.3蔬菜在家庭贮藏与加工条件下的亚硝酸盐含量的测定 (8)2.3.1 不同贮藏温度对蔬菜中亚硝酸盐含量的影响 (8)2.4煮熟菠菜在常温条件下,亚硝酸盐含量与菌落总数的关系 (8)3 实验结果与分析 (8)3.1标准曲线的绘制 (8)3.2消除抗坏血酸对实验的影响 (9)3.3家庭加工及加工后贮藏对亚硝酸盐含量的影响 (9)3.3.1 不同贮藏温度对蔬菜中亚硝酸盐含量的影响 (9)3.3.2 不同煮沸时间对蔬菜中亚硝酸盐含量的影响 (9)3.3.3 煮熟菠菜在常温条件下,亚硝酸盐含量与菌落总数的关系 (10)4 结论 (11)参考文献 (14)致谢 (15)摘要新鲜蔬菜中的亚硝酸盐含量会随着贮藏和加工条件的改变而变化,本文以分光光度法测定蔬菜中亚硝酸盐含量,分别研究了芹菜、番茄、白菜、白萝卜、菠菜和四季豆在不同贮藏温度、不同煮沸时间条件下,亚硝酸盐含量的变化;蔬菜煮熟后室温放置一定时间,亚硝酸盐含量与菌落总数之间的关系。
根据《食品中污染物限量》(GB 2762-2005)规定,蔬菜中亚硝酸盐限量卫生标准≤4 mg/kg。
试验结果表明:室温存放叶类、茎类、鲜豆类蔬菜分别不超过三天、四天和四天;根类和茄果类蔬菜中的亚硝酸盐含量在检测周期内(一周)没有超过限量标准;冰箱存放叶类蔬菜不超过四天;茎类、鲜豆类、根类和茄果类蔬菜中的亚硝酸盐含量在检测周期内(一周)没有超过限量标准。

分光光度法测定酱豆中亚硝酸盐含量卜彦林;张建夫;郑方圆【摘要】During the determination of nitrite in jiangdou ,the best condition of extracting is in 70 ℃ water for 30~45 min .The interference of pigment and vitamin C on nitrite determination could be eliminated effectively when 2 g activated carbon was added .During developer addition ,2 mL of sulfanilic acid solution and 1 mL of naphthylethy lenediamine solution after 5 min could make the color reaction more stable .And ethylenediamine after 3 min with distilled water capacity ,shake , for 15 min ,wait for color ,to make CST reagent blank ,using 1 cm of glass ,and type of S 22PC spectrophotometer determi-nation of absorbance solutions in 538 nm .The correlation coefficient R of the experiment is 0.996 78 ,and the detection limit is 0.014 47 μg/m L .%测定酱豆中的亚硝酸盐,样品提取的最佳条件是70℃水浴中提取30~40 min .加入2 g活性炭,能有效排除色素和维生素对亚硝酸盐测定造成的干扰.测定时显色剂的加入顺序为:先加入2 mL 的对氨基苯磺酸溶液,反应5 min后,再加入1 mL的萘乙二胺盐酸溶液,3 min后用蒸馏水定容,摇匀,静置15 min .待显色稳定后,以试剂空白作参比,用1 cm的比色皿在538 nm处用S 22 PC 型分光光度计测定溶液的吸光度.实验的相关系数 R=0.99678,检出限是0.01447μg/m L .【期刊名称】《周口师范学院学报》【年(卷),期】2014(000)005【总页数】3页(P81-83)【关键词】酱豆;亚硝酸盐;分光光度法【作者】卜彦林;张建夫;郑方圆【作者单位】河南省水利水电学校,河南周口466000;周口师范学院化学化工学院,河南周口466001;周口师范学院化学化工学院,河南周口466001【正文语种】中文【中图分类】O652由亚硝酸盐引起食物中毒的概率较高,亚硝酸盐主要指亚硝酸钠.在蔬菜腌制过程中,由于有害微生物及硝酸还原酶的作用,硝酸盐会转化为亚硝酸盐[1,2].在某些特定的环境下,如酸性环境、微生物菌群和适当的温度下,亚硝酸盐有可能转变为亚硝酸胺.亚硝酸盐会对人体造成危害,更为严重的是能引起高铁血红蛋白症,导致组织缺氧,出现血管扩张、血压降低等症状[3,4].因此食物中亚硝酸盐的测定是食品卫生检验的必测项目之一.亚硝酸盐的测定方法有定性和定量测定,如紫外可见分光光度计、催化法分光光度计、毛细管电泳法、示波极谱法、气相色谱法和高效液相色谱法[5-7]等.用分光光度法测定试样中亚硝酸盐的含量,为食品中亚硝酸盐含量的测定提供了一种简便可行的方法.该方法灵敏、简便、准确.1 实验部分1.1 仪器与试剂主要仪器:容量瓶,移液管,漏斗,漏斗架,比色管,比色皿,S-22PC型分光光度计(上海棱光技术有限公司),电子分析天平(北京赛多利斯公司)等.试剂:0.05g/L饱和硼砂溶液,1.0mol/L硫酸锌溶液,150g/L亚铁氰化钾水溶液,200g/L盐酸溶液,4g/L对氨基苯磺酸溶液(避光保存),2 g/L萘乙二胺盐酸溶液,0.2g/L NaNO2标准溶液.所用试剂均为分析纯.1.2 实验原理在弱酸性条件下,亚硝酸盐与对氨基苯磺酸溶液发生重氮反应,生成的重氮化合物与萘乙二胺盐酸偶联形成紫红色的偶氮染料.1.3 实验条件的选择1.3.1 最大吸收波长的选择取1.00mL浓度为4μg·mL-1的亚硝酸钠标准溶液,置于50mL的容量瓶中,加入2mL的对氨基苯磺酸溶液和1mL的萘乙二胺盐酸溶液,3min后用蒸馏水定容,摇匀,静置15min.待显色稳定后,以试剂空白作参比,在不同波长下测定吸光度,绘制吸收曲线图1,可以得到亚硝酸盐的最大吸收波长是538nm.图1 吸收曲线图1.3.2 吸光度与络合物显色时间的关系取1.00mL浓度为4μg·mL-1的亚硝酸钠标准溶液,置于50mL的容量瓶,加入2mL的对氨基苯磺酸溶液和1mL的萘乙二胺盐酸溶液,3 min后用蒸馏水定容,摇匀,分别取静置5,10,15,20,30,40,50,60min后的溶液,以试剂空白作参比,在538nm测得吸光度值,如表1所示,络合物的最佳显色时间为15min.图2 吸光度与络合物显色时间的关系图1.3.3 酸度对吸光度的影响用1mol/L的HCl和NaOH调节溶液的pH值分别为0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0.待显色稳定定容后,在538nm波长处测定其吸光度.由图3可见,当溶液pH在1.0~2.5范围内时吸光度变化不大,当pH大于3.0之后,吸光度减小,本实验中选择最适pH值2.5.图3 酸度对吸光度的影响图1.4 亚硝酸钠标准曲线的绘制用移液管精确吸取4μg/mL亚硝酸钠标准液0,0.1,0.2,0.4,0.6,0.8,1.0,1.5,2.0,2.5mL,分别置于50mL容量瓶中,各加水至25mL,分别加2mL对氨基苯磺酸溶液,摇匀.静置3~5min,各加入1mL萘乙二胺盐酸溶液,反应,并用水定容到50mL,摇匀.静置15min后,用1cm比色皿,以试剂空白为参比,用分光光度计在538nm处测定吸光度,作标准工作曲线(见图4).得到线性方程:A=0.0015+1.57965C,相关系数R=0.99678,检出限0.01447μg/mL.图4 标准曲线图1.5 样品的测定1.5.1 样品的预处理本实验中样品有两个.样品一海天黄豆酱产地:广东省佛山市.配料表:黄豆,水,白砂糖,食用盐,小麦粉,酿造食醋,食品添加剂(谷氨酸钠,5'-呈味核苷酸二钠,黄原胶,苯甲酸钠,安塞蜜,三氯蔗糖).样品二家庭自制酱豆原料:大豆,食用盐,辣椒等.将样品用榨汁机打成匀浆,准确称取50g样品至烧杯中,加水浸泡,用150mL 70℃以上的热水分4~5次将其转移到250mL容量瓶中,加入6 mL饱和硼砂溶液并摇匀,再加入2g活性炭粉,摇匀,然后加入2mL硫酸锌溶液和2mL亚铁氰化钾溶液,振摇3~5min,再加水稀释至刻度,摇匀后用滤纸过滤,弃去最初的10mL滤液,接其后滤液50mL左右用于测定.1.5.2 活性炭对样品中亚硝酸盐测定的影响以样品二为例,对酱豆进行预处理,分别取40 mL,置于两个50mL比色管中,一个不加入活性炭,另一个加入2g活性炭,摇匀.待处理完后,对各样品的亚硝酸盐含量进行测定.未加入活性炭的样品测得的吸光度为0.180,加入活性炭的一份测得的值为0.211.这是由于家制酱豆加入了含有维生素C的辣椒,处理样品时加入活性炭,可以有效地消除维生素C对亚硝酸盐含量测定的影响,同时还能消除酱豆中色素对亚硝酸盐测定的影响,所以在进行实验处理样品的时候要加入活性炭.1.5.3 样品中亚硝酸盐的测定用移液管吸取提取液40mL,置于50mL容量瓶中,加入0.4%对氨基苯磺酸溶液2mL,摇匀,5min后再加入0.2%萘乙二胺盐酸溶液1 mL,摇匀,定容,显色15min.用S-22PC型分光光度计测定,用1cm的比色皿,以试剂空白为参比,在波长538nm处测其吸光度,从标准曲线上查出相应的亚硝酸离子的浓度.同一个样品做三个平行测定.两个样品的亚硝酸盐浓度分别为0.0105 mg/kg(样品一),0.2612mg/kg(样品二),都低于国家食品卫生标准(酱腌菜≤20mg/kg),可以放心食用.2 实验过程分析(1)在处理样品时加入饱和硼砂溶液,硼砂溶入水中,即被水解为等量的硼酸与硼酸二氢钠,起缓冲溶液作用.(2)亚铁氰化钾和硫酸锌溶液作为蛋白质沉淀剂,使产生的亚铁氰化锌沉淀与蛋白质产生共沉淀.(3)活性炭对植物中的色素和VC都具有较好的吸附作用,在进行食物中亚硝酸盐含量的测定时,加入活性炭可以有效地消除测定时产生的误差,从而提高分析结果的准确性.3 结论用重氮偶合法进行酱豆中亚硝酸盐的测定,最佳条件是70℃,样品中加入2g活性炭,能有效排除色素和维生素对亚硝酸盐测定造成的干扰.测定时显色剂的加入顺序为先加入2mL的对氨基苯磺酸溶液,再加入1mL萘乙二胺盐酸溶液,3min后用蒸馏水定容,摇匀,静置15min,待络合物显色稳定后,以试剂空白作参比,用1cm的比色皿在538nm处,用分光光度计测定溶液的吸光度.实验标准曲线的线性方程为A=0.0015+1.57965C,相关系数R=0.99678.参考文献:[1]李基银.蔬菜腌渍过程亚硝酸盐生成规律与危害防治[J].食品科学,1989(3):1-6.[2]杨惠芬,王淮洲.蔬菜中硝酸盐,亚硝酸盐含量及卫生学评价[J].卫生研究,1989,18(3):45-47.[3]汪勤,高祖民.姜汁与维生素C阻断腌渍蔬菜产生亚硝酸盐的研究[J].南京农业大学学报,1991,14(4):99-103.[4]张庆芳,迟乃玉,郑艳,等.关于蔬菜腌渍发酵亚硝酸盐问题的探讨[J].微生物学杂志,2003,23(4):41-44.[5]张敏.催化动力学光度法测定水中痕量亚硝酸根[J].环境化学,1996(2):74-77.[6]许金生,袁亚莉,何爱桃.催化光度法测定硝酸盐和亚硝酸盐[J].环境科学进展,1997(12):70-72.[7]杜红霞,贺稚非,李洪军.食品中亚硝酸盐检测技术研究进展[J].肉类研究,2006,1(1):41-45.。

我国居民对加工肉制品的消费量份数为140份,样品均来自工业化生酸钠溶于水,用水稀释至500 mL。
再的水(70 ℃),将试样洗入容量瓶中,在沸水中加热15 min,取在容量瓶内加入亚铁氰化钾5 mL (106 g/L),摇拌均匀之后,接入乙5 mL(220 g/L),加入水到刻度,均匀摇晃,静态放置30 min 将上层的脂肪去除,使用滤纸过滤,去除,留作备用。
(3)检测方法。
采取分光光度法,检测腊肠内的亚硝酸盐含量,实验次次,最终的实验结果取两次实验的平均值。
按照GB 2760-2014《食品安全国家标准 食品添加剂使用标准》,腊肠亚硝酸盐含量≤30 mg/kg2 检测结果分析以上述实验步骤、条件依据,绘制亚硝酸钠的标准曲线图。
从图1中能够得知,线性关系较高,系数为0.999 3,能够精准地检测出腊肠内的硝酸盐、亚硝酸盐的含量。
回收率:本次实验选取的是一种样品,在其中加入0.015、的亚硝酸钠标准品。
重次,实验结果亚硝酸盐的回101.185%。
种腊肠,制备样品3份,每份样品检测3次,得出相对标准偏差,亚硝酸盐的精密度为为9.28%。
亚硝酸盐的含量:亚硝酸盐的检测含量见表1。
检测的84酸盐的含量为(4.85±6.10)mg/kg。
根据GB 2760-2014《食品安全国家标准 食品添加剂使用标准》,在样品中,有1份腊肠内的亚硝酸盐含量超标,含量为44.63 mg/kg,3 实验讨论硝酸盐本身属于化学致癌物,其含量直接关系着人们2015年在深圳的腌制品检测中,发现亚硝酸盐含量超标率为的含量为71.26 mg/kg。
2014—2017年,四川检测的160肉制品内的亚硝酸含量,其超标率为6.22%,最大亚硝酸盐值为122.72 mg/kg。
2015河南省的肉制品检测中,其亚硝酸盐的超标率为4.82%,亚硝酸盐的最高含量为95.35 mg/kg,其检测结果较为理想。
通过上述分析能够得知,不同的采样地点其腊肠内的硝酸盐残留也存在着较大的差异。
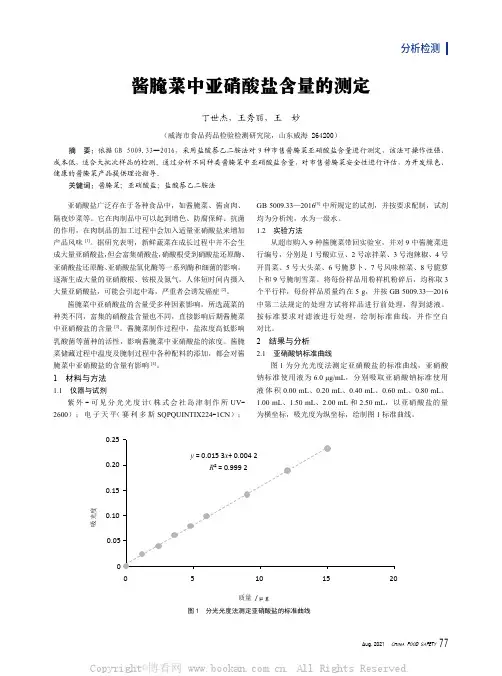
分析检测酱腌菜中亚硝酸盐含量的测定丁世杰,王秀丽,王 妙(威海市食品药品检验检测研究院,山东威海 264200)摘 要:依据GB 5009.33—2016,采用盐酸萘乙二胺法对9种市售酱腌菜亚硝酸盐含量进行测定,该法可操作性强、成本低,适合大批次样品的检测。
通过分析不同种类酱腌菜中亚硝酸盐含量,对市售酱腌菜安全性进行评估,为开发绿色、健康的酱腌菜产品提供理论指导。
关键词:酱腌菜;亚硝酸盐;盐酸萘乙二胺法亚硝酸盐广泛存在于各种食品中,如酱腌菜、酱卤肉、隔夜炒菜等。
它在肉制品中可以起到增色、防腐保鲜、抗菌的作用,在肉制品的加工过程中会加入适量亚硝酸盐来增加产品风味[1]。
据研究表明,新鲜蔬菜在成长过程中并不会生成大量亚硝酸盐,但会富集硝酸盐,硝酸根受到硝酸盐还原酶、亚硝酸盐还原酶、亚硝酸盐氧化酶等一系列酶和细菌的影响,逐渐生成大量的亚硝酸根、铵根及氮气,人体短时间内摄入大量亚硝酸盐,可能会引起中毒,严重者会诱发癌症[2]。
酱腌菜中亚硝酸盐的含量受多种因素影响,所选蔬菜的种类不同,富集的硝酸盐含量也不同,直接影响后期酱腌菜中亚硝酸盐的含量[3]。
酱腌菜制作过程中,盐浓度高低影响乳酸菌等菌种的活性,影响酱腌菜中亚硝酸盐的浓度。
酱腌菜储藏过程中温度及腌制过程中各种配料的添加,都会对酱腌菜中亚硝酸盐的含量有影响[4]。
1 材料与方法1.1 仪器与试剂紫外-可见分光光度计(株式会社岛津制作所 UV-2600);电子天平(赛利多斯 SQPQUINTIX224-1CN);GB 5009.33—2016[5]中所规定的试剂,并按要求配制,试剂均为分析纯,水为一级水。
1.2 实验方法从超市购入9种酱腌菜带回实验室,并对9中酱腌菜进行编号,分别是1号酸豇豆、2号凉拌菜、3号泡辣椒、4号开胃菜、5号大头菜、6号腌萝卜、7号风味榨菜、8号脆萝卜和9号腌制雪菜。
将每份样品用粉样机粉碎后,均称取3个平行样,每份样品质量约在5 g,并按GB 5009.33—2016 中第二法规定的处理方试将样品进行前处理,得到滤液。

熏肉制品中亚硝酸盐含量的测定华南师范大学09化一摘要:肉制品是一类深受人民群众喜爱的食品,在其生产过程中多采用亚硝酸盐作为发色剂,它不仅能使肉制品保持良好的色泽,还能抑制肉毒梭状芽孢杆菌,保证肉制品的后熟风味。
但近年来由于亚硝酸盐摄入量过多引起的食物时中毒时有发生,且加硝处理过的肉制品中的亚硝酸盐可与胺类生成强致癌物亚硝胺,对人体健康产生潜在的危害。
本实验用紫外分光光度法测定熏肉制品中亚硝酸盐的含量。
关键字:熏肉制品亚硝酸盐紫外分光光度法标准曲线法盐酸-萘乙胺引言盐的性质:亚硝酸和硝酸的钠盐和钾盐常被加入用于腌肉的混合物中,用来产生和保持色泽、抑制微生物和产生特殊的风味。
此外,亚硝酸盐(150-200mg/kg)可抑制罐装碎肉和腌肉中的梭状芽孢杆菌。
亚硝酸盐的抗微生物作用为它使用于可能生成长肉毒梭状芽孢杆菌的腌肉中提供了正当的理由。
亚硝酸盐含量只要控制在安全范围内使用不会对人体造成危害。
肉制品中,亚硝酸盐含量不得超过30mg/kg,这是因为亚硝酸盐的中毒剂量是200毫克以上,而正常膳食中的亚硝酸盐即使是大量用亚硝酸盐做食品添加剂的肉类,也不会超过50毫克。
中毒后症状:亚硝酸盐是不会蓄积在体内的,膳食中绝大部分亚硝酸盐随尿排出,不会对人体造成危害。
过量亚硝酸盐进入人体,会氧化血液中的血红蛋白为高铁血红蛋白,后者无携氧功能,导致组织缺氧,引起肠原性青紫症,皮肤青紫是本病的特征,尤以口唇青紫最为普遍。
口服亚硝酸盐10分钟至3小时后,可出现头晕、恶心、呕吐等症状。
严重者出现意识丧失、昏迷、呼吸衰竭,甚至死亡。
亚硝酸盐作用机理发色机理当血红蛋白中的铁处于+2(亚铁)并且缺乏配体键合所需的第6部位时,它被称为肌红蛋白,是由珠蛋白和血红素组成的络合物,位居血红蛋白中央的铁原子(d2sp3)具有6个配位部位,其中45个配位部位与珠蛋白的组氨酸残基键合,剩余的第6个配位部位可与各种配基提供的电负性原子络合。
亚硝酸盐为强氧化剂,进人人体后,可使血中低铁血红蛋白氧化成高铁血红蛋白,失去运氧的功能,导致组织缺氧。


香肠中亚硝酸盐的测定摘要:在弱酸条件下,亚硝酸盐与对氨基苯磺酸重氮化后,再与盐酸萘乙二胺偶合形成紫红色染料 ,建立了一种简易快速的测定食品中微量亚硝酸盐的方法。
优化了波长、酸度、显色剂用量、显色时间等实验条件。
分光光度法抗干扰能力强,根据朗伯-比耳定律能较快地测定自制食品中香肠中亚硝酸盐的含量。
盐酸萘乙二胺法因所用的分光光度计设备简单、价廉,操作简便、快速等特点,因而在肉制品检测中得到广泛使用。
本次试验,我们小组测定四个品牌的香肠亚硝酸盐的含量,目的在于通过比较不同品牌的亚硝酸盐的含量来了解目前香肠行业的亚硝酸实际加入量,给广大消费者一个购买的导向。
关键词:亚硝酸盐;香肠;分光光度法1. 前言护色剂又称呈色剂或发色剂,是食品加工中为使肉与肉制品呈现良好的色泽而适当加入的化学物质。
发色剂在食品中的作用:(1)可发色作用;(2)抑菌作用;(3)产生风味。
最常使用的护色剂是硝酸盐和亚硝酸盐。
亚硝酸盐毒性较强,各国都在保证安全和产品质量的前提下严格控制其使用。
我国目前批准使用的护色剂有硝酸钠(钾)和亚硝酸钠(钾),常用于香肠、火腿、午餐肉罐头等。
亚硝酸盐本身是白色结晶,近似食盐,但加入肉类之后,可以与肉中的血红素结合形成粉红色的亚硝基血红素,从而让肉制品在煮熟之后具有好看的粉红色。
这就是亚硝酸盐的发色作用。
未经亚硝酸盐发色的肉类在煮熟之后是白色、淡褐色或褐色的。
肉越红,煮熟后的褐色越重。
亚硝酸盐是广泛存在于自然环境中的化学物质,特别是在食物中,如粮食、蔬菜、肉类和鱼类都含有一定量的亚硝酸盐。
亚硝酸盐是常用的工业用盐,常见的亚硝酸盐有亚硝酸钠和亚硝酸钾,为白色或微黄色的结晶或颗粒粉末,无臭、味微咸涩稍苦,易潮解,易溶于水,是一种剧毒品。
亚硝酸盐是一种允许使用的食品添加剂,只要控制在安全范围内使用不会对人体造成危害。
但长期大量食用含亚硝酸盐的食物有致癌的隐患。
因为亚硝酸盐在自然界和胃肠道的酸性环境中可以转化为亚硝胺,所以,食品中亚硝酸盐的限量卫生标准为:西式蒸煮、烟熏火腿及罐头≤70 mg/kg,其他肉类罐头≤50 mg/kg,肉制品、火腿肠≤30 mg/kg,香肠(腊肠)、香肚、酱腌菜≤20 mg/kg,婴儿配方乳粉≤5 mg/kg,蔬菜≤4 mg/kg,鲜肉类、鲜鱼类≤3 mg/kg。
分光光度法测亚硝酸盐的实验报告
实验目的:
利用分光光度法测定水样中亚硝酸盐的浓度。
实验原理:
亚硝酸盐在酸性条件下与苯胺反应生成偶氮苯胺,偶氮苯胺呈深红色,可通过分光光度法测定其在特定波长的吸光度来间接测定亚硝酸盐的浓度。
实验步骤:
1. 准备工作:
a. 首先准备一系列浓度已知的标准溶液;
b. 针对每个标准溶液,按照一定比例配制相应的酸性酒石酸钠溶液;
c. 准备一定浓度的苯胺溶液。
2. 反应操作:
a. 取适量的标准亚硝酸盐溶液,加入酸性酒石酸钠溶液后,酸化;
b. 向上述溶液中加入苯胺溶液,充分混合反应;
c. 将混合液转移到比色皿中,使用分光光度计测量在特定波长的吸光度。
3. 建立标准曲线:
a. 用已知浓度的标准溶液进行上述测定,取各个浓度对应的吸光度数据;
b. 绘制标准曲线,以吸光度为纵轴,浓度为横轴,进行线性
拟合。
4. 测量未知样品:
a. 取一定体积的未知样品,按照上述反应操作进行测定;
b. 根据标准曲线,计算出未知样品中亚硝酸盐的浓度。
实验结果与讨论:
从标准曲线中可得出未知样品中亚硝酸盐的浓度。
结论:
通过分光光度法测定,得出未知样品中亚硝酸盐的浓度为XXX。
2017年03月食品中亚硝酸盐含量的测定及分析葛蕾(西北民族大学化工学院,甘肃兰州730124)摘要:食品中的亚硝酸盐污染主要来源于我们日常食物中的化学残留,肉制品在加工和储存过程中,会有亚硝酸盐生成和使用。
作物在生长过程中需要加入化学肥料,尤其是氮肥的使用居多,植物体生长机制可以造使氮以硝酸盐的形式在作物内积累,从而有很多渠道进去人体中。
由于亚硝酸盐的抑菌、抗氧化、发色等作用,亚硝酸盐在肉类加工时常用作发色剂[1]。
现如今,由于经济的发展和人们自身健康意识的不断增强,肉制品低硝化或无硝化成为人们关注的热点,亚硝酸盐用于肉制品对人体健康产生影响引起了关注叙述了亚硝酸盐的急(慢)性毒害(包括致畸和致癌性)以及人们在食用肉制品中导致的亚硝酸盐中毒,综述了亚硝酸盐的检测方法、对人体的危害以及亚硝酸盐用途分析。
关键词:亚硝酸盐;检测方法;用途;危害亚硝酸盐广泛的存在于我们的日常生活当中,它是一种有毒的化学物质,在食品中常作防腐保鲜剂,延长食品的保质期,也是香肠、嫩肉粉,肉质保鲜剂的基本配料。
尽管亚硝酸盐在改善食品防腐和储藏期方面的作用比较重要,但是亚硝酸盐对人体的危害也是需要我们注意的。
当人体中含有过量的亚硝酸盐时,导致人体出现缺氧的各种症状,甚至危及生命,造成中毒事件[2]。
因此,在食品卫生标准中,对亚硝酸盐和硝酸盐含量有明确的限制,20世纪末,硝酸盐的含量已经作为评价农产品品质的重要指标之一,本论文对于亚硝酸盐检测方法的研究和作用和下一步的展望进行了综述。
1检测方法1.1分光光度法(1)分光光度法方法的原理是在一定酸性条件下,亚硝酸盐可与对氨基苯磺酸发生重氮化反应,反应产物与盐酸乙二胺发生偶合作用,产生紫红色易分辨染料,然后确定反应的最佳条件,最后在最大吸收波长下测定吸光度。
(2)苯酚分光光度法的原理是:苯酚与亚硝酸盐在浓硫酸为催化剂,发生硝化反应,可以生成易分辨的有色物质。
简单来讲,在一定酸度性条件下,食品中的亚硝酸盐可以被低浓度的氧化剂氧化成硝酸盐,因此可间接测得亚硝酸盐的含量,具有快速、简单、准确等特点[3]。
分光光度法测定火腿肠中亚硝酸盐含量的研究作者:陈霞李存英范雯婷宋文爽魏法山来源:《现代食品·上》2017年第09期摘要:本文对GB 5009.33-2010第二法分光光度法火腿肠中亚硝酸盐含量的测定进行研究,具体研究了对氨基苯磺酸添加量及盐酸萘乙二胺添加量等对亚硝酸盐的影响。
在单因素实验的基础上,利用正交试验确定检测亚硝酸盐的最佳条件。
结果表明:显色剂反应时间和对氨基苯磺酸添加量对亚硝酸盐的检出量均具有显著影响(P显色剂反应时间>盐酸萘乙二胺添加量。
关键词:分光光度法;火腿肠;亚硝酸盐Abstract:In this study, GB 5009.33 – 2010 second spectrophotometric method improved ham nitrite. The factors including of added amount of amino benzene sulfonic acid, and add the amount of hydrochloric acid and ethylenediamine addition on nitrite were studied. The optimum conditions were obtained by orthogonal experiment design based on factor experiment. The results showed that the reaction time of the color reagent and the added amount of amino benzene sulfonic acid have significant influence on the detection rate of nitrite (P reaction time of color reagent > add the amount of hydrochloric acid ethylenediamine dihydrochloride.Key words:Spectrophotometric method; Ham sausage; Nitrite中图分类号:O657.31火腿肠是以切碎或斩碎的猪肉和鸡肉为主原料,淀粉和植物蛋白等填充剂为辅料的一种肉制品。
亚硝酸钠的检测方法亚硝酸钠是一种常用于食品加工和防腐的化学物质,但过量摄入会对健康造成危害。
因此,检测亚硝酸钠的含量对于确保食品的安全性至关重要。
目前常用的亚硝酸钠检测方法有:分光光度法、电化学法和色谱法。
下面将对这些方法进行详细介绍。
1.分光光度法分光光度法是一种基于溶液中物质吸收光的原理来测量其浓度的方法。
亚硝酸盐在酸性条件下与亚硝酸还原酶反应,生成亚硝酸,然后与萘酚反应生成有颜色的化合物。
根据化合物的特征吸收峰,通过测量吸光度来确定亚硝酸钠的浓度。
2.电化学法电化学法是利用亚硝酸钠在电极表面氧化还原反应产生的电流来测量其浓度的方法。
常用的电化学方法有循环伏安法和安培法。
循环伏安法通过改变电压的大小和方向,得到亚硝酸钠在电极表面产生氧化还原电流的特征,从而确定其浓度。
安培法则是通过测量亚硝酸钠氧化还原反应中所产生的电流来确定其浓度。
3.色谱法色谱法是一种利用柱或膜来分离和测量化学物质的方法。
常用的色谱法有气相色谱法和液相色谱法。
在亚硝酸钠的检测中,液相色谱法是最常用的方法。
该方法通过将亚硝酸钠样品通过色谱柱的固定相进行分离,再通过检测器测量其峰值的高度或面积来确定亚硝酸钠的浓度。
除了上述方法外,还可以利用分子生物学技术,如聚合酶链式反应(PCR),来检测亚硝酸盐邻苯二胺(NPH)的形成。
NPH是亚硝酸盐与蛋白质或胺类物质反应产生的致癌物质,在食品中的存在会增加健康风险。
综上所述,亚硝酸钠的检测方法有分光光度法、电化学法、色谱法和分子生物学技术等。
选择适当的方法取决于样品的特性、分析的目的和所需的准确度。
需要注意的是,在进行亚硝酸钠检测时,要保证采样过程的严谨性和实验操作的准确性,以确保测试结果的准确性和可靠性。
食品中亚硝酸盐含量检测试剂盒说明书可见分光光度法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC1490规格:50T/48S产品内容:提取液一:液体50mL×1瓶,室温保存。
提取液二:液体50mL×1瓶,室温保存。
提取液三:液体50mL×1瓶,室温保存。
提取液四:粉剂×1支,室温保存。
试剂一:液体25mL×1瓶,4℃避光保存。
试剂二:液体25mL×1瓶,4℃避光保存。
标准品:液体1mL×1支,1μmol/mL亚硝酸钠标准溶液,4℃保存。
产品说明:在食品中,亚硝酸盐可与肉品中的肌红素结合而更安定,在食品加工业中作为保色剂,以维持肉制品的良好外观,并防止肉毒梭状芽孢杆菌的产生,提高食用肉制品的安全,但是人体长期摄入亚硝酸盐过量的食品,可诱发消化系统癌变。
在酸性条件下,亚硝酸盐与对氨基苯磺酸反应生成重氮化合物,再与N-1-萘基乙二胺形成紫红色偶氮化合物,在540nm处有特征吸收峰。
自备实验用品及仪器:天平、研钵或匀浆器、台式离心机、可见分光光度计、1mL玻璃比色皿、蒸馏水。
操作步骤:一、样品处理称取样品约1g,破碎,加入1mL提取液一,沸水浴15min,冷却至室温,加入1mL提取液二,震荡摇匀,加1mL提取液三,用镊子加少量提取液四(约2mg),静置30min,10000rpm/min离心15min,取上清液待测。
二、测定步骤和操作表1、可见分光光度计预热30min以上,调节波长至540nm,蒸馏水调零。
2、将标准品用蒸馏水稀释成0.04µmol/mL标准管。
3、操作表空白管测定管标准管样品(µL)500标准管(µL)500蒸馏水(µL)500试剂一(µL)500500500试剂二(µL)500500500混匀,室温静置15min,检测A540吸光值。
注:空白管只需测定一次。
第二法 分光光度法 8 原理 亚硝酸盐采用盐酸萘乙二胺法测定,硝酸盐采用镉柱还原法测定。 试样经沉淀蛋白质、除去脂肪后,在弱酸条件下亚硝酸盐与对氨基苯磺酸重氮化后,再与盐酸萘乙二胺偶合形成紫红色染料,外标法测得亚硝酸盐含量。采用镉柱将硝酸盐还原成亚硝酸盐,测得亚硝酸盐总量,由此总量减去亚硝酸盐含量,即得试样中硝酸盐含量。 9 试剂和材料 除非另有规定,本方法所用试剂均为分析纯。水为GB/T 6682 规定的二级水或去离子水。 9.1 亚铁氰化钾(K4Fe(CN)6·3H2O)。 9.2 乙酸锌(Zn(CH3COO)2·2H2O)。 9.3 冰醋酸(CH3COOH)。 9.4 硼酸钠(Na2B4O7·10H2O)。 9.5 盐酸(ρ=1.19 g/mL)。 9.6 氨水(25 %)。 9.7 对氨基苯磺酸(C6H7NO3S)。 9.8 盐酸萘乙二胺(C12H14N2·2HCl)。 9.9 亚硝酸钠(NaNO2)。 9.10 硝酸钠(NaNO3)。 9.11 锌皮或锌棒。 9.12 硫酸镉。 9.13 亚铁氰化钾溶液(106 g/L):称取106.0 g 亚铁氰化钾(9.1),用水溶解,并稀释至1000 mL。 9.14 乙酸锌溶液(220 g/L): 称取220.0 g 乙酸锌(9.2),先加30 mL 冰醋酸(9.3)溶解,用水稀释至1000 mL。 9.15 饱和硼砂溶液(50 g/L): 称取5.0 g 硼酸钠(9.4),溶于100 mL 热水中,冷却后备用。 9.16 氨缓冲溶液(pH 9.6~9.7):量取30 mL 盐酸(9.5),加100 mL 水,混匀后加65 mL 氨水(9.6),再加水稀释至1000 mL,混匀。调节pH 至9.6~9.7。 9.17 氨缓冲液的稀释液:量取50 mL 氨缓冲溶液(9.16),加水稀释至500 mL,混匀。 9.18 盐酸(0.1 mol/L): 量取5 mL 盐酸,用水稀释至600 mL。 9.19 对氨基苯磺酸溶液(4 g/L):称取0.4g对氨基苯磺酸(9.7),溶于100 mL 20 %(V/V)盐酸中,置棕色瓶中混匀,避光保存。 9.20 盐酸萘乙二胺溶液(2 g/L):称取0.2 g 盐酸萘乙二胺(9.8),溶于100 mL 水中, 混匀后,置棕色瓶中,避光保存。 9.21 亚硝酸钠标准溶液(200 μg /mL):准确称取0.1000g于110℃~120℃干燥恒重的亚硝酸钠,加水溶解移入 500 mL 容量瓶中,加水稀释至刻度,混匀。 9.22 亚硝酸钠标准使用液(5.0 μg/mL):临用前,吸取亚硝酸钠标准溶液5.00 mL,置于200 mL 容量瓶中,加水稀释至刻度。 9.23 硝酸钠标准溶液(200 μg/mL,以亚硝酸钠计):准确称取0.1232 g 于110 ℃~120 ℃干燥恒重的硝酸钠,加水溶解,移于入 500 mL 容量瓶中,并稀释至刻度。 9.24 硝酸钠标准使用液(5 μg/mL):临用时吸取硝酸钠标准溶液2.50 mL,置于100 mL 容量瓶中,加水稀释至刻度。 10 仪器和设备 10.1 天平:感量为0.1 mg 和1 mg。 10.2 组织捣碎机。 10.3 超声波清洗器。 10.4 恒温干燥箱。 10.5 分光光度计。 10.6 镉柱 10.6.1 海绵状镉的制备:投入足够的锌皮或锌棒于 500 mL 硫酸镉溶液(200 g/L)中,经过3 h~4 h,当其中的镉全部被锌置换后,用玻璃棒轻轻刮下,取出残余锌棒,使镉沉底,倾去上层清液,以水用倾泻法多次洗涤,然后移入组织捣碎机中,加500 mL 水,捣碎约2 s,用水将金属细粒洗至标准筛上,取20 目~40 目之间的部分。 10.6.2 镉柱的装填:如图2。用水装满镉柱玻璃管,并装入2 cm 高的玻璃棉做垫,将玻璃棉压向柱底时,应将其中所包含的空气全部排出,在轻轻敲击下加入海绵状镉至8 cm~10 cm 高,上面用1 cm 高的玻璃棉覆盖,上置一贮液漏斗,末端要穿过橡皮塞与镉柱玻璃管紧密连接。如无上述镉柱玻璃管时,可以25 mL 酸式滴定管代用,但过柱时要注意始终保持液面在镉层之上。当镉柱填装好后,先用25 mL 盐酸(0.1 mol/L)洗涤,再以水洗两次,每次25 mL,镉柱不用时用水封盖,随时都要保持水平面在镉层之上,不得使镉层夹有气泡。 10.6.3 镉柱每次使用完毕后,应先以25 mL 盐酸(0.1 mol/L)洗涤,再以水洗两次,每次25 mL,最后用水覆盖镉柱。 10.6.4 镉柱还原效率的测定:吸取20 mL 硝酸钠标准使用液,加入5 mL 氨缓冲液的稀释液,混匀后注入贮液漏斗,使流经镉柱还原,以原烧杯收集流出液,当贮液漏斗中的样液流完后,再加5 mL 水置换柱内留存的样液。取10.0 mL 还原后的溶液(相当10 μg 亚硝酸钠)于50 mL 比色管中,以下按11.4自“吸取0.00 mL、0.20 mL、0.40 mL、0.60 mL、0.80mL、1.00mL„„”起依法操作,根据标准曲线计算测得结果,与加入量一致,还原效率应大于98%为符合要求。 10.6.5 还原效率计算 还原效率按式(2)进行计算。
10010AX% „„„„„„„„„„„„„„„„„„„„„„(2)
式中: X——还原效率,%; A——测得亚硝酸钠的含量,单位为微克(μg); 10——测定用溶液相当亚硝酸钠的含量,单位为微克(μg)。 11 分析步骤 11.1 试样的预处理 同5.1。 11.2 提取 称取5g(精确至0.01 g)制成匀浆的试样(如制备过程中加水,应按加水量折算),置于50 mL 烧杯中,加12.5 mL 饱和硼砂溶液(9.15),搅拌均匀,以70 ℃左右的水约300 mL 将试样洗入 500 mL 容量瓶中,于沸水浴中加热 15 min,取出置冷水浴中冷却,并放置至室温。 11.3 提取液净化 在振荡上述提取液时加入5 mL 亚铁氰化钾溶液(9.13), 摇匀, 再加入 5 mL 乙酸锌溶液(9.14),以沉淀蛋白质。加水至刻度, 摇匀, 放置30 min, 除去上层脂肪, 上清液用滤纸过滤, 弃去初滤液30 mL,滤液备用。 11.4 亚硝酸盐的测定 吸取40.0 mL 上述滤液于50 mL 带塞比色管中,另吸取0.00 mL、0.20 mL、0.40 mL、0.60 mL、0.80mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL 亚硝酸钠标准使用液(相当于0.0 μg、1.0 μg、2.0 μg、3.0 μg、4.0 μg、5.0 μg、7.5 μg、10.0 μg、12.5 μg亚硝酸钠),分别置于50 mL 带塞比色管中。于标准管与试样管中分别加入2 mL 对氨基苯磺酸溶液(9.19),混匀,静置3 min~5 min 后各加入1 mL盐酸萘乙二胺溶液(9.20),加水至刻度,混匀,静置15 min,用2 cm 比色杯,以零管调节零点,于波长 538 nm 处测吸光度,绘制标准曲线比较。同时做试剂空白。 11.5 硝酸盐的测定 11.5.1 镉柱还原 11.5.1.1先以 25 mL 稀氨缓冲液(9.17)冲洗镉柱,流速控制在3 mL/min~5 mL/min(以滴定管代替的可控制在2 mL/min~3 mL/min)。 11.5.1.2吸取 20 mL 滤液于50 mL 烧杯中,加5 mL 氨缓冲溶液(9.16),混合后注入贮液漏斗,使流经镉柱还原,以原烧杯收集流出液,当贮液漏斗中的样液流尽后,再加5 mL 水置换柱内留存的样液。 11.5.1.3将全部收集液如前再经镉柱还原一次,第二次流出液收集于100 mL 容量瓶中,继以水流经镉柱洗涤三次,每次20 mL,洗液一并收集于同一容量瓶中,加水至刻度,混匀。 11.5.2 亚硝酸钠总量的测定 吸取10 mL~20 mL 还原后的样液于50 mL 比色管中。以下按11.4 自“吸取0.00 mL、0.20 mL、0.40mL、0.60 mL、0.80 mL、1.00 mL……”起依法操作。 12 分析结果的表述 12.1 亚硝酸盐含量计算 亚硝酸盐(以亚硝酸钠计)的含量按式(3)进行计算。
1000m1000AX0111
VV„„„„„„„„„„„„„„„„„„„„(3)
式中: X1——试样中亚硝酸钠的含量,单位为毫克每千克(mg/kg); A1——测定用样液中亚硝酸钠的质量,单位为微克(μg); m——试样质量,单位为克(g); V1——测定用样液体积,单位为毫升(mL); V0 ——试样处理液总体积,单位为毫升(mL)。 以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。 12.2 硝酸盐含量的计算 硝酸盐(以硝酸钠计)的含量按式(4)进行计算。
232.110001000X1340222XVVVVm
A„„„„„„„„„„„(4)
式中: X2——试样中硝酸钠的含量,单位为毫克每千克(mg/kg); A2——经镉粉还原后测得总亚硝酸钠的质量,单位为微克(μg); m——试样的质量,单位为克(g); 1.232——亚硝酸钠换算成硝酸钠的系数; V2——测总亚硝酸钠的测定用样液体积,单位为毫升(mL); V0——试样处理液总体积,单位为毫升(mL); V3——经镉柱还原后样液总体积,单位为毫升(mL); V4——经镉柱还原后样液的测定用体积,单位为毫升(mL); X1——由式(3)计算出的试样中亚硝酸钠的含量,单位为毫克每千克(mg/kg)。 以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。 13 精密度 在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10 %。