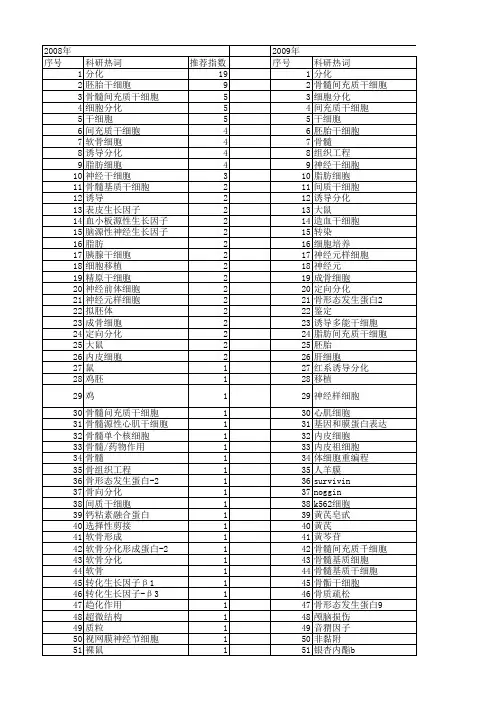
人骨髓间充质干细胞定向诱导分化为脂肪细胞
- 格式:pdf
- 大小:181.38 KB
- 文档页数:3

— 194 —CHINESE JOURNAL OF ANATOMY V ol.42 No.2 2019 解剖学杂志 2019年第42卷第2期* 国家自然科学基金(81770419)第1作者 E-mail :shite048@△通信作者,E-mail :wyangkai2005@收稿日期:2018-10-25;修回日期:2018-12-04黄芪最早记载于《神农本草经》 [1],具有脱毒生肌、补中益气、利水消肿等疗效 [2]。
已知黄芪的根可提取三种具有药效的活性成分为大分子多糖、小分子皂苷和异黄酮 [1]。
现代药理研究表明,黄芪的活性成分具有抗氧化、抗疲劳、抗衰老、增强免疫力、抗辐射、抗肿瘤,调血糖等作用,极具临床使用价值 [2-3]。
间充质干细胞(mesenchymal stem cells , MSCs )以其免疫原性相对较低、来源便利、易培养而备受组织工程领域的青睐,广泛用于神经系统、心血管系统疾病、骨科疾病、肿瘤等疾病的细胞治疗研究中 [1]。
大量的研究证明黄芪对MSCs 的生物学特性有显著的促进作用。
本文就黄芪对MSCs 增殖及分化的影响综述如下。
1 MSCs 的生物学特性概述MSCs 是一种有着多向分化潜力、增殖能力较强的成体干细胞,来源于胚胎发育早期的中胚层 [1] ,是继造血干细胞外的另一种多功能干细胞。
MSCs 大多存在于骨髓中,每100万骨髓单核细胞中最多只有5个 [1]。
同时在诸如肌肉、骨骼、脂肪组织、胎盘和脐带血中也有少量MSCs 的存在 [2]。
MSCs 在适当条件下,可定向诱导分化为中胚层细胞,例如脂肪细胞、软骨细胞、成骨细胞等,也可跨胚层诱导分化为如神经细胞、肌肉细胞、胰岛β细胞、肝细胞等内胚层或外胚层细胞 [4]。
MSCs 具有自我更新、自我复制、免疫原性低、造血支持、易于体外分离培养、体外扩增能力强等生物特性。
MSCs 还可以分泌肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、血小板生成素(thrombopoietin , Tpo )、白介素-6(interleukin-6, IL-6)、干细胞因子(stem cell factor , SCF )等生物因子 [5],并利用这些细胞因子进行自我动员和定向诱 导。

人毛囊间充质干细胞临床应用的研究进展周丹;赵辉;赵洋;刘晋宇【摘要】人毛囊间充质干细胞(hHF-MSCs)不仅具有自我更新和多向分化潜能的成体干细胞特性,同时具有来源丰富、获取方便和无伦理问题等优势,因此得到越来越多国内外学者的关注,已经成为再生医学研究和应用中重要的自体干细胞来源.本文从hHF-MSCs用于制备诱导性多能干细胞(IPS)、应用于组织工程学以及作为基因治疗的载体细胞等方面对目前国内外关于hHF-MSCs的研究进展及所取得的成果进行综述,并展望其在临床方面良好的应用前景.【期刊名称】《吉林大学学报(医学版)》【年(卷),期】2018(044)005【总页数】4页(P1086-1089)【关键词】毛囊;间充质干细胞;诱导多能干细胞;组织工程;基因治疗【作者】周丹;赵辉;赵洋;刘晋宇【作者单位】吉林大学第二医院儿科,吉林长春130041;吉林大学第二医院儿科,吉林长春130041;吉林大学第二医院儿科,吉林长春130041;吉林大学公共卫生学院卫生毒理学教研室,吉林长春130021【正文语种】中文【中图分类】R329毛囊是皮肤附属器之一,起源于胚胎发育时期表皮与间充质间相互作用。
人毛囊不断经历生长期、退行期和静止期,周而复始,形成毛囊周期。
毛囊周期伴随人类一生,同时毛囊还表达胚胎干细胞标志物sry相关HMG盒转录因子2(sry-related HMG box-containing transfactor2,SOX2),因此毛囊被认为是成体内胚胎组织之外唯一存在的胚胎样组织。
毛囊中含有多种干细胞,包括角朊干细胞、黑色素干细胞、神经脊干细胞和间充质干细胞。
这些干细胞在时空上相互作用,共同维持毛囊的自我更新和毛囊周期正常运行。
其中毛囊来源的间充质干细胞(hair follicle-derived mesenchymal stem cells, HF-MSCs)是成体干细胞家族成员之一,不仅表达间充质干细胞标志物如CD44、CD73、CD90和CD105,还具有分化为脂肪、骨、软骨、平滑肌和神经等多种组织特异性细胞的潜能[1]。

地塞米松对骨髓细胞有什么诱导作用发表时间:2019-08-06T14:22:42.140Z 来源:《总装备部医学学报》2019年第05期作者:赵菊[导读] 所以对于地塞米松与骨髓细胞之间的关系,我们也进行了系列的监测试验和探索。
四川省凉山彝族自治州冕宁县中医医院 615600地塞米松(Dexamethasone)是治疗多发性骨髓疾病方案中的重要组成部分,疗效已经被认可,但是其引起不良的反应也较多。
随着对骨组织的进程研究和发展,骨髓细胞的成骨潜能受到了越来越多人的关注和重视。
正常的骨髓细胞成分是比较复杂的,包括造血和基质两个大系统,其中具有成骨潜能的细胞多数来自于基质干细胞。
所以对于地塞米松与骨髓细胞之间的关系,我们也进行了系列的监测试验和探索。
一、地塞米松的背景地塞米松又叫氟美松或德沙美松、是猪病防治中常用的一种人工合成的长效的糖皮质激素,是泼尼松龙的氟化衍生物。
在肝内可以转换成氢化考的松地塞米松,属于肾上腺皮质激素类的药物。
具有抗炎、抗过敏、抗休克和抗毒等作用,临床上一般用于严重的细菌感染性疾病、过敏性疾病、休克、局部炎症等综合治疗。
来那度胺联合地塞米松的治疗方案已经应用于初治并且不适合的移植和复发难治的骨髓疾病,第一代的蛋白酶体抑制剂硼也被批准治疗于初治并且适合移植的骨髓病了。
目前这两种药分别联合地塞米松用于治疗骨髓病的效果都得到了广泛的认可。
大剂量与小剂量的研究通常是解决骨髓病化疗方案中不可缺少的因素。
地塞米松的应用也会导致一些不良的反应,其中包括升高血糖导致继发的糖尿病和原发糖尿病并发症的进展、血压的升高、乙肝病毒再激活导致的爆发性肝炎、增加感染的几率、精神异常、骨质疏松、白内障等疾病。
在临床工作中,临床如需要应用地塞米松治疗,含地塞米松在内的治疗方案同时也会给患者带来一系列的不良反应。
因此在关注治疗药物疗效的同时,我们也应关注药物的不良反应。
二、骨髓基质细胞骨髓基质细胞是存在于成体骨髓组织中的一类细胞,具有多向分化潜能。


脂肪与骨髓来源间充质干细胞生物学特性的比较朱希山;施薇;台卫平;安广宇【摘要】背景:近几年来脂肪来源的间充质干细胞因其取材容易也被广泛研究.目的:比较脂肪来源和骨髓来源间充质干细胞的生物学特性.方法:分离及体外培养人骨髓源间充质干细胞和脂肪源间充质干细胞,比较它们的表型、细胞倍增时间及分泌因子水平等.结果与结论:脂肪来源和骨髓来源的间充质干细胞在细胞表型上类似,只有CD106的表达有差异.脂肪来源间充质干细胞增殖速率比骨髓来源的间充质干细胞快.在相同体积的脂肪组织中能够得到的干细胞前体细胞的数量是骨髓的10倍以上.提示脂肪来源和骨髓来源的间充质干细胞具有相同功能,但脂肪组织是一个更有应用前景的干细胞来源.%BACKGROUND: Recently, adipose tissue derived mesenchymal stem cells due to easy to be harvested have been widely studied. OBJECTIVE: To compare the biological characteristics of adipose tissue derived mesenchymal stem cells and bone marrow mesenchymal stem cells. METHODS: Adipose tissue derived mesenchymal stem cells and bone marrow mesenchymal stem cells were isolated and cultured in vitro to compare their phenotype, cell doubling time and the level of secreted factors. RESULTS AND CONCLUSION: Adipose tissue derived mesenchymal stem cells have similar phenotype and differentiation ability as bone marrow mesenchymal stem cells except CD106 expression. The frequency of mesenchymal stem cells in bone marrow and adipose tissue was also calculated and found that mesenchymal stem cells frequency in adipose tissue was 10 times higher than bone marrow. This result can be an instruction for mesenchymal stem cells clinical use.【期刊名称】《中国组织工程研究》【年(卷),期】2011(015)032【总页数】5页(P5936-5940)【关键词】脂肪间充质干细胞;骨髓间充质干细胞;生物学特性;表型;周期【作者】朱希山;施薇;台卫平;安广宇【作者单位】首都医科大学附属北京世纪坛医院(北京大学第九临床医学院)肿瘤内科,北京市,100038;首都医科大学附属北京世纪坛医院(北京大学第九临床医学院)肿瘤内科,北京市,100038;首都医科大学附属北京世纪坛医院(北京大学第九临床医学院)肿瘤内科,北京市,100038;首都医科大学附属北京世纪坛医院(北京大学第九临床医学院)肿瘤内科,北京市,100038【正文语种】中文【中图分类】R394.20 引言间充质干细胞是一群存在于身体各个组织内具有贴壁能力的多潜能干细胞,具有成骨、成脂肪、成软骨和成肌等分化能力。

世界最新医学信息文摘 2019年 第19卷 第101期73投稿邮箱:zuixinyixue@·临床研究·人骨髓间充质干细胞原代提取及成神经诱导分化杨华1,吴雷2,孙赛男3,孙博谦1,王玲玲1,3(1.北华大学附属医院 神经内科,吉林 吉林 132013;2.吉林市中心医院 心胸乳甲外科,吉林 吉林132602;3.北华大学附属医院 精准医学中心,吉林 吉林 132013)0 引言运动神经元病为神经系统死亡率、致残率均较高的疾病,患者在病程中可表现为脊髓前角细胞受损、脑干运动神经元缺失以及皮质锥体细胞和锥体束等单一损伤或累加症状。
目前尚无有效药品能阻止运动神经元病的进展,患者多在5年内死亡,为此国内外学者将治疗方案寄希望于神经细胞移植以及神经细胞的自体修复,研究结果提示间充质干细胞可以在受损的脑组织及脊髓中生存、增殖、迁移及分化成神经样细胞。
本研究旨在探讨间充质干细胞原代提取的方法及细胞诱导分化能力,为自体细胞移植奠定基础。
1 资料和方法1.1 主要试剂。
DMEM/F12培养液(Gibco ),胎牛血清(Hyclone ),抗CD14、CD19、CD45、HLA-DR 及CD73、CD90、CD105单克隆抗体,碱性成纤维细胞生长因子、表皮生长因子购自中国碧云天生物技术公司。
《骨髓、脐带血细胞处理试剂盒》来源于加拿大威尔森公司。
其他试剂均由北华大学附属医院脑血管病研究所提供。
1.2 间充质干细胞的分离和培养。
日间手术室取患者髂前上棘5 mL 骨髓液注入15 mL 无菌离心管培养液内。
按加拿大威尔森公司研制的《骨髓、脐带血细胞处理试剂盒》说明书进行骨髓有核细胞混悬液的制备及细胞计数。
所获得的细胞沉淀使用含10%胎牛血清的 DMEM/F12(100 u/mL 青霉素和100 u/mL 链霉素)培养液重新制成单细胞悬液,接种于培养瓶中,在5%CO 2,37℃,饱和湿度的培养箱中培养,培养3 天后进行首次换液,弃去未贴壁细胞,后续2-3天换液1次,待细胞融合达80%以上使用0.25%胰蛋白酶进行消化并传代培养。

脂肪细胞的基础知识脂肪细胞的生长全过程及其形态变化脂肪母细胞,是指能向脂肪细胞分化的ADSCs在激素、生物活性因子、寒冷等因素刺激下均能逐渐分化成为单能干细胞。
它可保持着干细胞增殖活跃的特性,脂肪母细胞再进一步分化为前脂肪细胞,即通常人们所说的脂肪细胞前体。
前脂肪细胞再经历细胞融合、接触抑制和克隆扩增等步骤启动向成熟脂肪细胞分化,并在胰岛素、地塞米松等诱导剂作用下完成向成熟脂肪细胞的分化。
全过程可以表示为:多能干细胞——脂肪母细胞——前脂肪细胞——不成熟脂肪细胞——成熟脂肪细胞。
生长期前脂肪细胞的形态与成纤维细胞相似,经诱导分化,其细胞骨架和细胞外基质发生变化,开始进入不成熟细胞向成熟细胞转变。
细胞形态由成纤维细胞样逐渐趋于类圆或圆形,胞体逐渐增大,胞质中开始出现小脂滴,脂质开始累积,以后小脂滴增多并融合为较大的脂滴,可经油红“O”染色等方法于显微镜下显色,从而获得成熟脂肪细胞的形态特征。
此时的细胞无分裂增殖能力,为脂肪细胞分化的终末阶段。
张高娜,梁正翠.动物脂肪细胞的研究进展[J].饲料工业,2009,30(2):42-44.脂肪细胞由起源于中胚层的间充质干细胞逐步分化形成,按间充质干细胞→脂肪母细胞→前脂肪细胞→不成熟脂肪细胞→成熟脂肪细胞的过程发展。
前脂肪细胞在多种转录因子调控下,激活脂肪组织相关基因,并在这些基因的顺序性调控下,经一系列复杂的步骤分化为成熟脂肪细胞。
张艳.脂肪细胞分化过程中的分子事件[J].儿科药学杂志,2008,14(1):56-57.间充质干细胞概念:不同文献中,分别命名为抽脂处理细胞(processed lipoaspirate cells, PLA),脂肪基质微管碎片细胞(stromal vascularfraction cells, SVF),脂肪组织源基质细胞(adipose-tissue derived stromal cells, ATSCs),脂肪源中胚层干细胞(adipose-derived mesodermal stem cells, ADMSCs)等。

骨髓间充质干细胞的研究进展作者:闫德祺等来源:《中国当代医药》2013年第24期[摘要] 骨髓间充质干细胞(BMSCs)是骨髓基质中存在的非造血系的成体干细胞,具有多向分化潜能,已成为国内外基础医学和临床医学研究的热点。
本文简要介绍了BMSCs的概念提出、生物学特性、培养、鉴定,并根据近年来国内外包括应用中药进行的诱导分化、组织工程、基因治疗、再生医学等相关研究及临床应用前景作一综述。
[关键词] 骨髓间充质干细胞;诱导分化;组织工程;中药[中图分类号] R392.12 [文献标识码] A [文章编号] 1674-4721(2013)08(c)-0025-03早在1867年,世界著名病理学家Cohneim发现了骨髓中非造血系的干细胞,发现这类干细胞能够产生愈合伤口的成纤维细胞,后来Caplan[1]称之为间充质干细胞(mesenchymal stem cells,MSCs),因为这类细胞除骨髓外,还广泛分布于脂肪、外周血、脐血、羊水、胎盘、胎肺、胎肾、牙髓、肌腱、滑膜、骨骼肌等不同的组织中,可定向分化为造血细胞以外的神经胶质细胞、肌细胞、腱细胞、成软骨细胞、成骨细胞、脂肪细胞、心肌细胞、平滑肌细胞等多种细胞,支持造血,对造血干细胞有扩增作用,具有贴壁生长、高度可塑、免疫调节的性质,在体外易分离和扩增,还易于外源基因的转入和表达[1-2]。
本文在此基础上对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的研究及其应用作一综述,以期开拓新的研究领域和临床应用。
1 改良性的BMSCs分离培养和鉴定方面的研究体外培养的小鼠及人的BMSCs形态学特征主要表现为梭形、纺锤形,少数为多角形。
BMSCs的体外分离方法有四类:贴壁培养法、密度梯度离心法、流式细胞术和免疫磁珠分离法。
贴壁培养法更换培养液去除造血系细胞后还残留有单核细胞、淋巴细胞贴壁生长,需要严格控制胰蛋白酶的剂量和消化时间,连续培养才能清除并得到相对的纯化[3]。

骨髓间充质干细胞成脂和成骨分化过程中Wnt信号通路的调控效应李萍华;刘钰瑜;崔燎【摘要】背景:骨髓间充质干细胞的成脂肪分化与成骨分化比例的失衡与许多骨疾病密切相关,而近些年发现Wnt信号通路在调控骨髓间充质干细胞的分化方向中起重要作用.目的:通过Wnt信号通路PCR基因芯片观察大鼠骨髓间充质干细胞分化为脂肪细胞和成骨细胞后相关基因表达的变化,寻找Wnt信号通路中调控骨髓间充质干细胞分化的靶基因.方法:采用大鼠第3代骨髓间充质干细胞分别进行成骨诱导和成脂诱导,7 d后用Trizol萃取培养瓶中的细胞总RNA,倒置显微镜下观察骨髓间充质干细胞形态特征及成骨诱导后和成脂诱导后细胞形态特征.采用Wnt信号通路PCR芯片(大鼠)进行摹因芯片检测,以未诱导组为对照,计算成脂肪诱导,成骨诱导后相关基因上调/下调的比值.结果与结论:①倒置显微镜下观察,传3代后可获得均一性较高的骨髓间充质干细胞,骨髓间充质干细胞经成骨诱导后向成骨细胞方向分化,经成脂诱导后向脂肪细胞方向分化.②与未诱导组相比,骨髓间充质干细胞成脂诱导后Wnt信号通路表达上调的基因(Dkk-1,kremen,FZD1,FZD7)等15个(ratio>2),下调的基因(sFrp 5,β-catenin,Dvl3,Tcf7)等16个(ratio<0.5).成骨诱导后,Wnt信号通路表达上调的基因(Dkk1,kmmen,β-catenin,Wnt11)6个,表达下调的基因(sFrp5,sFRP4,Fzd1)等15个.提示WnI信号通路在骨髓间克质干细胞成脂细胞分化和成骨细胞分化中发挥重要作用.【期刊名称】《中国组织工程研究》【年(卷),期】2010(014)010【总页数】6页(P1749-1754)【关键词】脂肪细胞;成骨细胞;Wnt信号通路;骨髓间充质干细胞;基因芯片;DKK-1【作者】李萍华;刘钰瑜;崔燎【作者单位】广东医学院药理教研室,广东省湛江市,524023;广东医学院药理教研室,广东省湛江市,524023;广东医学院药理教研室,广东省湛江市,524023【正文语种】中文【中图分类】R394.20 引言骨髓基质细胞是由许多细胞群体组成的异质细胞群,其间存在的间充质干细胞是一种具有自我更新、复制及多向分化潜能的成体干细胞。
Wnt/β—catenin调控骨形成分子机制的研究进展OP的病理机制主要与成骨分化能力减弱、成脂分化能力增强,骨组织微循环血供减少有关[1-2]。
BMSCs(Bone mesenchymal stem cells,BMSCs)是成骨细胞的起源。
在老龄OP患者中,BMSCs的含量不仅显著减少,分化能力明显减弱,且增殖缓慢,移植过程病毒感染风险大,免疫原性与成本也较高。
人脐血间充质干细胞(Human umbilical cord blood mesenchymal stem cells,hUCB-MSCs)在体外诱导条件下具有向成骨细胞定向分化的巨大潜能[3],来源更丰富,临床取材方便,分离纯度更高,具有强大的增殖与自我更新能力,免疫原性较低,能耐受更大程度的HLA配型不符,蕴藏着比BMSCs更加优越的临床应用价值[4]。
因此,通过持续激活Wnt/β-catenin信号通路,启动与增强hUCB-MSCs的自身成骨分化能力,为临床OP的干细胞治疗提供新的策略。
1 Wnt/β-catenin调控骨形成的分子机制Wnt/β-catenin信号通路对成骨分化的调控主要表现在控制MSCs的分化方向和早期分化潜能。
Wnt蛋白和卷曲蛋白FZD(Frizzled)以及低密度脂蛋白受体LRPs(LDL-rececptor related proteins)结合激发了细胞内信号转导,使GSK-3β磷酸化而失活,从而维持β-catenin的稳定。
稳定的β-catenin在细胞质内聚集,转移到细胞核内,后与转录因子TCF/LEF结合,启动细胞靶基因Runx-2、DKx-5,Osterix等的转录,调控MSCs的生长(图1示)。
Wnt/β-catenin的激活不仅可促进MSCs向成骨细胞分化,通过上调成骨相关基因直接促进骨形成,而且可通过抑制成脂关键因子PPARγ-2等的表达来调控前体细胞定向成骨分化。
图11.1激活Wnt/β-catenin信号通路调控MSCs成骨分化Wnt/β-catenin信号通路通过调控BMSCs的分化方向和早期分化潜能来调节成骨分化能力[5]。