含硫化合物介绍
- 格式:pdf
- 大小:177.94 KB
- 文档页数:8

含硫化合物知识点总结初中一、硫的性质1. 硫的性质硫是一种非金属元素,化学性质活泼,常见的形态包括硫磺、硫化物等。
硫在自然界中广泛存在,在地壳中的含量较多。
硫的化合价常见有-2、0和+6等。
2. 硫的化合物硫化合物指的是硫和其他元素形成的化合物,常见的包括硫化氢、二氧化硫、硫酸盐等。
它们具有独特的化学性质,在工业生产和人类生活中具有广泛的应用。
二、硫化合物的性质1. 硫化氢硫化氢是一种具有刺激性气味的无色气体,易燃易爆。
它可以与氧气发生燃烧反应,生成二氧化硫和水。
硫化氢在皮肤和呼吸道接触时具有毒性,可引起中毒。
2. 二氧化硫二氧化硫是一种具有刺激性气味的无色气体,易溶于水。
它是一种重要的工业原料,用于制取硫酸和其他化工产品。
此外,二氧化硫也是大气污染的重要来源之一,它会形成酸雨,对环境造成危害。
3. 硫化物硫化物是硫和金属元素的化合物,常见的有硫化铁、硫化铜等。
它们具有独特的性质,可以用作金属提取、制备合金等。
另外,一些硫化物还具有半导体性能,被应用于电子器件中。
4. 硫酸化合物硫酸盐是含有硫酸根离子的化合物,常见的有硫酸钠、硫酸铜等。
它们具有酸性,可以与碱和金属反应,生成对应的盐和水。
硫酸盐在工业生产、农业生产和医药中都具有重要的用途。
三、硫化合物的应用1. 工业生产硫化合物在工业生产中有着广泛的应用,如制酸、制药、染料生产等。
硫酸盐是重要的化工原料,被广泛用于肥料、皮革、玻璃等行业。
2. 农业生产硫化合物在农业生产中也具有重要的作用,硫酸铵和硫酸钾是常用的化肥原料,可以提供作物生长所需的硫元素。
此外,硫磺还可以用于农药制备。
3. 矿业开采硫化物是很多金属矿石的主要成分,如硫化铁、硫化铜等,它们是金属提取的重要原料。
此外,一些硫化物还具有一定的经济价值,如黄铁矿等。
4. 环境保护硫化合物在环境保护中具有重要作用,二氧化硫是大气污染的重要来源之一,需要加强控制排放。
另外,硫酸盐还可以用于处理废水和废气,减少环境污染。

《含硫化合物之间的转化》知识清单一、含硫化合物的种类含硫化合物在自然界和人类生活中广泛存在,种类繁多。
常见的含硫化合物包括二氧化硫(SO₂)、三氧化硫(SO₃)、硫化氢(H₂S)、硫酸(H₂SO₄)、亚硫酸(H₂SO₃)、硫单质(S)等。
二、含硫化合物的性质1、二氧化硫(SO₂)物理性质:无色、有刺激性气味的气体,易溶于水,密度比空气大。
化学性质:具有酸性氧化物的通性,能与水反应生成亚硫酸(H₂SO₃),与碱反应生成亚硫酸盐和水。
同时,SO₂具有还原性,能被氧气、氯气等氧化剂氧化为三氧化硫(SO₃);还具有漂白性,能使品红溶液褪色,但加热后又会恢复原色。
2、三氧化硫(SO₃)物理性质:无色、易挥发的固体,熔点为 168℃,沸点为 448℃。
化学性质:具有酸性氧化物的通性,能与水剧烈反应生成硫酸,与碱反应生成硫酸盐和水。
3、硫化氢(H₂S)物理性质:无色、有臭鸡蛋气味的气体,密度比空气略大,能溶于水。
化学性质:具有可燃性,在空气中燃烧生成二氧化硫和水;具有还原性,能被氧气、二氧化硫等氧化剂氧化;是一种二元弱酸,能与碱反应生成硫化物和水。
4、硫酸(H₂SO₄)物理性质:无色、油状液体,沸点高,难挥发,能与水以任意比例互溶,溶解时放出大量的热。
化学性质:具有酸的通性,能使酸碱指示剂变色,能与活泼金属、金属氧化物、碱、盐等反应。
浓硫酸具有吸水性、脱水性和强氧化性。
5、亚硫酸(H₂SO₃)物理性质:无色、有刺激性气味的液体。
化学性质:具有酸性,不稳定,易分解为二氧化硫和水;具有还原性,能被氧气等氧化剂氧化为硫酸。
6、硫单质(S)物理性质:黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳。
化学性质:具有氧化性,能与金属(如铁、铜)反应生成金属硫化物;具有还原性,能与氧气等氧化剂反应。
三、含硫化合物之间的转化关系1、硫燃烧生成二氧化硫:S + O₂=点燃= SO₂2、二氧化硫催化氧化生成三氧化硫:2SO₂+ O₂=催化剂=2SO₃3、三氧化硫与水反应生成硫酸:SO₃+ H₂O = H₂SO₄4、二氧化硫与水反应生成亚硫酸:SO₂+ H₂O ⇌ H₂SO₃5、亚硫酸被氧气氧化生成硫酸:2H₂SO₃+ O₂= 2H₂SO₄6、硫化氢燃烧生成二氧化硫(氧气充足):2H₂S + 3O₂=点燃= 2SO₂+ 2H₂O7、硫化氢燃烧生成硫单质(氧气不足):2H₂S + O₂=点燃=2S + 2H₂O8、浓硫酸与铜反应生成硫酸铜、二氧化硫和水:Cu +2H₂SO₄(浓) =加热= CuSO₄+ SO₂↑ + 2H₂O9、浓硫酸与碳反应生成二氧化碳、二氧化硫和水:C +2H₂SO₄(浓) =加热= CO₂↑ + 2SO₂↑ + 2H₂O四、含硫化合物之间转化的应用1、工业生产硫酸的工业制法:通过上述一系列反应,先由硫燃烧生成二氧化硫,再将二氧化硫催化氧化为三氧化硫,最后用三氧化硫与水反应制取硫酸。



加热加热加热点燃加热 点燃 加热课题含硫化合物的性质及其应用教学过程一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态) 2Na+S===Na 2S (剧烈反应并发生爆炸)2Al+3S Al 2S 3(制取Al 2S 3的唯一途径)Fe+S FeS (黑色)2Cu + S Cu 2S (黑色) ②与非金属反应S+O 2 SO 2S+H 2H 2S (说明硫化氢不稳定)③与化合物的反应S+6HNO 3(浓)H 2SO 4+6NO 2↑+2H 2OS+2H 2SO 4(浓) 2SO 2↑+2H 2O3S+6NaOH 2Na 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2.硫的氢化物: ①硫化氢的制取:Fe+H 2SO 4(稀)=FeSO 4+H 2S ↑(不能用浓H 2SO 4或硝酸,因为H 2S 具有强还原性) ——H 2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时,2H 2S+O 22S+2H 2O (H 2S 过量)当22/O S H n n ≤2/3时,2H 2S+3O 2点燃2SO 2+2H 2O (O 2过量)当23222<<O SH n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、Fe 3+、HNO 3、KMnO 4等,甚至SO 2均可将H 2S 氧化。
加热SO2 SO2 CO2 CO2C.不稳定性:300℃以上易受热分解③H2S的水溶液叫氢硫酸,是二元弱酸。


含硫化合物的用途含硫化合物在生活和工业中有着广泛的用途。
硫化合物是指含有硫元素的化合物,其中硫的氧化态可以为-2、0、+4、+6。
首先,含硫化合物在农业中具有重要的作用。
硫是植物生长所必需的微量元素之一,能够促进植物的光合作用,提高植物的光合效率和养分吸收能力。
因此,硫化合物常被用作农药的主要成分,例如硫磺和硫胺素。
硫磺可以用于防治病虫害,如硫磺熏蒸可以杀灭农作物种子表面的病菌和虫卵,保护作物的生长。
硫胺素是维生素B1的一种硫化衍生物,可以用作动物饲料添加剂,提高动物的生长速度和健康水平。
其次,含硫化合物在化学工业中有着重要的应用。
硫酸是一种重要的含硫酸化合物,广泛应用于冶金、石油、纺织、化肥等工业生产。
硫酸被用来生产肥料,例如磷酸二氢钾肥料中的磷酸二氢铵和磷酸二氢钾,以及超磷酸钙肥料中的磷酸钙。
此外,硫酸还可以用于制备其他化学品,如硫酸亚铁、硫酸铵等。
硫酸亚铁是电池制造业中常用的电池电解液,硫酸铵则是一种常见的氮肥。
含硫化合物还在制药工业中发挥着重要作用。
硫化合物在制药中常用于合成药物原料,例如硫酸巴曲酮是一种抗抑郁药,硫酸卡巴拉汀是一种消化性溃疡治疗药物,它们都是含有硫化合物的药物。
此外,硫化合物还可以用于合成抗生素、抗肿瘤药物等重要药物。
含硫化合物还在能源领域具有重要应用。
硫化氢是一种常见的含硫气体,它可以被用作生产化学品和能源转换。
例如,硫化氢被用来制造硫醇、硫酸铵以及生产液化石油气等。
此外,硫醇化合物也被用于石油提炼和燃料添加剂的制备。
此外,含硫化合物还广泛应用于日常生活中。
有机硫化合物常被用作香料和香水的成分,例如硫化苯和硫化酚等。
硫酸氢钠是一种常见的食品添加剂,被用来调节食品的酸碱度和增加食品的酸味。
硫酸铜是一种常见的消毒剂,广泛用于水处理和游泳池消毒等领域。
另外,硫化合物还常被用作制备染料、油漆和胶水等工业产品。
总而言之,含硫化合物在农业、化学工业、制药、能源和日常生活中均具有广泛的应用。

含硫化合物的性质与反应硫是一种常见的元素,它在自然界和化学反应中都扮演着重要角色。
硫可以与其他元素形成含硫化合物,在化学研究和工业生产中具有广泛的应用。
本文将介绍含硫化合物的性质和反应,以及一些相关的应用。
一、含硫化合物的性质1. 物理性质:含硫化合物通常呈现出白色或黄色结晶固体,具有特定的熔点和沸点。
一些含硫化合物也可溶于水或有机溶剂中。
此外,它们往往具有恶臭的气味,如硫化氢(H2S)。
2. 化学性质:含硫化合物在化学反应中表现出一系列特征。
首先,它们能够与氧气反应生成硫酸,这是含硫化合物最常见的反应之一。
例如,二氧化硫(SO2)与水反应形成亚硫酸(H2SO3),进一步氧化则形成硫酸(H2SO4)。
其次,含硫化合物还可以与金属离子反应生成金属硫化物。
这种反应常被用于化学分析和沉淀反应。
最后,含硫化合物还能够参与氧化还原反应,例如硫酸铜与铁反应形成硫酸亚铁和硫。
二、含硫化合物的反应1. 氧化反应:氧化反应是含硫化合物最常见的反应之一。
例如,硫化氢与氧气反应生成二氧化硫和水。
反应方程式如下:2H2S + O2 -> 2SO2 + 2H2O此外,硫化物也可以以其他形式参与氧化反应,产生不同的硫氧化物。
2. 还原反应:含硫化合物也可以参与还原反应。
例如,金属硫化物可以与氧化剂反应,将硫还原为硫化物。
这种反应在冶金和电化学工业中常被应用。
3. 酸碱反应:含硫化合物通常表现出酸性反应。
例如,硫化氢溶于水会生成硫酸,并具有酸性溶液的性质。
与碱性物质反应时,硫化物离子会与金属离子结合形成金属硫化物沉淀。
三、含硫化合物的应用1. 工业生产:含硫化合物在许多工业领域有重要应用。
例如,二氧化硫广泛用于造纸、制药、食品和化肥工业中。
硫化氢则在石油和矿石冶炼过程中用作氧化剂和消毒剂。
2. 化学分析:含硫化合物通常用于化学分析,用于检测金属离子。
通过与金属离子反应生成可溶性或不溶性的金属硫化物沉淀,可以实现对金属离子的检测和定量。
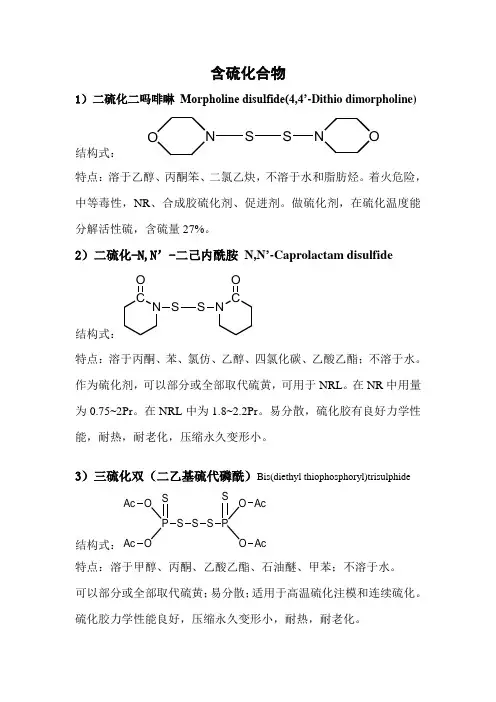
含硫化合物1)二硫化二吗啡啉Morpholine disulfide(4,4’-Dithio dimorpholine)结构式:S N OSNO特点:溶于乙醇、丙酮笨、二氯乙炔,不溶于水和脂肪烃。
着火危险,中等毒性,NR、合成胶硫化剂、促进剂。
做硫化剂,在硫化温度能分解活性硫,含硫量27%。
2)二硫化-N,N’-二己内酰胺N,N’-Caprolactam disulfide结构式:NCNC O OS S特点:溶于丙酮、苯、氯仿、乙醇、四氯化碳、乙酸乙酯;不溶于水。
作为硫化剂,可以部分或全部取代硫黄,可用于NRL。
在NR中用量为0.75~2Pr。
在NRL中为1.8~2.2Pr。
易分散,硫化胶有良好力学性能,耐热,耐老化,压缩永久变形小。
3)三硫化双(二乙基硫代磷酰)Bis(diethyl thiophosphoryl)trisulphide结构式:S S S PPS S OOOOAcAc AcAc特点:溶于甲醇、丙酮、乙酸乙酯、石油醚、甲苯;不溶于水。
可以部分或全部取代硫黄;易分散;适用于高温硫化注模和连续硫化。
硫化胶力学性能良好,压缩永久变形小,耐热,耐老化。
4)一氯化硫Sulfur monochlorideCl S S Cl结构式:特点:有毒,有刺激性。
NR、合成橡胶及胶乳用硫化剂,不适用于氯丁橡胶。
可直接加入橡胶及胶乳中,特别适用于硫化胶乳及薄片模型橡胶制品,也可以用于自硫化胶浆。
5)二氯化硫Sulfur dichlorideCl S Cl结构式:特点:有毒,有氯臭,遇水易分解。
NR、合成橡胶及胶乳用硫化剂,不适用于氯丁橡胶。
可直接加入橡胶及胶乳中,特别适用于硫化胶乳及薄片模型橡胶制品,也可以用于自硫化胶浆。
6)烷基苯酚硫化物Alkyphenoldisulfide特点:可作天然胶或合成胶制品给硫体类硫化剂。
含有活性硫,在受热状态下可对橡胶起硫化作用,与胶料相容性好,硫化胶不喷霜,拉伸强度高,并具有优良耐热性能。

《含硫化合物之间的转化》知识清单一、含硫化合物的种类含硫化合物在我们的生活和自然界中广泛存在,种类繁多。
常见的含硫化合物包括硫化氢(H₂S)、二氧化硫(SO₂)、三氧化硫(SO₃)、硫酸(H₂SO₄)、亚硫酸(H₂SO₃)、硫酸盐(如硫酸钠 Na₂SO₄、硫酸钡 BaSO₄等)、硫化物(如硫化钠 Na₂S、硫化亚铁 FeS 等)。
二、含硫化合物之间的转化关系1、硫化氢与二氧化硫硫化氢具有还原性,二氧化硫具有氧化性,二者可以发生氧化还原反应。
化学方程式为:2H₂S + SO₂=3S↓+ 2H₂O。
在这个反应中,硫化氢被氧化为硫单质,二氧化硫被还原为硫单质。
2、二氧化硫与三氧化硫二氧化硫在一定条件下(如催化剂、加热)可以被氧化为三氧化硫。
化学方程式为:2SO₂+ O₂⇌ 2SO₃。
这是一个可逆反应,三氧化硫在同样条件下也可以分解为二氧化硫和氧气。
3、二氧化硫与亚硫酸二氧化硫溶于水生成亚硫酸,化学方程式为:SO₂+ H₂O ⇌H₂SO₃。
亚硫酸不稳定,容易分解为二氧化硫和水。
4、亚硫酸与硫酸亚硫酸具有较强的还原性,可以被氧化剂(如氧气、过氧化氢等)氧化为硫酸。
例如,2H₂SO₃+ O₂= 2H₂SO₄。
5、硫酸盐与硫化物在一定条件下,硫酸盐可以被还原为硫化物。
例如,在高温和还原剂(如碳)的作用下,硫酸钠可以转化为硫化钠:Na₂SO₄+ 4C ⇌Na₂S +4CO↑。
三、含硫化合物之间转化的条件1、温度许多含硫化合物之间的转化反应需要在特定的温度条件下进行。
例如,二氧化硫转化为三氧化硫通常需要较高的温度,并在催化剂的存在下才能更有效地进行。
2、催化剂催化剂在含硫化合物的转化中起着重要的作用。
如二氧化硫氧化为三氧化硫的反应中,常用的催化剂是五氧化二钒(V₂O₅),它能显著提高反应的速率和转化率。
3、氧化剂和还原剂氧化还原反应是含硫化合物转化的重要类型,这就需要有合适的氧化剂或还原剂参与。
比如,硫化氢转化为二氧化硫需要氧化剂,而亚硫酸转化为硫酸则需要更强的氧化剂。

《含硫化合物之间的转化》知识清单一、含硫化合物的种类含硫化合物种类繁多,在我们的日常生活和工业生产中都有着广泛的应用和影响。
常见的含硫化合物包括硫化氢(H₂S)、二氧化硫(SO₂)、三氧化硫(SO₃)、硫酸(H₂SO₄)、亚硫酸(H₂SO₃)、硫单质(S)等。
硫化氢是一种具有臭鸡蛋气味的剧毒气体,通常由一些微生物在缺氧条件下分解含硫有机物产生。
二氧化硫则是一种常见的大气污染物,主要来源于化石燃料的燃烧,如煤、石油等。
三氧化硫是二氧化硫进一步氧化的产物,它与水反应可以生成硫酸。
硫酸是一种重要的工业原料,具有强酸性和强腐蚀性。
亚硫酸是一种不稳定的中强酸,容易被氧化为硫酸。
硫单质在自然界中以多种形式存在,如单质硫、硫化物矿石等。
二、含硫化合物之间的转化关系1、硫单质的转化硫单质可以在一定条件下与氧气反应生成二氧化硫:S + O₂==点燃== SO₂二氧化硫在催化剂的作用下与氧气进一步反应生成三氧化硫:2SO₂+ O₂<==催化剂,加热==> 2SO₃2、二氧化硫的转化二氧化硫与水反应生成亚硫酸:SO₂+ H₂O ⇌ H₂SO₃亚硫酸在空气中容易被氧化为硫酸:2H₂SO₃+ O₂= 2H₂SO₄3、硫化氢的转化硫化氢在空气中燃烧可以生成二氧化硫和水:2H₂S + 3O₂==点燃== 2SO₂+ 2H₂O若氧气不足,则生成硫单质和水:2H₂S + O₂==点燃== 2S +2H₂O4、硫酸的转化浓硫酸具有强氧化性,在加热条件下可以与铜反应生成硫酸铜、二氧化硫和水:Cu + 2H₂SO₄(浓) ==△== CuSO₄+ SO₂↑ +2H₂O三、含硫化合物转化的条件含硫化合物之间的转化往往需要一定的条件,如反应温度、催化剂、反应物的浓度等。
例如,二氧化硫转化为三氧化硫需要在催化剂(如五氧化二钒)和高温的条件下进行。
而硫化氢燃烧生成二氧化硫或硫单质则取决于氧气的供应量。
四、含硫化合物转化的应用1、工业生产含硫化合物之间的转化在工业生产中有着重要的应用。
含硫化合物知识点总结初中含硫化合物是化学中重要的一类化合物,它们在日常生活和工业生产中具有广泛的应用。
本文将对初中生所需了解的含硫化合物的知识点进行总结。
一、含硫化合物的基本概念含硫化合物是指化学式中含有硫原子的化合物。
硫是一种常见的非金属元素,具有特殊的化学性质。
通过与其他元素的结合,硫可以形成多种化合物。
常见的含硫化合物有硫化氢、硫酸、硫酸铜等。
二、硫化氢的性质和用途硫化氢(H2S)是一种无色、刺激性气味的气体。
它是硫化物最简单的化合物,具有剧烈的毒性。
硫化氢可用于检测金属离子的存在,也可以作为某些化学反应的催化剂。
然而,由于其毒性,使用时需格外小心。
三、硫酸的性质和用途硫酸(H2SO4)是一种无色、具有强烈腐蚀性的液体。
它是一种重要的化工原料,广泛应用于冶金、制药、电子等行业。
硫酸还可用于制备其他含硫化合物,如硫酸铜。
四、硫酸铜的性质和用途硫酸铜(CuSO4)是一种蓝色结晶固体,具有良好的溶解性。
硫酸铜可用作防腐剂、杀菌剂和催化剂。
此外,硫酸铜还可用于制备其他铜化合物,如碳酸铜。
五、硫化物的存在形式和来源硫化物可以以固体、气体或液体的形式存在。
在自然界中,含硫矿石是硫化物的重要来源。
人类通过采矿和冶炼将硫化物提取出来,并将其用于各种工业生产和科学研究中。
六、含硫化合物的环境影响含硫化合物对环境有一定的影响。
例如,硫化合物的氧化物在大气中形成硫酸和硫酸盐,其中一些会以酸雨的形式降落到地表,对生态系统和建筑物造成损害。
此外,含硫化合物的燃烧也会产生有害的气体和颗粒物。
七、安全使用含硫化合物的注意事项在使用含硫化合物时,需注意以下事项:首先,应在通风良好的环境下操作,以避免有毒气体的积聚。
其次,应佩戴个人防护装备,如手套、护目镜和防护服,以防止物质直接接触皮肤和眼睛。
最后,应遵守相关的安全操作规程,以确保自身和他人的安全。
总结:含硫化合物是化学中重要的一类化合物,初中生需要了解其基本概念、性质和用途。
水体中的含硫化合物全文共四篇示例,供读者参考第一篇示例:水体中含有硫化合物,是由于地下水中的硫化氢、硫酸盐等物质溶解导致的。
这些含硫化合物是地球上常见的无机化合物,对水质和水生生物造成了不良影响。
本文将会探讨水体中含硫化合物的来源、对水质的影响以及处理方法等方面。
水体中的含硫化合物主要来源于地下水中的硫酸盐和硫化氢。
硫酸盐是由硫酸和盐类等物质组成的盐类,其中含有一定量的硫元素。
而硫化氢是一种无色有刺激性气体,通常呈现为硫化氢的离子形式存在在水中。
这些含硫化合物通常通过地下水层的流动,溶解到水体中,造成了水体中的硫化物质浓度升高。
水体中含有过高浓度的硫化物质会对水质造成不良影响。
硫化物质会使水体呈现出一种刺鼻的恶臭味道,对人体健康和生活环境造成不良影响。
硫化物质还会影响水体中的溶解氧含量,导致水体缺氧,对水生生物的生长和繁殖造成危害。
硫化物质还会与其他有机物质产生化学反应,形成二次污染物,影响水体的整体水质。
针对水体中含硫化合物的问题,可以采取一些有效的处理方法。
可以通过生物法,即利用特定的微生物对硫化物质进行降解。
这种方法不仅能够有效地去除水体中的硫化物质,还能够提高水体中的溶解氧含量,改善水质状况。
可以采用物理法,如通过氧化还原反应或化学沉淀法等手段去除水体中的含硫化合物。
这种方法相对简便,但效果可能不如生物法明显。
水体中含硫化合物是一种常见的水质污染物,对水体和水生生物造成了不良影响。
为了保护水资源和维护生态平衡,我们应当采取有效的措施,去除水体中的含硫化合物,提高水质标准。
也需要加强对水质监测和管理,及时发现并解决水体中的含硫化物质污染问题,保护水资源的可持续利用。
【本文共计XX字】。
第二篇示例:水体是地球上最重要的资源之一,无论对于生物还是人类生活,都有着不可或缺的重要性。
在我们环境中还存在着一些不利于水质的因素,其中包括含有硫化合物的污染物。
硫化合物是一类含有硫元素的化合物,可能对水体产生不利影响。
硫醇硫醇是一类通式为R-SH的化合物,其中-SH称巯基。
低级的硫醇有强烈且令人讨厌的气味,但臭味随碳数增多而减弱,高级硫醇具有令人愉快的气味。
它们是醇的含硫对应化合物,但相比之下,硫醇的酸性和亲核性更强,更易被氧化。
在空气、碘、氧化铁、二氧化锰等弱氧化剂作用下,硫醇氧化得到二硫化物:2R-SH -[O]→ R-S-S-R + H2O 。
金属锂在液氨中,以及氢化铝锂或锌加酸都可使二硫化物还原为硫醇/硫酚。
硫醇与二硫化物互相转化的氧化还原反应是生物体内常见现象之一,半胱氨酸经氧化转化为胱氨酸即是一例。
二硫化物中含有的二硫键(-S-S-)是维持蛋白质空间结构的重要化学键之一。
强氧化剂(如高锰酸钾、硝酸、高碘酸)作用下,硫醇氧化经过中间产物次磺酸、亚磺酸,最终得到磺酸。
催化加氢条件下,硫醇失硫生成相应的烃。
工业上,因为硫会使一般的催化剂(如雷尼镍)中毒,这一步脱硫常在二硫化钼或二硫化钨等含硫催化剂的作用下进行,一个例子是由噻吩催化加氢制取四氢噻吩。
硫醇与羧酸反应成硫醇酯,与醛生成缩硫醛,与酮生成缩硫酮。
后两个反应一般用于羰基的保护,保护基缩硫醛/酮具有特殊有用的极性翻转性质。
硫醚硫醚是一类通式为R-S-R的化合物。
相比醚,硫醚中的C-S键键能较低,容易断裂,有时可以形成稳定的含硫自由基。
硫原子含有两对孤对电子,具亲核性和碱性,可与浓硫酸或卤代烷成锍盐。
锍盐经氢氧化银和水作用转化为氢氧化三烷基锍,有强碱性,加热分解为硫醚和烯烃。
硫醚也可被多种氧化剂(如过氧化氢)氧化,中间产物是亚砜,最终产物是砜。
高碘酸和间氯过氧苯甲酸可使氧化反应停留在亚砜的阶段。
此外,催化加氢也可使硫醚中的C-S键断裂,生成烷烃。
亚砜、砜亚砜和砜是通式分别为R-S(=O)-R和R-S(=O)2-R的化合物。
硫原子为sp杂化态,S=O键为强极性键,硫带部分正电荷,氧带部分负电荷,具亲核性。
α-氢具酸性。
两个烃基不同的亚砜有手性,有些可以被拆分出来。
含硫化合物1 硫化合物硫化合物是包含硫键的化合物,由一个硫原子和另一个原子组成,形成单原子硫键。
硫在其六个电子结构中一共具有六种氧化物形式,其中四种形式有二原子硫键,被称为二价硫化合物。
它们是:硫氧化物(SO)、硫氯化物(SCl2)、硫硝酸盐(SNO2)和硫酸盐(SO3)。
2 分子结构硫氧化物,也称硫醚、二甲基硫醚或瑞士醚,是最重要的二价硫化合物。
它的分子结构由两个硫原子和一个氧原子组成,在分子中形成四元环。
硫氯化物,也被称为正磷硫醚,它的分子结构也由两个硫原子和一个氯原子组成,形成三元环。
硫硝酸盐比硫氯化物更脆弱,它的分子结构由两个硫原子和两个氧原子组成,形成了二元环。
最后,硫酸盐的分子结构由三个硫原子和三个氧原子组成,也形成了四元环。
3 生物作用二价硫化合物几乎可以在所有生物系统和环境中找到,它们的生物学作用也不容忽视。
硫氧化物作为一种能够改善水质的抗氧化剂,可以被用来净化水体,使蓝藻去除和盐析出更有效。
硫氯化物可以有效抵抗病原体,防止感染,而且还可以促进植物的光合作用,增加养份而提高产量。
此外,硫仍是人体免疫系统的重要组成成分,人体的一些重要细胞和酶都包含了硫化合物。
4 环境影响硫化合物也可以通过工业废水排放造成环境污染,其中醋酸硫酸盐产生的废水硫挥发性最大。
废水中含有高浓度的硫化合物将可能引起水和空气污染,例如导致地表水酸化,硝酸盐污染,大气酸雨和硫化氢致病毒性事件。
此外,汽车尾气和低温时发电站放出的低温排风也排放了大量的硫化合物和硫酸盐,从而对大气造成很大的污染。
定期监测气体排放中的硫氧化物含量,减少硫化合物对环境的污染,对保护环境极为重要。
因此,硫化合物是至关重要的,既可以是生物体的重要成分,也可以在一定范围内有效地提高水质,但如果排放过多,就会造成环境污染。
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。