第五章离子聚合高分子化学
- 格式:ppt
- 大小:458.50 KB
- 文档页数:27

浙江大学材化学院高分子化学公式推导第一章绪论(Introduction)(1)分子量的计算公式:M0:重复单元数的分子量M1:结构单元数的分子量(2)数均分子量:N1,N2…N i分别是分子量为M1,M2…M i的聚合物分子的分子数。
x i表示相应的分子所占的数量分数。
(3)重均分子量:m1,m2…m i分别是分子量为M1,M2…M i的聚合物分子的重量W i表示相应的分子所占的重量分数(4)Z均分子量:(5)粘均分子量:α:高分子稀溶液特性粘度—分子量关系式中的指数,一般在 0.5~0.9之间(6)分布指数:分布指数第二章自由基聚合(Free-Radical Polymerization)(1)引发剂分解动力学:引发剂的分解速率:引发剂的浓度引发剂分解一般属于一级反应,因而分解速率为的一次方。
将上式积分得:进而得到半衰期(引发剂分解至起始浓度一半时所需的时间)对应半衰期时:,由前面的推导有:半衰期(2)自由基聚合微观动力学链引发速率:链增长速率:链终止速率:式中:kd、kp、kt分别为引发、增长及终止速率常数;[M]为体系中单体总浓度;为体系中活性种(自由基)的总浓度;f为引发剂效率。
推导如下:链引发反应由以下两个基元反应组成:式中:为初级自由基;为单体自由基。
若第二步的反应速率远大于第一步反应(一般均满足此假设),有:引入引发剂效率后,得引发速率的计算式如下:一般用单体的消失速率来表示链增长速率,即:链增长反应如下式:引入自由基聚合动力学中的第一个假定:等活性理论,即链自由基的活性与链长基本无关,即各步速率常数相等,kp1=kp2=kp3=…kp x=kp推得:自由基聚合一般以双基终止为主要的终止方式,在不考虑链转移反应的情况下,终止反应方程式如下:偶合终止:歧化终止:终止总速率:式中:Rtc为偶合终止速率;Rtd为歧化终止速率;Rt为总终止速率;ktc、ktd、kt为相应的速率常数。
在以上公式的基础上,引入处理自由基动力学的三个假设,得到以单体消耗速率表示的总聚合速率,其计算公式为:以及单体浓度随时间的变化关系为:若引发剂浓度可视为常数,则上式还原为:以上公式推导如下:自由基浓度较难测定,也很难定量化,因而无实用价值,引入处理自由基动力学的第二个假定——稳态假定,假定体系中自由基浓度在经过一段很短的时间后保持一个恒定值,或者说引发速率和终止速率相等, Ri=Rt即:解出:再引入处理自由基动力学的第三个假定:大分子的聚合度很大,用于引发的单体远少于增长消耗的单体, Ri <<Rp由此,用单体消失速率来表示的聚合总速率就等于链增长速率代入引发速率的表达式得:代入引发剂浓度随时间的变化关系得到:积分得:两边同时变号当引发剂的浓度可看作常数时即:即:此时:可略去高阶无穷小量得:(3)动力学链长及平均聚合度1)不考虑链转移反应自由基聚合过程中双基终止有两种方式,一种为双基偶合终止,另一种为双基歧化终止,二者所占的分率的不同将会引起平均聚合度的改变,但两种终止方式不会改变动力学链长的大小,二者的计算公式为:式中:Rtc为双基偶合终止的反应速率;Rtd为双基歧化终止的反应速率;Rp为链增长速率。

高分子化学中聚合度的计算1、自由基聚合2、自由基共聚3、乳液聚合4、阳离子聚合5、阴离子聚合6、线形缩聚(一)线型缩聚动力学:(1)不可逆条件下a 、自催化聚合(无外加酸)积分得: p t 22p R k 2]M [k =ντν]M [k p =Xn 1=k P k t [M]+C M +C S [M][S]]C []M [n n ]M []M [n X ==-NN X 0n =大分子数结构单元数目=3kC dt dC =-t k 2C 1C 1202=-由C = Co (1-P),代入上式b 、外加酸催化积分得:将 C = Co (1-P ) 代入上式(2)平衡条件下a 、水未排出时(密闭体系)根据反应程度关系式0N N 1P -=2C `k dt dC =-t `k C 1C 10=-1t C `k P 110+=-1t C `k X 0n +=()2121C 1k C k dtdC ----=1C 1C C C N N N P 0000---===P1C -=∴所以正、逆反应达到平衡时,总聚合速率为零,则解得b 、水部分排出时(非密闭体系)根据反应程度关系式所以平衡时()[]K P P 1k dt dP 221--=()0K P P 122=--()0K KP 2P 1K 2=+--1K K 1K K K P +==--1K 1K K 11P 11X n +===+--()W 121n C 1k C k dt dC ----=1C 1C C C N N N P 0000---===P 1C -=∴()[]K n P P 1k dt dP w 21--=()K n P P 1W 2=-当 P 趋近于1 ( > 0.99)时(二)线形缩聚物聚合度的控制(端基封锁)(1)单体aAa 和bBb 反应,其中bBb 稍过量a 、当原料单体官能团等摩尔比时,即 r = 1 或 q = 0b 、当P =1时,即官能团a 完全反应(其中 ,称为摩尔系数; ,称为bBb 单体的分子过量分率, )(2)aAa 、bBb 等摩尔比,另加少量单官能团物质CbW n P K P 11Xn =-= ∴)P 1(2q 2q P r 2r 1r 12/)P N 2N N (2/)N N (X a b a b a n -++-++-++===()P 11P 122X n --==q 21q 2r 1r 1X n ≈=+=+-()()P N N N 2N N 2P N N N N N X a c a c a a c a c a n -++-++==()()rP2r 1r 1P N 2N 2N N N 2N N a c a a c a a -++-++++==1<=b a N N r r r 1N N N 2/N 2/)N N (q a a b a a b ---===1q 1r += ∴(其中, )(3)aRb 加少量单官能团物质Cb(分子数为Nc )反应(其中, )7、体型缩聚Carothers 理论c a a N N N r 2+=a c a c N N 22N N q ==1q 1r +=()()P r r r P N N N N N P N N N N N X a c a c a a c a c a n 21122-++===-++-++c a a 'N N N r 2+=1q 1r +=)(=nX 11f 2P -f P 22X n -=。

高分子化学聚合方法1.高分子化学聚合方法是通过将单体分子连接起来形成高分子链的过程。
在高分子化学中,聚合是一种重要的方法,用于合成具有特定性质和功能的高分子材料。
本文将介绍几种常见的高分子化学聚合方法。
2. 自由基聚合自由基聚合是一种常见的聚合方法,其中自由基起到连接单体以形成高分子链的作用。
这种聚合方法通常需要一个引发剂来生成自由基。
引发剂的种类非常多,常见的有过氧化物、硫醇和光敏引发剂等。
自由基聚合的优点是反应条件温和、反应速率较快,适用于多种单体。
3. 阳离子聚合阳离子聚合是另一种常用的聚合方法,其中阳离子起到连接单体的作用。
这种聚合方法需要在反应体系中加入一个酸性催化剂,以形成阳离子。
阳离子聚合通常适用于带有活泼亲电基团的单体,如环氧树脂和乳液聚合物。
4. 阴离子聚合阴离子聚合是一种通过阴离子的连接作用来形成高分子链的聚合方法。
这种聚合方法通常需要在反应体系中加入碱性催化剂,以形成阴离子。
阴离子聚合适用于带有活泼亲核基团的单体,如丙烯酸和乙烯基醚。
5. 双键聚合双键聚合是一种通过双键的共轭作用来形成高分子链的聚合方法。
这种聚合方法适用于具有共轭结构的单体,如聚合物太阳能电池和有机发光二极管。
6. 离子共聚合离子共聚合是一种将阳离子和阴离子进行聚合的方法。
这种聚合方法可以用于合成具有特殊性质的高分子材料,如离子交换树脂和水凝胶。
7. 环氧树脂聚合环氧树脂聚合是一种通过环氧基团的开环反应形成高分子链的聚合方法。
环氧树脂聚合常用于涂料、黏合剂和复合材料的制备中。
8. 聚合反应控制在高分子化学聚合方法中,精确控制反应的条件和参数对于获得理想的高分子材料至关重要。
常见的聚合反应控制方法包括温度控制、引发剂用量控制和反应时间控制等。
9. 应用领域高分子化学聚合方法在许多领域都有广泛的应用。
例如,它们可以用于合成高分子材料,如塑料、纤维和弹性体等。
此外,高分子化学聚合方法还可以用于制备功能性高分子材料,如药物递送系统、聚合物光学材料和生物医学材料等。

高分子化学中的聚合机理分析高分子化学是研究高分子化合物的构造、性质和合成方法的学科。
高分子物质具有重复单元的特点,当这些单元通过化学反应结合在一起时,就形成了高分子链。
这种化学反应,即聚合反应,是高分子化学中的核心问题。
聚合机理是聚合反应发生的过程和方式的科学描述,对于理解聚合反应机制和控制聚合反应的参数具有重要意义。
一、自由基聚合机理自由基聚合是目前工业上最常用的聚合方法,其聚合机理是指具有自由基互相结合形成键的聚合反应。
自由基聚合反应主要包括三个步骤:起始反应、传递反应和终止反应。
聚合物的分子量主要受到起始剂和链转移剂的影响。
起始反应是聚合反应的第一步,通常采用过氧化物、单质或光敏剂来引发。
比较常用的过氧化物有过氧化苯乙酮和二异丙基过氧化物等。
在光敏剂引发聚合过程中,通常还需要添加光引发剂或有机过氧化物。
起始剂在高分子化学领域中起到引发反应的作用。
传递反应是两个自由基互相交换氢原子而形成稳定的双自由基,通常采用共溶剂或者链传递剂来促进。
传递反应有助于实现分子量的控制,从而使聚合物的结构得以控制。
终止反应是指自由基引发聚合反应的一种反应终止方式。
终止方式有两种:1、交叉联系,即形成交联聚合物;2、自由基自身相遇,形成中间物并快速终止聚合反应。
终止反应的方式直接影响高分子的分子量分布和结构。
二、离子聚合机理离子聚合是指离子引发反应的聚合方法。
常用的离子聚合反应有阴离子聚合和阳离子聚合两种方式。
离子聚合反应通常需要引入引发剂,通过引入离子源来生成离子中间体。
阴离子聚合反应通常采用亲核取代反应中的亲核试剂作为引发剂。
当亲核试剂被引发剂引发后,会生成阴离子中间体,阴离子中间体通过聚合反应快速生成高分子聚合物。
阳离子聚合反应通常采用质子酸作为引发剂,产生阳离子中间体。
与阴离子聚合反应类似,阳离子通过质子酸引发后,会生成阳离子中间体,进而快速形成高分子聚合物。
离子聚合反应具有选择性和准确性,因此常被用于制备精细聚合物和高性能材料。

第一章绪论(Introduction)(1)分子量的计算公式:M0:重复单元数的分子量M1:结构单元数的分子量(2)数均分子量:N1,N2…N i分别是分子量为M1,M2…M i的聚合物分子的分子数。
x i表示相应的分子所占的数量分数。
(3)重均分子量:m1,m2…m i分别是分子量为M1,M2…M i的聚合物分子的重量W i表示相应的分子所占的重量分数(4)Z均分子量:(5)粘均分子量:α:高分子稀溶液特性粘度—分子量关系式中的指数,一般在0.5~0.9之间(6)分布指数:分布指数第二章自由基聚合(Free-Radical Polymerization)(1)引发剂分解动力学:引发剂的分解速率:引发剂的浓度引发剂分解一般属于一级反应,因而分解速率为的一次方。
将上式积分得:进而得到半衰期(引发剂分解至起始浓度一半时所需的时间)对应半衰期时:,由前面的推导有:半衰期(2)自由基聚合微观动力学链引发速率:链增长速率:链终止速率:式中:kd、kp、kt分别为引发、增长及终止速率常数;[M]为体系中单体总浓度;为体系中活性种(自由基)的总浓度;f为引发剂效率。
推导如下:链引发反应由以下两个基元反应组成:式中:为初级自由基;为单体自由基。
若第二步的反应速率远大于第一步反应(一般均满足此假设),有:引入引发剂效率后,得引发速率的计算式如下:一般用单体的消失速率来表示链增长速率,即:链增长反应如下式:引入自由基聚合动力学中的第一个假定:等活性理论,即链自由基的活性与链长基本无关,即各步速率常数相等,kp1=kp2=kp3=…kp x=kp推得:自由基聚合一般以双基终止为主要的终止方式,在不考虑链转移反应的情况下,终止反应方程式如下:偶合终止:歧化终止:终止总速率:式中:Rtc为偶合终止速率;Rtd为歧化终止速率;Rt为总终止速率;ktc、ktd、kt为相应的速率常数。
在以上公式的基础上,引入处理自由基动力学的三个假设,得到以单体消耗速率表示的总聚合速率,其计算公式为:以及单体浓度随时间的变化关系为:若引发剂浓度可视为常数,则上式还原为:以上公式推导如下:自由基浓度较难测定,也很难定量化,因而无实用价值,引入处理自由基动力学的第二个假定——稳态假定,假定体系中自由基浓度在经过一段很短的时间后保持一个恒定值,或者说引发速率和终止速率相等,Ri=Rt即:解出:再引入处理自由基动力学的第三个假定:大分子的聚合度很大,用于引发的单体远少于增长消耗的单体,Ri <<Rp由此,用单体消失速率来表示的聚合总速率就等于链增长速率代入引发速率的表达式得:代入引发剂浓度随时间的变化关系得到:积分得:两边同时变号当引发剂的浓度可看作常数时即:即:此时:可略去高阶无穷小量得:(3)动力学链长及平均聚合度1)不考虑链转移反应自由基聚合过程中双基终止有两种方式,一种为双基偶合终止,另一种为双基歧化终止,二者所占的分率的不同将会引起平均聚合度的改变,但两种终止方式不会改变动力学链长的大小,二者的计算公式为:式中:Rtc为双基偶合终止的反应速率;Rtd为双基歧化终止的反应速率;Rp为链增长速率。

离子聚合的聚合方法离子聚合是一种重要的化学反应过程,通过离子间的相互吸引和结合,将带电离子聚集成大分子结构。
在化学领域中,离子聚合被广泛应用于合成高分子材料、药物输送系统、生物传感器等领域。
离子聚合的聚合方法多样,根据离子的性质和反应条件的不同,可以选择合适的方法进行聚合反应。
1. 离子交联聚合离子交联聚合是一种常见的离子聚合方法。
在该方法中,通常先合成含有带电离子基团的单体,如带正电荷的氨基甲酸乙酯(AMPS)或带负电荷的丙烯酸钠(SA)。
然后,通过交联剂将这些带电离子基团连接在一起,形成三维网状结构,从而实现离子聚合反应。
2. 离子自组装聚合离子自组装聚合是一种利用离子间的自组装作用形成多层结构的方法。
在这种方法中,通常利用带正电荷和带负电荷的离子通过静电吸引力相互作用,形成多层的堆积结构。
这种离子自组装聚合方法不仅可以改善材料的性能,还可以调控材料的形貌和结构。
3. 离子稀释聚合离子稀释聚合是一种通过在反应体系中引入具有相同电荷的离子来降低离子浓度的方法。
在离子稀释聚合中,可以使用盐类或离子交换剂来稀释带电离子,减少带电离子之间的相互排斥作用,从而促进离子的聚合过程。
4. 离子引发聚合离子引发聚合是利用离子引发剂引发的聚合反应。
在这种方法中,离子引发剂能够引发单体分子之间的共聚反应,形成带电离子聚合体。
离子引发聚合方法对反应条件要求严格,需要选择适当的引发剂和反应条件以确保聚合反应的进行。
通过以上几种离子聚合的聚合方法,可以实现对带电离子的高效聚合反应,形成具有特定功能和结构的高分子材料。
离子聚合技术的应用不仅可以拓展高分子材料的应用领域,还可以为材料科学、生物医药等领域提供更多的创新解决方案。


第一章绪论1.单体:能够形成高分子化合物中结构单元的小分子化合物。
2.高分子:由许多结构相同的简单的单元通过共价键重复连接而成的相对分子质量很大的化合物,也称聚合物或高聚物。
3.结构单元:高分子中多次重复的并且可以表明合成所用单体种类的化学结构。
4.重复单元:在聚合物的大分子链上重复出现的,组成相同的最小基本单元。
5.单体单元:聚合物中具有与单体相同化学组成而不同电子结构的单元。
6.聚合度:衡量聚合物分子大小的指标。
以重复单元数为基准,即聚合物大分子链上所含重复单元数目的平均值,以DP表示。
以结构单元数为基准即聚合物大分子链上所含结构单元数目的平均值,以Xn表示。
7.碳链聚合物:大分子主链完全由碳原子组成的聚合物。
8.杂链聚合物:聚合物大分子的主链中除了含有碳原子外,还含有氧,氮等杂原子。
9.元素有机聚合物:聚合物的大分子主链中没有碳原子存在,又要由硅,硼,铝和氧,氮,硫,磷等原子组成。
10.无机高分子:主链与侧链均无碳原子的高分子。
第二章缩聚和逐步聚合1.均缩聚:由一种单体进行的缩聚反应。
2.混缩聚:由两种均不能独自缩聚的单体进行的缩聚反应。
3.共缩聚:在均缩聚中加入第二单体或混缩聚中加入第三,第四种单体进行的缩聚反应。
4.官能度:一分子中能参与的官能团数称为官能度。
5.平均官能度:指反应体系中平均每一分子上带有的能参加反应的官能团数目。
6.过量分率:线型缩聚中某一单体过量的摩尔分率。
7.反应程度:参加反应的官能团数占起始官能团数的分率。
8.凝胶点:开始出现凝胶瞬间的临界反应程度Pc。
9.熔融缩聚:指反应温度高于单体和缩聚物的熔点,反应体系处于熔融状态下进行的反应。
10.溶液缩聚:单体加适当催化剂在溶剂中呈溶液状态下进行的缩聚叫做溶液缩聚。
11.界面缩聚:两单体分别溶解于两互不溶的溶剂中,反应在两相界面上进行的缩聚反应,具有明显的表面反应的特性。
第三章自由基聚合1.活性种:打开单体的π键,使链引发和增长的物质,活性种可以是自由基,阴离子或阳离子。
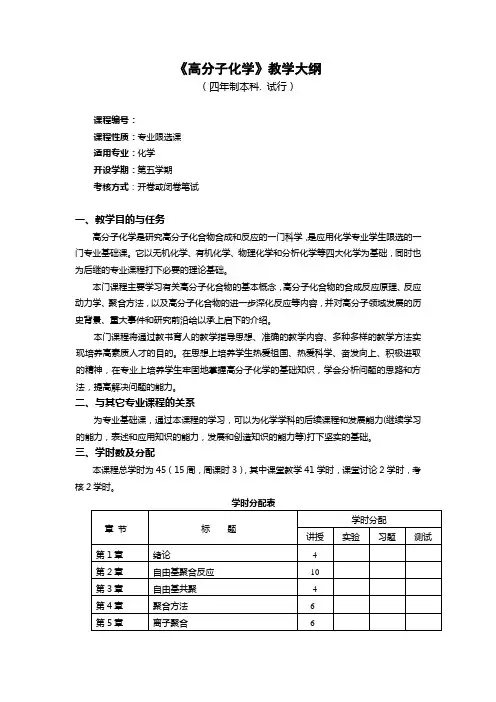
《高分子化学》教学大纲(四年制本科. 试行)课程编号:课程性质:专业限选课适用专业:化学开设学期:第五学期考核方式:开卷或闭卷笔试一、教学目的与任务高分子化学是研究高分子化合物合成和反应的一门科学,是应用化学专业学生限选的一门专业基础课。
它以无机化学、有机化学、物理化学和分析化学等四大化学为基础,同时也为后继的专业课程打下必要的理论基础。
本门课程主要学习有关高分子化合物的基本概念,高分子化合物的合成反应原理、反应动力学、聚合方法,以及高分子化合物的进一步深化反应等内容,并对高分子领域发展的历史背景、重大事件和研究前沿给以承上启下的介绍。
本门课程将通过教书育人的教学指导思想、准确的教学内容、多种多样的教学方法实现培养高素质人才的目的。
在思想上培养学生热爱祖国、热爱科学、奋发向上、积极进取的精神,在专业上培养学生牢固地掌握高分子化学的基础知识,学会分析问题的思路和方法,提高解决问题的能力。
二、与其它专业课程的关系为专业基础课,通过本课程的学习,可以为化学学科的后续课程和发展能力(继续学习的能力,表述和应用知识的能力,发展和创造知识的能力等)打下坚实的基础。
三、学时数及分配本课程总学时为45(15周,周课时3),其中课堂教学41学时,课堂讨论2学时,考核2学时。
四、讲授内容与要求:(分章节)本大纲根据教育部理科化学教学指导委员会“理科应用化学专业化学教学基本内容”,以四年制本科人才培养规格为目标,按照高分子化学学科的理论知识体系,提出了具体的教学要求。
第一章绪论(4学时)【教学要求】1、了解聚合物的物理状态和主要性能;2、了解高分子科学及其工业发展历史和前景;3、掌握高分子化合物的基本概念、分类及命名原则;4、掌握聚合物的平均分子量、分子量分布、大分子微结构等基本概念。
【教学内容】1、高分子化合物的基本概念、分类及命名原则;2、聚合物的平均分子量、分子量分布、大分子微结构等基本概念,3、聚合物的物理状态和主要性能;高分子科学及其工业发展历史和前景。

聚合方法一、解释下列名词:1、乳液聚合:单体在乳化剂作用下以乳液状态分散在反应介质中而进行的聚合反应。
2、胶束:乳化剂分子在介质中达到饱和溶解度后,就会产生数十个或数百个乳化剂分子的聚集体,这种聚集体被称作胶束。
3、临界胶束浓度:出现胶束时乳化剂浓度,称为临界胶束浓度,用CMC表示。
4、乳液聚合中的均相成核:水相生成的初级自由基首先引发溶于水相中的单体而形成短链自由基,短链自由基在吸附了乳化剂后得以稳定存在,成为单体可以扩散进去继续聚合的乳胶粒,这一过程被称为均相成核。
5、胶束成核:在乳液聚合反应中,对于水溶性小的单体,是通过自由基扩散进入胶束内引发单体聚合,使胶束变成乳胶粒子,这一过程叫胶束成核。
6、三相平衡点:乳化剂处于分子溶液、胶束和凝聚三相平衡状态时的温度称为三相平衡点。
8、界面聚合:两种单体分别溶解在两种互不相溶的介质中,聚合反应只能在两相的界面发生,故称界面聚合。
例如,把二酰氯溶于氯仿,把二胺溶于水中,混合后就可以发生界面聚合,在界面上生成聚合物。
二、选择题:1.能够提高聚合速率而不降低聚合度的方法是:A、本体聚合B、∨乳液聚合C、悬浮聚合D、溶液聚合(Page117:采用乳液聚合可以通过增加乳胶粒的方法同时提高聚合反应速率和聚合度。
聚合速率快、聚合度高是乳液聚合不同与其它聚合方法的一个显著特征。
)2.在低转化率时就能获得高分子量聚合物的方法是:A、熔融缩聚B、溶液缩聚C、∨界面缩聚D、固相缩聚3、当乳液聚合反应进入第二阶段后,若补加一定量的引发剂,将会出现:A、聚合速率增大B、∨聚合速率不变C、聚合物分子量增大D、聚合物分子量不变(乳液聚合的第二阶段是恒速期;第一阶段加速期;第三阶段降速期)4、合成橡胶通常采用乳液聚合反应,主要是因为乳液聚合:A、以水作介质价廉无污染B、散热容易C、∨易获得高分子量聚合物D、不易发生凝胶效应5、在缩聚反应中界面缩聚的最突出优点是:A、反应温度低B、反应速度快C、∨低转化率下获得高分子量聚合物D、当量比要求严格6、若在乳液聚合反应到达恒速阶段后提高反应温度,将会出现:A、∨聚合速率不变,分子量下降B、聚合速率增加,分子量下降C、聚合速率和分子量不变D、聚合速率增加,分子量不变7、乳液聚合和悬浮聚合都是将单体分散在水相中,但聚合机理却不同,这是因为:A、∨聚合场所不同所致B、聚合温度不同所致C、搅拌速度不同所致D、分散剂不同所致8、在乳液聚合反应速率和时间的关系曲线上,一般存在加速、恒速和降速三个阶段,出现恒速和降速这一转变时,不同单体的转化率不同,其中转化率最高的单体是:A、乙酸乙烯酯B、甲基丙烯酸甲酯C、丁二烯D、∨氯乙烯9、丁苯橡胶的工业合成常采用:A)溶液聚合方法B)∨乳液聚合C)悬浮聚合D)本体聚合10、自由基本体聚合反应时,会出现凝胶效应,而离子聚合反应则不会,原因在于:A)链增长方式不同B)引发反应方式不同C)聚合温度不同D)∨终止反应方式不同11、乳液聚合反应进入恒速阶段的标志是:A、单体液滴全部消失B、体系粘度恒定C、胶束全部消失D、引发剂消耗掉一半12、同时获得高聚合速率和高分子量的聚合方法是:A、溶液聚合B、悬浮聚合C、乳液聚合D、本体聚合三、问答题1.苯乙烯本体聚合的工业生产分两个阶段。

一、选择题1.一种自修复材料在外力破坏后能够复原,其结构简式(图1)和修复原理(图2)如图所示,下列说法错误的是A.该高分子可通过加聚反应合成B.使用该材料时应避免接触强酸或强碱C.合成该高分子的两种单体含有相同的官能团D.自修复过程中“-COOCH2CH2CH2CH3”基团之间形成了化学键答案:D解析:A.该高分子化合物是加聚反应产物,所以该高分子化合物可以通过加聚反应得到,故A正确;B.该高分子化合物中含有酯基,所以能和酸、碱反应,故B正确;C.合成该高分子化合物的单体分别为CH2=C(CH3)COOCH3、CH2=CHCOOCH2CH2CH2CH3,官能团相同,故C正确;D.自修复过程中“-COOCH2CH2CH2CH3”基团之间没有形成化学键,故D错误;故选:D。
2.山梨酸是一种高效安全的防腐保鲜剂。
其合成路线如图所示,下列说法正确的是A.反应1属于加聚反应B.根据溴水是否褪色可以鉴别巴豆醛和山梨酸C.聚酯不能使酸性高锰酸钾褪色D.聚酯中存在1个手性碳原子(注:连有四个不同的原子或基团的碳称为手性碳)答案:A解析:A.反应1没有小分子物质生成,属于加聚反应,故A正确;B.巴豆醛、山梨酸都含有碳碳双键,都可以和溴水发生加成反应而褪色,用溴水不能鉴别二者,故B错误;C.聚酯中含碳碳双键、能使酸性高锰酸钾褪色,故C错误;D.聚酯中每1个链节存在1个手性碳原子,含n个手性碳原子,故D错误;答案选A。
3.化学与生产、生活、科技、环境等密切相关。
下列说法正确的是A.我国自主研发的“龙芯4000系列”CPU芯片与光导纤维是同种材料B.“复兴号”高铁车厢连接处使用的增强聚四氟乙烯板属于有机高分子材料C.古人煮沸海水制取淡水,现代可通过向海水加入明矾实现海水淡化D.用75%的医用酒精杀死新型冠状病毒,是利用了酒精的强氧化性答案:B解析:A.我国自主研发的“龙芯4000系列”CPU芯片的主要成分是硅,光导纤维主要是二氧化硅制成的,A不正确;B.聚四氟乙烯板是以四氟乙烯为原料,通过加聚反应制成的材料,聚四氟乙烯板属于有机高分子材料,B正确;C.向海水中加入明矾,主要是为了利用明矾中Al3+水解生成的氢氧化铝胶体的吸附能力,将海水中的悬浊物沉降,但不能实现海水中可溶性盐的脱除,无法实现淡化,C不正确;D.用75%的医用酒精杀死新型冠状病毒,是利用了酒精能使蛋白质变性的性质,D不正确;故选B。
第五章配位聚合第五章配位聚合第五章配位聚合习题参考答案1.举例说明聚合物的异构现象,如何评价聚合物的立构规整性?答疑:(1)聚合物的异构现象:①结构异构聚合物,例如共聚甲基丙烯酸甲酯与聚丙烯酸乙酯:ch3|-[-ch2-c-]n--[-ch2-ch-]n-||co2ch3co2c2h5共聚甲基丙烯酸甲酯聚丙烯酸乙酯②几何异构聚合物,汉分子链中由于双键或环形结构上取代基在空间排列方式不同造成的立体异构称作几何异构,也表示承-反异构。
例如丁二烯生成所构成的1,4-聚丁二烯,其结构单元存有双键结构和反式结构两种:~~~ch2ch2~~~~~~ch2hc=cc=chhhch2~~~双键结构(顺-1,4聚丁二烯)反式结构(反-1,4聚丁二烯)③光学异构聚合物,如聚环氧丙烷有一个真正的手性碳原子:h|~~~o-c*-ch2~~~|ch3④构象异构聚合物,当大分子链中原子或原子团拖单键民主自由转动所占有的特定空间边线或单键连接的分子链单元的相对位置的改变称构象异构。
构象异构可以通过单键的旋转而互相转换。
(2)当大分子链上大部分结构单元(大于75%)就是同一种立体构型时,指该大分子为存有规立构聚合物,或立构规整聚合物、定向聚合物。
反之,称作无规立构聚合物。
2.写出下列单体聚合后可能出现的立构规整聚合物的结构式及名称:(1)ch2=ch-ch3(2)ch2-ch-ch3o(3)ch2=ch-ch=ch2ch3|(4)ch2=c-ch=ch2答疑:(1)聚丙烯hhhhhrhrhhhhhrrhhhhhhrhrhhhhhrrh全同聚丙烯(r为甲基)间同聚丙烯(r为甲基)(2)聚环氧丙烷hhhhhhhhoooohch3hch3hch3hch全规共聚环氧丙烷间规聚环氧丙烷hch3hhhch3hhoooohhhch3hhhch(3)丁二烯~~~ch2ch2~~~~~~ch2hc=cc=chh顺式结构(顺-1,4聚丁二烯)hhhhrhhhrhhhrhhr全同1,2-聚丁二烯(r为乙烯基)(4)异戊二烯~~~ch2ch2~~~c=cch3h双键结构(顺-1,4共聚异戊二烯)hhhhhrhhrhhhrhhr全同3,4-聚异戊二烯(r为-c(ch3)=ch2)hchhhch3rhh3rchhh3chrh3r全同1,2-聚异戊二烯(r乙烯基)hch2~~~反式结构(反-1,4聚丁二烯)hhhhrrhhhhhhrrhh间同1,2-聚丁二烯(r 为乙烯基)~~~ch2hc=cch3ch2~~~反式结构(反-1,4聚异戊二烯)hhhhrrhhhhhhrrhh3,4-共聚异戊二烯(r为-c(ch3)=ch2)chhhh3rrchhchhh3h3rrhch3间同3,4-聚异戊二烯(r为乙烯基)间同3.什么就是配位聚合?主要存有几类催化剂(或引起剂),各存有什么特点?答疑:(1)配位聚合:是指单体分子的碳-碳双键先在显正电性的低价态过渡金属的空位上配位,形成某种形式的络合物(常称σ-π络合物),经过四元环过渡态,随后单体分子插入过渡金属-碳键中进行增长的聚合过程。
高分子化学英文名称:Polymer Chemistry一. 课程的性质、目的及任务高分子化学是高分子材料与工程专业的专业基础课,本课程是研究高聚物的各种合成方法和化学反应机理的学科。
目的是使学生熟知高分子的基本概念,掌握合成高聚物的单体、引发剂及合成高聚物的方法及实施方法,掌握合成高聚物的反应动力学及分子量控制的基本理论,培养学生初步具有控制聚合反应和选择聚合方法的能力,结合平行课程的学习,初步掌握结构与性能的关系,可进行分子的设计与合成,同时了解本学科方向一些有意义的新动向。
为后修的《高聚物合成工艺学》、《高分子材料学》和《功能高分子》等专业课程打好理论基础。
学生通过本课程的学习,毕业后可以胜任在相关科研单位及企业从事高分子的合成与开发工作。
二. 课程教学基本要求(1)掌握高分子化学中的基本概念和研究范围(2)深入了解化学反应的基本原理、反应动力学和分子量的控制方法(3)掌握常见高分子合成的基本实施方法(4)了解分子设计与合成的基本原理和高分子化学的发展方向三. 课程教学基本内容第一章绪论1.1 高分子化学简史1.2 高分子的基本概1.3 聚合物的分类与命名1.4 聚合反应1.5 分子量1.6 线型、支链型和体型大分子1.7 大分子微结构1.8 聚合物的物理状态和主要性能1.9 聚合物材料和机械强度第二章自由基聚合反应2.1 自由基聚合的单体2.2 自由基聚合机理2.3 引发剂和引发作用2.4 自由基聚合反应速率2.5 分子量和链转移反应2.6 阻聚和缓聚作用2.7 影响聚合反应速率及分子量的因素(分子量分布的概念)2.8 聚合反应速率常数的测定2.9 聚合动力学第三章自由基共聚合3.1 共聚合的类型及研究意义3.2 二元共聚物的组成3.3竟聚率的测定及影响因素3.4 单体和自由基的活性3.5 Q—e概念3.6 多元共聚第四章聚合方法4.1 本体聚合4.2 溶液聚合4.3 悬浮聚合4.4 乳液聚合第五章离子聚合5.1 阳离子聚合5.2 阴离子聚合5.3 自由基聚合与离子聚合的比较5.4 离子型共聚合5.5 离子型开环聚合第六章配位离子聚合6.1 配位离子聚合概述6.2 聚合物的立体异构现象6.3 Ziegler—Natta引发体系6.4 α—烯烃的配位阴离子聚合6.5 双金属活性中心模型和单金属活性中心模型6.6 二烯烃的配位离子聚合第七章逐步聚合反应7.1 概述7.2缩聚反应7.3 线性缩聚反应的机理7.4 线性缩聚动力学7.5 影响线性缩聚物聚合度的因素和控制方法7.6 分子量分布7.7 逐步聚合方法7.8 体型缩聚7.9 凝胶化作用和凝胶点第八章聚合物的化学反应8.1 聚合物侧基官能团反应的特征8.2 聚合物的相似转变8.3 聚合物的接枝交联和扩链反应8.4 功能高分子8.5 聚合物的降解反应及老化高分子化学实验实验课程编号实验课程名称中文高分子化学实验英文Polymer Chemistry Experiments实验课程基本情况课程总学分1开设实验项目数9个其中:必修(8)个,选修(3)课程总学时30实验总学时30先修课程高分子化学、高分子物理适用专业高分子材料与工程实验教学目标(通过开设本实验课程,所要达到的基本目的):高分子化学实验是在学生学完高分子化学的基本理论之后,进行的一门实验课程。