(完整版)NF-kb信号通路
- 格式:doc
- 大小:28.51 KB
- 文档页数:6

nfkb通路相关蛋白NF-κB(核因子激活的B细胞的κ-轻链增强)是一种蛋白质复合物,其控制转录的DNA,细胞因子产生和细胞存活。
NF-κB几乎存在于所有动物细胞类型中,并参与细胞对刺激的反应,如应激,细胞因子,自由基,重金属,紫外线照射,氧化LDL和细菌或病毒抗原。
NF-κB在调节对感染的免疫应答中起关键作用。
NF-κB的不正确调节与癌症,炎症和自身免疫疾病,感染性休克,病毒感染和免疫发育不当有关。
NF-κB也与突触可塑性和记忆过程有关。
产品简介NF-κB由Ranjan Sen(NIH)在诺贝尔奖获得者David Baltimore的实验室中通过其与B细胞中免疫球蛋白轻链增强子中的II碱基对序列的相互作用而发现。
核因子-kB(NF-kB),是细胞内重要的核转录因子。
它参与机体的炎症反应、免疫应答,能调节细胞凋亡、应激反应,NF-kB过度激活,与人类许多疾病如类风湿关节炎、心脏与脑部疾病的炎症变化等相关,因此通过药物来抑制NF-kB信号转导通路,可能会成为治疗的手段。
NF-kB分子的N端含Rel同源域,参与其和DNA结合、参与二聚体化,能被NF-kB 抑制物(TeB)结合、抑制;NF-kB分子内还有核输出域、核定位域、转位活性域等,C 端有反式转录激活域。
p50/p65NF-KB能与靶基因启动子免疫球蛋白k轻链基因转录增强序列(kB序列)特异结合。
RelA/c-Rel二聚体,能与靶基因启动子其他序列结合。
NF-kB家族有5个成员,包括NF-kB1(p50)、NF-kB2(p52)、RelA(p65)、RelB和c-Rel,通常所说的NF-kB蛋白,是指p65/p50亚单位形成的NF-KB1二聚体蛋白;RelB/p52亚单位形成NF-kB2二聚体蛋白。
NF-kB可分两组:p50/p52组,分别由pII0、p105前体裂解产生,p50/p52能与NF-kB家族其他成员形成二聚体,存留于胞质。
RelA(p65),RelB和cRel一组,没有前体。

NF-κB通路是一种重要的信号转导通路,可以被激活以应对细胞内外的各种压力和刺激,从而调节炎症反应、免疫应答、细胞增殖和细胞凋亡等生物学过程。
而非长链编码RNA(lncRNA)在这一过程中也扮演着重要的角色。
本文将围绕着NF-κB通路和非长链编码RNA展开深入探讨,并按照深度和广度的要求进行全面评估。
1. NF-κB通路的基本概念NF-κB是核因子-κB的简称,它是一类可以调节基因转录的转录因子家族。
在非激活状态下,NF-κB被抑制子IκB结合而保持在细胞质中。
当受到刺激时,IκB被降解,NF-κB得以释放并转位至细胞核,激活相关基因的转录,从而调节炎症反应、免疫细胞的活化及细胞凋亡等生理过程。
2. 非长链编码RNA的作用机制非长链编码RNA是一种长度超过200个核苷酸的RNA分子,虽然在基因组中占据很大的比例,但其功能仍然鲜为人知。
近年来的研究表明,lncRNA参与了许多生物学过程,包括染色质修饰、转录调控、细胞分化和肿瘤发生等。
在NF-κB通路中,lncRNA可以通过调控相关基因的表达、介导信号传导以及参与蛋白复合物的装配等方式发挥作用。
3. NF-κB通路和非长链编码RNA的相互调控关系在细胞的生物学过程中,NF-κB通路和非长链编码RNA之间存在着复杂的相互调控关系。
NF-κB通路可以调节一些lncRNA的表达,例如通过结合到lncRNA的启动子区域或增强子区域来激活或抑制其转录。
另一些lncRNA也可以影响NF-κB通路的激活和信号传导,例如通过促进或抑制IκB的降解,调节NF-κB的核转位以及与NF-κB蛋白的相互作用等途径。
4. 个人观点和理解在我看来,NF-κB通路和非长链编码RNA的相互调控关系是一个非常值得深入研究的领域。
通过深入了解它们之间的相互作用机制,我们可以更好地理解生物学过程中的调控网络,为新药的研发和治疗疾病提供更多的靶点和策略。
我也认为在未来的研究中,结合生物信息学、分子生物学和细胞生物学等多个学科的方法进行综合分析是非常重要的,这将有助于我们更全面地揭示NF-κB通路和非长链编码RNA之间的交互网络。

万方数据 万方数据 万方数据丝篁塑量壁鎏!Q堕堡i旦箜!鲞箜!塑』坐虫坐垡丛堡!虫望塑i!些!鱼塑:也堡!塑!!y堂!:盟!:;到显著抑制,而共转染RcCMV.1nBa.SR细胞内HBV复制中间体DNA的水平得到上调(图2A),检测细胞上清液中的HBeAg和HBsAg也得到了相同的结果(结果未在本文显示)。
免疫荧光结果也显示,单独表达MyD88可明显抑制HBVcore蛋白的合成;而kBa—SR与MyD88共表达后core蛋白在细胞中的表达量可显著增加(图2B)。
以上结果说明,NF.s:B活化被阻断后MyD88抑制HBV复制的效应也得到抑制,进一步提示MyD88抑制HBV复制中的作用依赖于NF—xB信号通路的活化。
A畿∞£确S《蠢6。
螂㈨j.芒羞4.00E+03£8蚕2.00E+03pemv3J(oatoM归∞(o.4t,O脑轴R蝴髑堆哼w蝌稍《卜D螃E乒毛吐(0.憾lqO+Bo-02图2阻断NF-r。
B信号通路对nyI粥8抑制HBV效应的影响rig2.BlockageofNF-r。
BactivationabolishesMyD68mediatedsuppressionofHBVA:BlockageofNF—KBactivationabolishesMyD88mediatedsuppressionofparticle—associatedHBVreplicativeintermediateDNA.B:BlockageofNF-·cBactivationabolishesMyD88mediatedsuppressionofprotein.3.活化NF.s:B信号通路可抑制HBV的复制和表达为进一步探讨单独活化NF.tcB信号通路对HBV复制的影响,将HBV的复制型质粒pHBV3.8与空载或不同剂量的NF.fcB激活剂pRc—G.actin.3HA.IⅪ血/IK邸共转染Huh7细胞,检测上清液中HBsAg和HBeAg的表达水平以及细胞内HBV复制中问体DNA的水平。

nfkb信号通路转录因子The NF-κB signaling pathway plays a pivotal role in regulating cellular responses to a wide range of stimuli, including stress, inflammation, and immune responses. At the heart of this pathway lies the transcription factor NF-κB, which, in its inactive form, is sequestered in the cytoplasm by inhibitory proteins known as IκBs. Upon activation by various stimuli, the IκB kinase (IKK) complex is triggered, leading to the phosphorylation and subsequent degradation of IκBs. This liberation allow s NF-κB to translocate to the nucleus, where it binds to specific DNA sequences and regulates the expression of genes involved in immune and inflammatory responses.NF-κB信号通路在调节细胞对各种刺激的反应中起着关键作用,这些刺激包括压力、炎症和免疫反应等。
这一通路的核心是转录因子NF-κB。
在静息状态下,NF-κB与其抑制蛋白IκBs结合,被滞留在细胞质中。
当受到各种刺激时,IκB激酶(IKK)复合物被激活,导致IκBs的磷酸化和随后的降解。

nfkb信号通路的转录因子The NF-κB signaling pathway is a crucial regulatory mechanism in cellular responses to various stimuli, including inflammation, immune response, and cell survival. At the core of this pathway lies the transcription factor NF-κB, which plays a pivotal role in gene expression modulation. NF-κB is typically held inactive in the cytoplasm by inhibitor proteins known as IκBs. Upon activation, these inhibitors are degraded, allowing NF-κB to translocate to the nucleus and regulate the transcription of target genes.NF-κB信号通路是细胞对各种刺激(包括炎症、免疫反应和细胞存活)作出反应的关键调节机制。
该通路的核心是转录因子NF-κB,它在基因表达调控中起着至关重要的作用。
NF-κB通常被细胞质中的抑制蛋白IκBs所束缚,处于非活跃状态。
一旦被激活,这些抑制蛋白会被降解,从而允许NF-κB进入细胞核,并调控目标基因的转录。
The regulation of NF-κB activity is highly complex and involves multiple layers of control. One key aspect is the phosphorylation of IκB proteins by the IκB kinase (IKK) complex, which triggers their ubiquitination and subsequent degradation by the proteasome. This phosphorylation event is triggered by upstream signaling events, such as the activation of Toll-like receptors or cytokine receptors.NF-κB活性的调节机制非常复杂,涉及多个层面的控制。
NF-κB信号通路在细胞生物学和免疫学中起着非常重要的作用,其主要的生物学效应包括:
1. 调节细胞增殖和分化:NF-κB信号通路可以通过激活或抑制某些基因的表达来调节细胞增殖和分化。
例如,NF-κB可以促进细胞增殖和细胞周期进展,同时也可以抑制细胞凋亡和分化。
2. 调节细胞凋亡:NF-κB信号通路可以通过调节细胞凋亡相关基因的表达来影响细胞凋亡。
例如,NF-κB可以抑制细胞凋亡蛋白Bcl-2的表达,从而促进细胞凋亡。
3. 调节炎症反应:NF-κB信号通路可以通过调节炎症相关基因的表达来影响炎症反应。
例如,NF-κB可以促进炎症介质的合成和释放,从而引起炎症反应。
4. 调节免疫反应:NF-κB信号通路可以通过调节免疫相关基因的表达来影响免疫反应。
例如,NF-κB可以促进免疫细胞的增殖和活化,同时也可以抑制免疫细胞的凋亡和分化。
5. 调节细胞周期和细胞凋亡:NF-κB信号通路还可以通过调节细胞周期和细胞凋亡相关基因的表达来影响这些过程。
例如,NF-κB可以促进细胞周期蛋白的合成和释放,从而影响细胞周期进程;同时也可以抑制细胞凋亡蛋白的表达,从而影响细胞凋亡。
总之,NF-κB信号通路在细胞生物学和免疫学中扮演着重要的调节作用,其失调可能导致多种疾病的发生和发展。
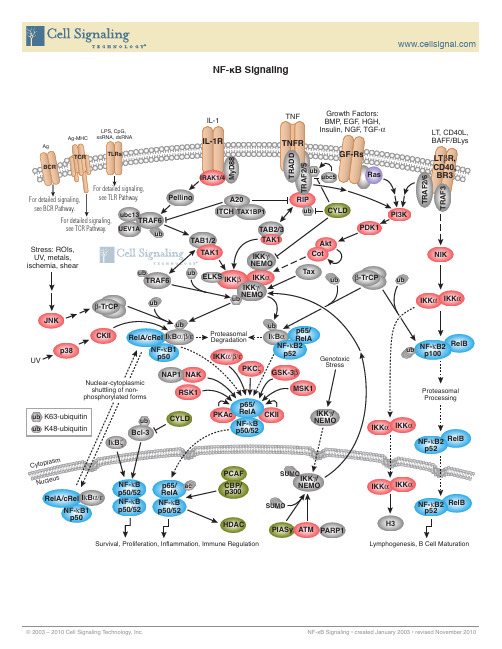
NF-KB与微循环障碍核因子-KB(nuclear factor-kappa B,NF-KB)•蛋白家族是一种多效性的转录因子,可以与多种基启动子部位的KB位点发生特异性的结合从而促进其转录表达。
其受氧化应激、细菌脂多糖,细胞因子等多种刺激而活化后,能调控前炎症性细胞因子、细胞表面受体、转录因子、粘附分子等的生成。
而这些刺激因素及其调控的因子与微循环障碍的发生、发展均有着密切的关系。
本文就NF-KB的组成结构,•活化调节及与微循环障碍的关系等方面做一综述,以期从一新的角度阐述微循环障碍发生的机制及改善的途径。
1.NF-KB的概述1.1 NF-KB/Rel蛋白家族及结构1986年,Sen 等首次从鼠B淋巴细胞核提取物中,发现一种能与免疫球蛋白K轻链基因增强子KB序列(GGGACTTTCC)特异结合,调节其基因表达的核蛋白因子,•称之为NF-KB。
随后大量的研究又陆续发现了NF-KB•家族的其它成员,•其构成亚基分别是NF-•KB1 (P50)、NF-KB2(P52)、P65(RelA)、c-Rel(Rel)、RelB等,因这些亚基的N-末端均崐有约300个氨基酸残基的Rel同源区(rel homology domain ,RHD)•,•故统称为NF-KB/Rel蛋白家族。
其RHD内含DNA 结合区,二聚体化区和核定位序列,分别具有与DNA KB序列结合、与同源或异源亚基二聚体化以及与NF-KB抑制蛋白(IKB)家族成员相互作用并携带核定位信号(NLS),参与活化的NF-KB由细胞质向细胞核的迅速移动等功能。
又根据结构、功能和合成方式的不同,Rel蛋白分为两类。
•一类为P50(•NF-•KB1)和P52(•NF-•KB2),•分别由含有C-末端锚蛋白重复序列(ahkrin ••repeat motif)的前体蛋白p105和p100通过ATP依赖蛋白水解过程裂解而形成。
该类蛋白含有RHD,但缺乏转录活性区,无独立激活基因转录的功能。
另一类为p65(RelA),Rel(c-Rel),Rel B和果蝇的dorsal、Dif和Relish,它们没有前体,除N端的RHD外,•其C-端有一个或多个转录活性区,具有直接作用转录设备而激活基因转录的功能。
Rel蛋白成员间可形成多种形式的同源或异源二聚体,•如p50/RelA、•p50/p50、RelA/Rel等,但并不是都可构成二聚体,如RelB只能与p50或p52二聚体化,•而不能构成同源二聚体。
Rel间的二聚化作用是其与DNA结合的特性所决定的,因为KB位点为二元对称结构,二聚体中的每一成员只与半个识别序列发生作用。
而且不同的NF-KB/Rel•蛋白二聚体具有不同的结合序列(KB位点),因而具有各自的特性。
如NF-KB的KB序列为十聚体的5'-GGGRNNYYCC-3',而p65/c-Rel二聚体的KB序列为十聚体的5'-HGGARNYYCC-3',(H代表A,C或T,R代表嘌呤,Y代表嘧啶)。
这样保证了NF-KB/Rel•家族对基因调控的特异性,这种特异性还与细胞类型、亚细胞结构定位、相互作用的IKB•类型及激活的方式等有关。
通常所指的NF-KB的组成为p50/p65异源二聚体,其几乎存在于体内所有细胞,且含量常常最高。
除RHD外,其组分p50有很少其它序列,而P65则有250个氨基酸残基的C-未端,内含2-3•个独立的转录活性区,有增强靶基因转录激活的作用,而且p65的另一个重要功能是与IKB成员直接偶然。
其他的同源或异源二聚体的核因子-KB在体内含量极少,但可能对某些特定的启动子有独特和重要的作用。
Lehming等报道存在于淋巴细胞中p50同源二聚体能以结构型与DNA链KB序列结合,对转录起抑制作用。
讫今为止的体内外实验发现NF-KB/Rel蛋白复合物大多以这样有二种类型存在于胞浆中:同源或异源二聚体与IKB蛋白家族构成的三聚体;Rel蛋白(如p65•)与未裂解的前体(如p105)组成的二聚体。
信号转导可诱导IKB•和p105•磷酸化而降解,•从而使NF-KB活化再由胞浆转核而发挥效应。
1.2 IBK家族IKB蛋白家族成员有IKBα(MAD-3,pp40)、IKBβ、IKBγ/p105、IKBδ/p100、IKBε、Bcl-3以及果蝇属的Cactus等。
•其家族结构特点是均有多个约33•个氨基酸的重复序列,•称为崐SWI6/锚蛋白重复序列,主要参与与Rel蛋白的RHD相互作用。
IKB•蛋白主要有以下三个部分构成:1.与蛋白降解有关的N-末端区;2.能与NF-KB•相互作用的内部区(区内含有锚蛋白重复序列);3.称为PEST的C•-端区,•主要参与“囚禁”NF-KB在细胞浆中。
1.2.1 IKBα,IKBβ主要与含有p65和c-•Rel•的二聚体具有高亲和力,•与其它Rel蛋白亲和力低,是体内NF-KB(p50-p65)的主要调控抑制蛋白。
IKB•α的基因启动子上有KB位点,故其合成也受到NF-KB的调控,因此形成对NF-KB的负反馈调节。
IKBβ则无这种机制。
这种调节差异可致NF-KB 调控的靶基因的表达表现在时间上和水平上的差异。
1.2.2 IKBγ, IKBδ作为p50和p52蛋白前体的p105和p100,由于在结构上有能与RHD相互作用锚蛋白的重复序列,在功能上有类于NF-KB抑制剂的作用,因此将之归于IKB•家族,•称为p105/IKB γ,p100/IKBδ。
例如:p105既含有在N-未端区的p50,又含有3-4•个锚蛋白重复序列的C-未端区,因而它既能掩蔽p65、c-Rel,又可以通过蛋白水解释放出p50。
1.2.3 IKBε,Bcl-3 IKBε主要与p65发生抑制作用,专一性地与p65和c-•Rel结合,与IKBα具有多方面的共同特性。
Bcl-3位于胞核,虽然表现出能抑制含有p50•的二聚体,但与p52在DNA上结合后却发挥了转录共激活的功能。
1.3 NF-KB的活化信号转导途径非活化状态的NF-KB以与IKB聚合的三聚体形式或与前体蛋白聚合的二聚体的形式存在于细胞浆中,在多种因素的刺激作用下,通过多种信号转导途径使IKB磷酸化,再在蛋白水解酶作用下发生降解,从而使NF-KB得以活化而转核发挥其调控作用。
•这个过程大致分三部分:1.3.1刺激因素的信号转导:多种因素如细胞因子(TNF-α、IL-1β、IL-2)、病毒(流感病毒、•鼻病毒)、双链ANA、氧化剂、细菌脂多糖、多种抗原及紫外线照射等均是NF-KB活化的刺激信号,能通过多种不同的信号转导途径,由胞外向胞内传递,使NIK(NF-KB-inducing kinase)或活化途径中的其它激酶激活,而致NF-KB的活化。
Cao等提出IL-1的活化途径是:IL-1与胞膜上的IL-1受体(IL-1R)识别结合后,IL-1R胞浆内组份立即与IL-1R辅助蛋白(IL-1R accessory protein,IL-RAcP)联结,IL-1RAcP再聚集活化一种接合体蛋白髓细胞样分化蛋白(Myeloid differentiation protein MyD88),MyD88再聚集两种丝氨酸/苏氨酸激酶:IL-1受体活化激酶(IL-1 •receptor-•activated •kinase IRAK)•和IRAK2而共同形成受体复合体。
IRAK、IRAK2又随后又跟一种接合体分子TNF•受体结合因子6(TNF receptor-associated factor 6,TRAF6)相互作用。
TRAF-6使IRKA、IRAK2•与NF-KB诱导激酶(NF-KB-inducing kinase NIK)相联结,NIK被激活。
zhang等则通过实验证明,LPS与其受体结合后要通过IL-1的浆内信号介导途径激活NIK.从而活化NF-KB的。
而Takeuchi等揭示TNF•激活NIK•是通过TNF•受体、TNF受体结合死亡区•(TNF •reeeptor •associated •death •domain,TRADD)、TRAF2及丝氨酸/苏氨酸激酶RIP的过程。
双链DNA(double-stranded DNA,dsDNA)和佛波酯(PMA)则分别通过dsDNA依赖的蛋白激酶(dsDNA-dependent•protein kinase, PKR)和PKC、丝裂原激活蛋白激酶(MAPK-PP90rsk)来使IKB 磷酸化。
1.3.2 IKB的磷酸化及降解NIK属于丝裂原激活蛋白激酶MAPKKK家族的。
NIK活化IKB激酶复合体IKKα、IKKβ, IKK α、IKKβ催化IKB•上Ser32/36磷酸化,•然后IKB•上Lys21/22遍在•蛋白化(ubiquitination),再遍在蛋白连接酶(ubiquitin conjugation enzymes)作用下与蛋白酶小体(proteasome)连接,•在蛋白酶小体作用下IKB降解,NF-KB活化。
1.3.3 NF-KB核转位及调控基因表达。
IKB降解后,暴露NF-KB上的核定位信号,NF-KB迅速发生转核,与调控基因启动子上的KB 位点结合,启动基因转录。
2.NF-KB在微循环障碍发生发展中的作用。
NF-KB•活化后能调控一系列基因的表达:如粘附分子家族的细胞间粘附分子-1•(intercellular adhesion nolecule-1,ICAM-1)、•血管细胞粘附分子-1(•vascullar cell adhesion molecule-1,VCAM-1)、E-•选择素(E-•selectin)•、•p-•选择素(P-selectin)前炎症性细胞因子TNF-α、IL-1β、IL-2、IL-6,化学趋化因子单核细胞趋化蛋白-1(Monocyte chemoattoactant protein-1,MCP-1)、IL-8•以及一些受体分子IL-2受体、T细胞受体α、β链,等等。
•而这些物质都能直接或间接地作用于微血管内皮细胞或血细胞或者介导它们之间的相互作用,从而导致微循环障碍。
2.1 NF-KB介导的微管内皮细胞的损伤。
2.1.1炎症性浸润引发的损伤已知ICAM-1基因启动子上有1个基本的NF-KB位点,VCAM-1基因有2个NF-KB位点,E-sel基因有3个NF-KB位点。
在TNF、IL-1、LPS•及活性氧作用下,能在30min内使NF-KB活化升高,并且持续很长时间,•然后单独或与其它因子协同作用下,使ICAM-1、VCAM-1、E-sel在2-4小时内表达增加,6-12小时内达到峰值,而且其表达升高与刺激物质呈时间、剂量依赖的方式。
不同途径抑制NF-KB•的活化或清除刺激来源后,均能相应地抑制这种活化和表达。