注射用奥拉西坦-11-药品标准草案及起草说明
- 格式:doc
- 大小:48.00 KB
- 文档页数:6
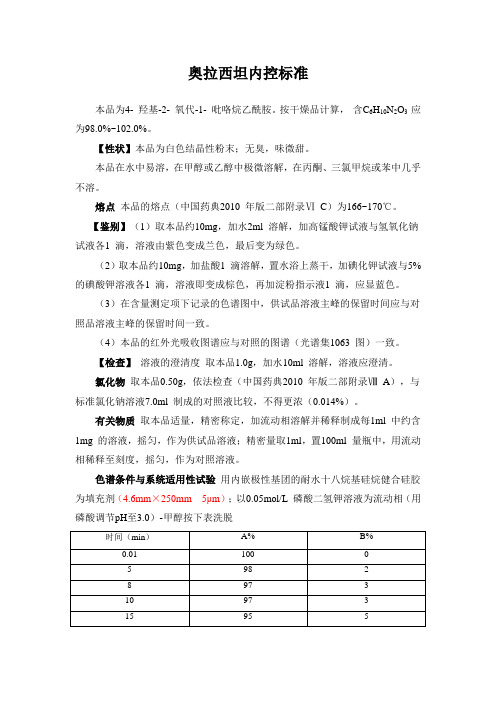
奥拉西坦内控标准本品为4- 羟基-2- 氧代-1- 吡咯烷乙酰胺。
按干燥品计算,含C6H10N2O3 应为98.0%~102.0%。
【性状】本品为白色结晶性粉末;无臭,味微甜。
本品在水中易溶,在甲醇或乙醇中极微溶解,在丙酮、三氯甲烷或苯中几乎不溶。
熔点本品的熔点(中国药典2010 年版二部附录ⅥC)为166~170℃。
【鉴别】(1)取本品约10mg,加水2ml 溶解,加高锰酸钾试液与氢氧化钠试液各1 滴,溶液由紫色变成兰色,最后变为绿色。
(2)取本品约10mg,加盐酸1 滴溶解,置水浴上蒸干,加碘化钾试液与5%的碘酸钾溶液各1 滴,溶液即变成棕色,再加淀粉指示液1 滴,应显蓝色。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)本品的红外光吸收图谱应与对照的图谱(光谱集1063 图)一致。
【检查】溶液的澄清度取本品1.0g,加水10ml 溶解,溶液应澄清。
氯化物取本品0.50g,依法检查(中国药典2010 年版二部附录ⅧA),与标准氯化钠溶液7.0ml 制成的对照液比较,不得更浓(0.014%)。
有关物质取本品适量,精密称定,加流动相溶解并稀释制成每1ml 中约含1mg 的溶液,摇匀,作为供试品溶液;精密量取1ml,置100ml 量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
色谱条件与系统适用性试验用内嵌极性基团的耐水十八烷基硅烷健合硅胶为填充剂(4.6mm×250mm 5μm);以0.05mol/L 磷酸二氢钾溶液为流动相(用磷酸调节pH至3.0)-甲醇按下表洗脱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。
再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3 倍。
供试品溶液的色谱图中如有杂质峰,奥拉西坦酸(相对保留时间约为1.2)的峰面积不得大于对照溶液主峰面积的0.1倍(0.1%);其他单个杂质峰面积不得大于对照溶液主峰面积的0.05 倍(0.05%);各杂质峰面积的和不得大于对照溶液主峰面积的0.3倍(0.3%)。

奥拉西坦【中文品名】奥拉西坦【药效类别】脑代谢改善药>吡拉西坦类【通用药名】OXIRACETAM【别名】脑复智,奥拉酰胺,4-羟基脑复康, Hydroxypiracetam,Neuromet,Neuracitym,ISF-2522,CT-848【化学名称】l-Pyrrolidineacetamide, 4-hydroxy-2-oxo-【CA登记号】[62613-82-5]【结构式】【分子式】C6H10N2O3【分子量】158.16【收录药典】【开发单位】ISF(意大利)【首次上市】1984,意大利【性状】白色结晶性粉末。
mp165~168℃。
【用途】智能促进药。
可促进磷酰胆碱、磷酰乙醇胺合成和脑代谢,老龄者长期使用,可明显改善组织机能,还可提高有脑血管损伤的老年人的学习效率。
用于治疗老年性脑机能不全性精神综合征及精神行为紊乱和老年性痴呆症。
【推荐合成路线】[1]一、2-(3-乙氧甲酰-4-羟基吡咯烷-2-酮-1-基)乙酸乙酯(3)的制备在反应瓶中,加入亚氨二乙酸乙酯648g(3.43mol),无水二氯甲烷3600ml和三乙胺572ml,于0℃滴加2-乙氧羰基乙酰氯619g(4.11mol)和二氯甲烷1.lL的溶液(内温不超过10~15℃),滴毕,于室温搅拌2h。
反应毕,放置过夜,分出有机层,无水硫酸镁干燥。
过滤,滤液减压回收溶剂,得油状物(2)。
在反应瓶中,加入金属钠75.6g(0.243mol)和无水乙醇2.7L的溶液,于室温下加入上步反应(2)和无水苯1.5L,加热搅拌6h。
反应毕,冷却至室温,用水提取数次,合并水层。
用浓酸调至pH1,过滤,干燥,得粗品(3)。
乙醇重结晶,得(3)。
mp175~179℃。
二、2-(2-吡咯烷-2,4-二酮-1-基)乙酸乙酯(4)的制备在反应瓶中,加入(3)20g(0.077mol),乙腈200ml和水1.8ml,加热搅拌回流20min。
反应毕,分出有机层,水层用乙腈提取数次,合并有机层,无水硫酸钠干燥。

注射用奥拉西坦标准草案及起草说明注射用奥拉西坦Oxiracetam for injectionZhusheyong aolaxitan本品为奥拉西坦无菌冻干粉,含奥拉西坦(C6H10N2O3)应为标示量的90.0~110.0%。
【性状】本品为白色或类白色粉末或疏松状固体。
本品在水中易溶、在甲醇或乙醇中略溶,在丙酮、氯仿或苯中几乎不溶;在氢氧化钠中易溶解。
【鉴别】(1)取本品内容物约10mg,加水2ml溶解,加高锰酸钾试液与氢氧化钠试液各1滴,溶液由紫色变成蓝色,渐变为绿色。
(2) 取本品内容物约10mg,加盐酸1滴溶解,置水浴上加热驱除过剩的盐酸,加碘化钾试液与5%的碘酸钾溶液各1滴,溶液即变成棕色,再加淀粉指示液1滴,应显蓝色。
(3)取本品,加水制成每1ml中含0.1mg的溶液,用有关物质项下的色谱条件进行检测,进样20μl,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)本品的红外光吸收图谱应与对照品的红外光吸收图谱一致(中国药典2005年版二部IV C)。
【检查】酸碱度取本品0.1g,加水10ml,充分振摇,使溶解、滤过,取滤液依法测定(中国药典2005年版二部附录VI C)pH值应为4.5~6.5。
溶液的澄清度与颜色取本品1.0g,加新沸过的冷水10ml溶解后,溶液应澄清。
如显色,与黄色5号标准比色液(中国药典2005年版二部附录IX A第一法)比较,不得更深。
水分取本品,照水分测定法(中国药典2005年版二部附录Ⅷ M 第一法A)测定,含水分不得过2.0%。
有关物质照高效液相色谱法(中国药典2005年版二部附录V D)测定。
色谱条件与系统适用性试验用氰基键合硅胶为填充剂;以甲醇一水(2∶3)为流动相;检验波长为214nm。
理论板数按奥拉西坦峰计算应不低于4000。
测定法取本品,加水制成每1ml中含1.0mg的溶液,作为供试品溶液。
量取适量,加水制成每1ml中含20μg的溶液,作为对照溶液。

奥拉西坦注射液处方工艺改进和稳定性研究发表时间:2017-09-14T11:36:14.237Z 来源:《医药前沿》2017年9月第26期作者:周红霞[导读] 奥拉西坦属于吡咯烷酮类药物,具有改善脑代谢的效果。
(海南皇隆制药股份有限公司海南海口 570311)【摘要】目的:分析奥拉西坦注射液处方工艺改进和稳定性。
方法:选择奥拉西坦200.0g,加入3.45g磷酸二氢钠、0.5g乙二胺四乙酸二钠盐,加入注射水直至1000ml为制造工艺,使用高效液相色谱法对相关物质含量进行测定,实施影响因素实验,加速实验以及长期考察实验,确认其稳定性,实施过敏性实验以及溶血反应实验,评价药物的安全性。
结果:在0.002091~0.189521mg/ml之内,线性关系良好。
样品主峰面积为1378512,RSD=0.14%,12h内稳定性良好。
回收率实验平均回收率为99.51%。
RSD为0.32%。
重复实验证实:样本的平均值为100.8%,RSD为0.39%。
稳定性良好,安全性佳,奥拉西坦不存在溶血和凝集现象,无过敏性。
12mo药品性状,PH值以及有关物质等和0mo无显著差异。
结论:本实验制定的工艺处方安全性强,质量可靠。
稳定性良好,药物安全性高。
【关键词】奥拉西坦注射液;稳定性;质量控制;生产工艺【中图分类号】R94 【文献标识码】A 【文章编号】2095-1752(2017)26-0377-02奥拉西坦属于吡咯烷酮类药物,具有改善脑代谢的效果。
最早由意大利ISF公司合成。
我国在1991年开始研究该药物,并投入生产[1]。
奥拉西坦可以促进磷酰乙醇胺以及磷酰胆碱合成,进而提升大脑对于氧分子和葡糖的利用吸收,改变ATP/ADP比值,提升大脑内蛋白质以及核酸合成量。
这种药物神经毒性低,可以对记忆以及智能障碍者的记忆和学习能力起到改善效果。
由此可见,保证药物安全性,制造出质量过关的药物,有着相当重要的现实意义,结合实际情况,本文现就奥拉西坦注射液处方工艺改进和稳定性展开全面研究,现报告如下。

奥拉西坦注射液药品名称:通用名称:奥拉西坦注射液英文名称:Oxiracetam Injection商品名称:欧兰同成份:奥拉西坦适应症:用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。
规格:5ml:1g静脉滴注。
每日一次,每次4-6g,用前加入到5%葡萄糖注射液或0.9%氯化钠注射液100-250ml中,摇匀后静脉滴注。
可酌情增减用量,用药疗程为2-3周。
国外上市奥拉西坦注射液的用量范围是2-8g,但国内尚无低于4g、高于6g的用药经验。
不良反应:1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻,停药后可自行恢复。
2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差异,未发现严重不良事件。
禁忌:对本品过敏者、严重肾功能损害者禁用。
注意事项:1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
孕妇及哺乳期妇女用药:本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。
儿童用药:尚不明确。
老年用药:Lecaillon JB 等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除半衰期(t 1/2β)较健康青年人延长,曲线下面积(AUC)及血药峰浓度(C max )均略有升高,老年人在使用本品后消除速度稍慢,但与青年人相比无显著性差异。
药物相互作用:尚不明确。
药物过量:在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。
毒理研究:动物研究显示,奥拉西坦小鼠灌胃给药10g/kg 、静注给药2g/kg 和大鼠灌胃给药10g/kg 均未见动物死亡;未见致突变性、致癌作用及生殖毒性。
药理作用:奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。
机理研究结果提示,奥拉西坦可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP 的比值,使大脑中蛋白质和核酸的合成增加。

我院注射用奥拉西坦使用点评与分析余张宁; 黄燕愉; 刘玉珊【期刊名称】《《药品评价》》【年(卷),期】2019(016)016【总页数】2页(P24-25)【关键词】注射用奥拉西坦; 专项点评; 合理用药【作者】余张宁; 黄燕愉; 刘玉珊【作者单位】厦门医学院附属第二医院药学部福建厦门 361021; 厦门市海沧医院药学部福建厦门 361026【正文语种】中文【中图分类】R743.3为规范我院辅助治疗药品的使用,根据我院《辅助治疗药品使用管理制度》,每月对进入药品消耗金额排名前二十位的辅助治疗药品进行专项点评,点评时随机抽取住院病历30份,门急诊处方50张进行点评。
根据《医院处方点评管理规范(试行)》、《处方管理办法》,药品说明书等,对在2017年注射用奥拉西坦进行点评分析,具体情况如下。
1 一般资料利用我院PASS临床药学管理系统提取当月使用注射用奥拉西坦的处方及出院病历,共随机抽取处方431张,病历270份进行点评,利用Excel数据表记录患者住院号/门诊号、年龄、姓名、就诊科室、临床诊断及用药明细等。
2 方法以注射用奥拉西坦说明书、《处方管理办法》及奥拉西坦相关研究文献为参考标准,分析其应用的合理性。
3 结果3.1 科室分布情况注射用奥拉西坦病历/处方科室分布及抽取情况见表1、表2。
3.2 不合理用药情况共抽查270份病历中合理病历共231份,合理率为85.56%;共抽查431张处方中合理用药352张,合理率为81.67%。
不合理用药类型见表3。
表1 使用注射用奥拉西坦病历科室分布(例/%)表2 使用注射用奥拉西坦处方科室分布(例/%)表3 注射用奥拉西坦病历/处方不合理用药类型(例/%)3.3 持续点评情况按照辅助用药规定,连续3个月合格率低于90%的,要停止使用3个月。
以月份为横坐标,当月病历/处方的合理率为纵坐标,使用奥拉西坦的持续点评情况见图1。
图1 奥拉西坦注射液持续点评情况4 讨论4.1 从表1、表2可见,我院注射用奥拉西坦主要在神经内科、神经外科和急诊外科使用,这与药品说明书适应证“用于脑损伤及其引起的神经功能缺失、记忆与智能障碍等症的治疗”相符合,科室分布基本合理。
2016.08药物应用91奥拉西坦注射液的安全性评价李 娥 董润璁 田树红 符 健海南医学院海南省药物安全性评价研究中心 海南省海口市 571101【摘 要】目的:通过试验评价奥拉西坦注射液的安全性,为临床应用提供依据。
方法:奥拉西坦注射液用药毒性,本文通过静脉注射血管刺激性和过敏性试验来评价其安全性。
结果:奥拉西坦注射液注射不引起血管刺激性,亦不引起过敏反应。
结论:实验结果提示奥拉西坦注射液符合静脉注射用药要求。
【关键词】奥拉西坦注射液;安全性评价;静脉注射本品为吡拉西坦的类拟物,属促智药。
可改善记忆与智能障碍症患者的记忆和学习功能。
透过血脑屏障对特异中枢神经道路有刺激作用,提高大脑中ATP/ADP 的比值,促大脑中蛋白质和核酸的合成增加。
动物研究本品急性毒性低,小鼠灌胃给药10 g/kg ,静脉给药2 g/kg 和大鼠灌胃10 g/kg 均未动物死亡;未表现致突变、致癌作用及生殖毒性。
奥拉西坦注射液经静脉给予健康受试者后,在体内的药代动力学符合二室模型,消除半衰期为3小时左右。
奥拉西坦在体内广泛分布,主要以肾脏、肝脏和肺内浓度高。
小鼠口服奥拉西坦后,脑内于4小时可达药物的峰浓度。
药物与血浆白蛋白的结合率低,很少透过胎盘屏障,主要以原形从肾脏排出。
本实验以奥拉西坦注射液为研究对象,考察其制剂安全性,为临床用药提供参考。
1 材料与方法1.1 药品与试剂奥拉西坦注射液,规格:5mL :1.0 g ,批号:120301,由海南合瑞制药股份有限公司提供;平行对照品,规格:5mL :1.0 g ,批号:110903B ,由哈尔滨三联药业有限公司。
1.2 动物新西兰家兔6只,HD 豚鼠36只,由广东省医学实验动物中心提供,动物生产许可证号:SCXK (粤)2008-0002。
1.3 方法1.3.1 奥拉西坦注射液对家兔血管刺激性试验家兔6只,每日每只兔一侧耳缘静脉滴注奥拉西坦注射液7.0 mg/kg ,另一侧滴注等体积的氯化钠注射液,1次/d ,连续3 d ,每天给药前、后对动物和注射部位进行肉眼观察,末次给药后96 h ,处死供试品、平行对照品组各2只家兔,剪取含有血管的耳缘组织,用甲醛固定后进行病理学检查,提供病理照片。
奥拉西坦注射液中奥拉西坦2种含量测定方法的比较
崔巍;李健和;阳巧凤;易利丹;曹俊华
【期刊名称】《中南药学》
【年(卷),期】2010(8)11
【摘要】目的比较奥拉西坦注射液2种不同的含量测定方法。
方法分别采用凯氏定氮法和HPLC法测定奥拉西坦注射液的含量。
结果凯氏定氮法测定的平均回收率为99.6%,RSD为0.3%;HPLC法测定的平均回收率为99.4%,RSD为0.3%,奥拉西坦在0.020 84~0.187 56 mg.mL-1与峰面积呈良好线性关系,r=0.999 96。
结论 2种测定方法的测定结果无明显差异;凯氏定氮测定法方法简便、成本低,但专属性相对较差,可用于常规检查;HPLC法专属性强、灵敏度高、重复性好,为更好的控制样品的质量,可将HPLC法订入质量标准。
【总页数】3页(P845-847)
【关键词】奥拉西坦;高效液相色谱法;凯氏定氮法
【作者】崔巍;李健和;阳巧凤;易利丹;曹俊华
【作者单位】中南大学湘雅二医院药学部;中南大学药学院;湖南省马王堆医院【正文语种】中文
【中图分类】R927.1;R917
【相关文献】
1.奥拉西坦注射液的含量测定方法学研究 [J], 田辉;张明
2.高效液相色谱法测定奥拉西坦注射液中奥拉西坦的含量 [J], 唐燕
3.HPLC法测定奥拉西坦注射液中奥拉西坦的含量 [J], 林冬烜;陈咏昕
4.HPLC法测定奥拉西坦注射液中奥拉西坦的含量 [J], 邵丙侠
5.动态浊度法测定奥拉西坦注射液的细菌内毒素含量 [J], 张一帆; 汤秋华
因版权原因,仅展示原文概要,查看原文内容请购买。
奥拉西坦注射液以下内容仅供参考,请以药品包装盒中的说明书为准。
核准日期:2007年04月18日修改日期:2009年06月22日修改日期:2010年02月28日修改日期:2014年07月11日奥拉西坦注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:奥拉西坦注射液英文名称:Oxiracetam lnjection汉语拼音:Aolaxitan Zhusheye【成份】本品的主要成份为奥拉西坦,辅料为磷酸二氢钠盒乙二胺四乙酸二钠盐。
【性状】本品为几乎无色或微黄色澄明液体。
【适应症】用于脑损伤及其引起的神经功能缺失、记忆与智能障碍的治疗。
【规格】 5ml:1.0g【用法用量】静脉滴注,每次4.0g,每日一次,可酌情增减,用前加入100-250ml5%葡萄糖注射液或0.9%氯化钠注射液中,摇匀。
对神经功能缺失的治疗通常疗程为2周,对记忆与智能障碍的治疗通常疗程为3周。
【不良反应】据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒,恶心,精神兴奋,头晕,头痛,睡眠紊乱,但症状较轻,停药后可自行恢复。
【禁忌】对本品过敏者、严重肾功能损害者禁用。
【注意事项】 1、1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
【儿童用药】尚不明确【老年用药】若出现不良反应时,须减量。
【药物相互作用】尚不明确【药物过量】目前尚无本品药物过量反应的相关报道。
【药理毒理】药理作用本品为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。
机理研究结果提示,本品可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP的比值,使大脑中蛋白质和核酸的合成增加。
毒理研究动物研究提示:本品急性毒性低,小鼠灌胃给药10g/kg,静脉给药2g/kg和大鼠灌胃给药10g/kg均未见动物死亡;未表现出致突变、致癌作用及生殖毒性。
【药代动力学】奥拉西坦注射液经静脉给予健康受试者后,在体内的药代动力学符合二室模型,消除半衰期为3小时左右。
注射用奥拉西坦标准草案及起草说明
注射用奥拉西坦
Oxiracetam for injection
Zhusheyong aolaxitan
本品为奥拉西坦无菌冻干粉,含奥拉西坦(C
6H
10
N
2
O
3
)应为标示量的90.0~110.0%。
【性状】
本品为白色或类白色粉末或疏松状固体。
本品在水中易溶、在甲醇或乙醇中略溶,在丙酮、氯仿或苯中几乎不溶;在氢氧化钠中易溶解。
【鉴别】
(1)取本品内容物约10mg,加水2ml溶解,加高锰酸钾试液与氢氧化钠试液各1滴,溶液由紫色变成蓝色,渐变为绿色。
(2) 取本品内容物约10mg,加盐酸1滴溶解,置水浴上加热驱除过剩的盐酸,加碘化钾试液与5%的碘酸钾溶液各1滴,溶液即变成棕色,再加淀粉指示液1滴,应显蓝色。
(3)取本品,加水制成每1ml中含0.1mg的溶液,用有关物质项下的色谱条件进行检测,进样20μl,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)本品的红外光吸收图谱应与对照品的红外光吸收图谱一致(中国药典2005年版二部IV C)。
【检查】
酸碱度取本品0.1g,加水10ml,充分振摇,使溶解、滤过,取滤液依法测定(中国药典2005年版二部附录VI C)pH值应为4.5~6.5。
溶液的澄清度与颜色取本品1.0g,加新沸过的冷水10ml溶解后,溶液应澄清。
如显色,与黄色5号标准比色液(中国药典2005年版二部附录IX A第一法)比较,不得更深。
水分取本品,照水分测定法(中国药典2005年版二部附录Ⅷ M 第一法A)测定,含水分不得过2.0%。
有关物质照高效液相色谱法(中国药典2005年版二部附录V D)测定。
色谱条件与系统适用性试验用氰基键合硅胶为填充剂;以甲醇一水(2∶3)为流动相;检验波长为214nm。
理论板数按奥拉西坦峰计算应不低于4000。
测定法
取本品,加水制成每1ml中含1.0mg的溶液,作为供试品溶液。
量取适量,加水制成每1ml中含20μg的溶液,作为对照溶液。
取对照溶液10μl注入液相色谱仪进行预试,调节检测灵敏度。
使主成分色谱峰的峰高约为记录仪满量程的20-25%。
再准确量取上述两种溶液各10μl分别注入色谱仪,记录色谱图至主峰保留时间的两倍,供试品溶液的色谱图中如有杂质峰,量取各杂质峰面积的和,应不大于总面积的1.5%。
无菌取本品,加无菌水适量溶解后,全部转移至不少于500ml的0.9%无菌氯化钠溶液中,用薄膜过滤法处理后,依法检查(中国药典2005年版二部附录ⅪH),应符合规定。
细菌内毒素取本品,依法检查(中国药典2005年版二部附录Ⅺ E),每1mg奥拉西坦中含内毒素的量应小于0.1EU。
其他应符合注射剂项下有关的各项规定(中国药典2005年版二部附录附录Ⅰ B)。
【含量测定】
测定法照氮测定法(中国药典2005年版二部附录Ⅶ D第二法)测定。
取本品约0.2g,精密称定,置凯氏烧瓶中加40%氢氧化钠溶液20ml,连接蒸馏装置,另取2%硼酸溶液40ml作为吸收液,加入甲基红一溴甲酸绿混合指示液10滴,水蒸汽蒸馏,至接受液的总体积约为200ml时,停止蒸馏,吸收液用硫酸滴定液(0.05mol/L)滴定,并将滴定结果用空白试液校正,即得。
每1ml的硫酸滴定液(0.05mol/L)相当于15.82mg的C6H10N2O3。
【类别】脑代谢药。
【贮藏】遮光,密封,在阴凉干燥处保存。
【制剂】注射用奥拉西坦,奥拉西坦注射液,奥拉西坦胶囊。
【有效期】暂定二年
注射用奥拉西坦标准草案起草说明
一、名称、分子式、结构式与分子量
中文名:注射用奥拉西坦
汉语拼音:zhusheyong a olaxitan
英文名:Oxiracetam for injection
主要成分化学名:2-(4-羟基吡咯烷-2-酮-1-基)乙酰胺
二、性状
本品为白色或类白色结晶性粉末或疏松状固体。
六批样品外观状检验结果列入表11-1。
三、鉴别
鉴别的方法确定:参照中国药典的鉴别方法,分别用显色反应、红外光谱、液相色
谱进行鉴别。
具体方法如下:
(1)取本品内容物约10mg,加水2ml溶解,加高锰酸钾试液与氢氧化钠试液各1滴,溶液由紫色变成蓝色,渐变为绿色。
(2) 取本品内容物约10mg,加盐酸1滴溶解,置水浴上加热驱除过剩的盐酸,加碘化钾试液与5%的碘酸钾溶液各1滴,溶液即变成棕色,再加淀粉指示液1滴,应显蓝色。
(3)本品的红外光吸收图谱应与对照品的红外光吸收图谱一致(中国药典2005年版二部IV C)。
(4)取本品与奥拉西坦对照品适量,分别加水溶解并稀释制成每1ml中含0.1mg的溶液,照奥拉西坦有关物质项下的色谱条件测定,供试品主峰的保留时间应与对照品主峰的保留时间一致。
六批样品的红外光谱见申报资料10,六批样品鉴别试验结果列入表11-1。
四、检查
溶液的澄清度与颜色取自制对照品0.20g,加0.1mol/L的盐酸10ml溶解,另取本品六批及一批粗品各0.20g,加0.1mol/L的盐酸10ml溶解,自制对照品溶液澄清、颜色浅于黄色1号标准比色液,六批样品溶液澄清,颜色均浅于黄色1号标准比色液,粗品澄清、颜色与黄色1号标准比色液比较,略浅,故将本品溶液的颜色限制在不得比黄色5号标准比色液更深。
六批样品溶液的澄清度与颜色检查结果列入表11-1。
酸碱度取六批样品,按中国药典2005年版二部附录VI C依法测定,取0.1g,加水10ml,充分振摇,使溶解、滤过,取滤液依法测定pH值为4.5-6.5。
六批样品的PH值检查结果列入表11-1。
水分取本品,照水分测定法(中国药典2005年版二部附录Ⅷ M 第一法A)测定,含水分不得过2.0%。
六批样品水分测定结果列入表11-1。
纯度检查
用氰基键合硅胶为填充剂;以甲醇-水(2∶3)为流动相;检验波长为214nm。
理论板数按奥拉西坦峰计算应不低于4000。
本品纯度检查对象主要是有关物质及降解产物。
选择合适的高效液相检测条件,采用已知杂质作对照,对样品经光照、温度、湿度影响、酸碱加热分解的样品进行试验,证明达到分离。
(有关物质的归属及方法学研究详见申报资料10)。
六批样品中有关物质检查结果均列入表11-1。
结果表明:产品有关物质中杂质总量均小于1.0%,单一杂质的量均小于0.5%。
无菌:取本品,加无菌水适量溶解后,全部转移至不少于500ml的0.9%无菌氯化钠溶液中,用薄膜过滤法处理后,依法检查(中国药典2005年版二部附录ⅪH),应符合规定。
六批样品无菌检查结果列入表11-1。
细菌内毒素:取本品,依法检查(中国药典2005年版二部附录Ⅺ E),每1mg奥拉西坦中含内毒素的量应小于0.10EU。
六批样品细菌内毒素检查结果列入表11-1。
五、含量测定
含量测定采用氮检测法(详见申报资料NO.10)经过对六批样品和一批样品的含量测定结果证明样品含量均高于99.6%,结果列入表11-1,粗品含量为98.7%,因此含量定为按干燥品计算含C32H53BrN2O4为99.0%以上。
测定法照氮测定法(中国药典2000年版二部附录Ⅶ D第二法)测定。
取装量差异项下的内容物适量(约相当于奥拉西坦0.2g),精密称定,置烧杯中,加少量水溶解并转移至蒸馏瓶中,用水洗涤烧杯,合并洗液至蒸馏瓶中,加40%氢氧化钠溶液20ml,另取2%硼酸溶液40mL作为吸收液,加甲基红-溴甲酚绿混合指示液10滴,蒸馏至馏出液的总体积约为200ml时,停止蒸馏,吸收液用硫酸滴定液(0.05mol/L)滴定,并将滴定结果用空白试验校正。
每1ml的硫酸滴定液(0.05mol/L)相当于15.82mg的C6H10N2O3。
六批样品含量测定结果列入表11-1。
六、类别
脑代谢药。
七、贮藏
根据本品稳定性试验考察结果(详见申报资料14),确定本品应避光并置干燥处贮藏。
八、制剂
注射用奥拉西坦、奥拉西坦注射液规格均为1g,胶囊规格为400mg。
九、有效期
通过加速试验、长期试验考察结果可知,本品在包装状态下较稳定(详见申报资料14),因此将本品有效期暂订为二年,实际有效期应以长期试验的最终结果为准。
十、参考文献。