奥拉西坦注射液-说明书
- 格式:docx
- 大小:16.97 KB
- 文档页数:3




HPLC法测定奥拉西坦注射液中奥拉西坦的含量【关键词】奥拉西坦摘要:目的建立奥拉西坦注射液中奥拉西坦的含量测定方法。
方法高效液相色谱法,用氨基硅烷键合硅胶为填充剂,流动相为乙腈水(体积比80∶20),检测波长210 nm。
结果奥拉西坦质量浓度在0.025~0.20 mg/mL范围内与峰面积呈良好的线性关系(r=10000);精密度、重复性试验结果RSD分别为0.10 %和0.30 %;平均回收率为100.85 %,RSD=0.79 %。
结论本法简便,灵敏,准确,重现性好,建立的定量方法可用于控制该注射液的质量。
关键词:奥拉西坦;注射液;含量测定;高效液相色谱法Abstract: Objective To establish a quick and efficient highperformance liquid chromatographic assay for the determination of oxiracetam in oxiracetam injection. Method Chromatography was performed on a column (250/4.6 NUCLEOSIL 1005 NH2) using acetonitrilewater (80∶20) as the mobile phase under the detection wavelength of 210 nm. Result The linear range was 0.025~0.20 mg /ml(r=1.0000). The average recovery was 100.85 % and RSD 0.79 %. Conclusion The method is convenient,sensitive and accurate for the quality control of oxiracetam injection.Key words:oxiracetam; oxiracetam injection; content determination; HPLC奥拉西坦注射液主要成分为奥拉西坦。
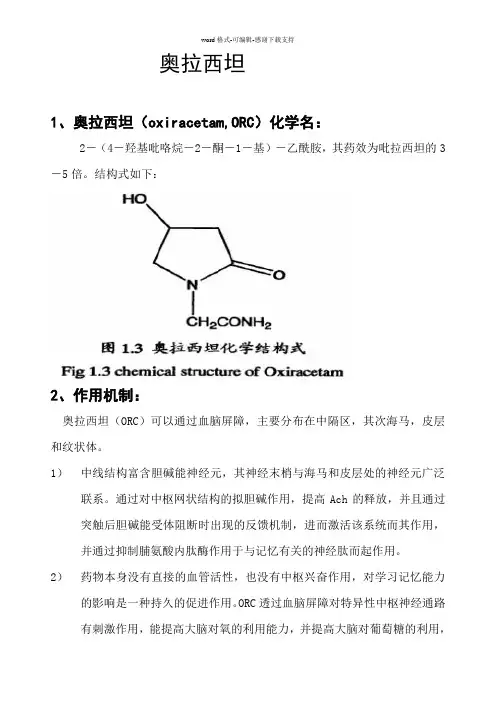
奥拉西坦1、奥拉西坦(oxiracetam,ORC)化学名:2-(4-羟基吡咯烷-2-酮-1-基)-乙酰胺,其药效为吡拉西坦的3-5倍。
结构式如下:2、作用机制:奥拉西坦(ORC)可以通过血脑屏障,主要分布在中隔区,其次海马,皮层和纹状体。
1)中线结构富含胆碱能神经元,其神经末梢与海马和皮层处的神经元广泛联系。
通过对中枢网状结构的拟胆碱作用,提高Ach的释放,并且通过突触后胆碱能受体阻断时出现的反馈机制,进而激活该系统而其作用,并通过抑制脯氨酸内肽酶作用于与记忆有关的神经肽而起作用。
2)药物本身没有直接的血管活性,也没有中枢兴奋作用,对学习记忆能力的影响是一种持久的促进作用。
ORC透过血脑屏障对特异性中枢神经通路有刺激作用,能提高大脑对氧的利用能力,并提高大脑对葡萄糖的利用,通过激活腺苷酸激酶提高大脑中ATP/ADP的比值,使大脑中蛋白质和核酸的合成增加,为大脑正常工作提供充足的能量保障。
3)ORC可调节谷氨酸促离子α-AMPA,能选择性地和不可逆地延长离子通道开放时间,并且防止它的脱敏。
ORC可增加L-谷氨酸盐激活的单通道反应的爆发长度,对AMPA受体具有正性作用。
ORC对谷氨酸受体的促离子、促代谢作用,促进大脑长时程增强(LTP)的产生,增加突触后电位的时限和波幅,甚至引起长期强化后仍出现突触后电位的延长,即使受体已被致敏,ORC仍能增强突触反应,进而增强学习和记忆能力。
ORC还可以促进大脑皮质联络纤维突触的可塑性,调动未受损脑组织及功能重建,恢复神经功能,提高患者生活质量。
4)蛋白激酶C(PKC)是存在于海马中的影响学习功能的蛋白,ORC可以通过改变γ-PKC的活化反应过程,增加PKC的活性,提高学习记忆能力。
5)ORC作用后大鼠下丘脑神经元Na+电流及K+电流均增大。
Na+电流的增加会提升神经元动作电位的幅值,使神经元动作电位在细胞间传导增加,而K+电流的增加会使神经元静息电位的绝对值增大,细胞膜电位负值变得更大,从而使神经元动作电位的传导更加容易;因此在细胞水平ORC可能是通过增加神经元动作电位的幅值及传导速度而改善脑功能。

奥拉西坦注射液治疗一氧化碳中毒迟发性脑病30例临床分析【摘要】目的了解奥拉西坦注射液治疗一氧化碳中毒迟发性脑病的临床效果。
方法30例患者纳入该研究,将其分为对照组和治疗组,对照组进行高压氧、改善微循环及脑保护等治疗,治疗组再次基础上给予奥拉西坦注射液治疗。
结果治疗组有效率为86.7%,对照组53.3%,治疗组明显高于对照组,差异有统计学意义(p0.05),具有可比性。
1.2治疗方法:2组患者常规给予高压氧治疗(压力2个大气压),其中加压20min,稳压40min,减压20min,每日1次,10次为1疗程。
同时给予胞二磷胆碱及红花等治疗。
治疗组在对照组的基础上再给予奥拉西坦注射液(广东世信药业生产)3.0g静滴,每日1次,14天为1疗程。
1.3疗效判定标准[3]:①治愈:神志清,原有症状体征消失,脑电图正常,生活自理;②好转:意识障碍程度减轻,原有症状体征较前改善,生活基本能自理,遗留部分运动或精神障碍,脑电图轻到中度异常;③无效:病情处于稳定期或加重期,未进入恢复阶段,生活不能自理,脑电图重度异常。
有效包括治愈和好转。
1.4统计学方法:用spss13.0统计软件进行分析。
计量数据以均数标准差表示,组间比较采用t检验;计数资料以率(%),采用x2检验。
p<0.05为差异有统计学意义。
2结果2.1治疗效果:两组疗效比较见表1:治疗组总有效率86.7%,高于对照组53.3%两组比较有显著性差异(p<0.05)3讨论急性一氧化碳中毒在我国北方属于常见病、多发病,迟发性脑病发生率占2%~30%。
一氧化碳中毒后迟发性脑病多发生在中重度急性一氧化碳中毒之后,患者急性期多昏迷时间长,或治疗不规范,于假愈期后出现以认知障碍为主的神经精神症状,主要表现以痴呆、震颤麻痹、语言障碍、大小便障碍等,日常生活能力明显下降,一旦发生,治疗不及时,临床症状进行性加重。
其发病机制尚不完全明了,有多种学说,以低氧—缺血理论、细胞凋亡学说、自由基学说、血管因素学说等居多[4]。

制剂处方及工艺的研究资料及文献资料一、处方按1000支注射剂计算,规格分别为5ml,10ml:奥拉西坦 1000g 2000g依地酸钙钠 1g 2g注射用水加至5000ml 10000ml二、处方依据国内上市的奥拉西坦注射液规格为1g/支,一次2支用于静脉滴注,日本或其他地区上市的奥拉西坦注射剂规格为5ml和10ml ,成人一次2-8g,一日一次,一日1~2次靜脉注射,处方为50mg/ml。
据此将奥拉西坦注射液的规格定为每支含奥拉西坦1g(5ml)以及2g(10ml)。
三、生产工艺(1)水处理:自来水进行处理,制成纯水,过滤用于安瓿洗涤,同时蒸馏制备注射用水,并通氮气。
(2)安瓿处理:洗涤安瓿,干燥灭菌,冷却。
(3)注射液的配置和滤过:在配制容器中,加配制量80%的通氮注射用水,加入处方量依地酸钙钠,加104.4%处方量的奥拉西坦,搅拌使完全溶解,用10mol/L盐酸调节pH4.0~7.0,加通氮注射用水至全量。
加入0.2%活性炭至药液中,50℃下搅拌30分钟,过滤。
用垂熔玻璃漏斗与膜滤器滤过,溶液中通氮气,并在氮气流下灌封,最后用115℃流通蒸汽30min灭菌。
(4)灯检,质量检查。
(5)印字,包装入库。
四、原辅料来源及质量标准奥拉西坦原料是*******制药有限公司生产,符合奥拉西坦质量研究标准草案以及国家标准;水为注射用水,符合注射用水质量标准;盐酸为上海化学试剂公司产品,分析纯,主要是调节奥拉西坦溶液pH值;依地酸钙钠为上海润捷化学试剂有限公司生产,本公司按中国药典2010年版标准进行了检测,质量符合中国药典标准。
五、工艺流程图六、处方工艺研究1、奥拉西坦理化性质(1)溶解性分析:经溶解度试验,本品在水中易溶。
(2)色泽与澄清度:取奥拉西坦1.0g ,加水10ml溶解后,溶液无色澄清。
(3)pH值测定:取奥拉西坦0.5g,加水10ml溶解后,测定pH值为4.0-6.5。
2、处方选择按上市的注射剂的处方确定为1mg/5ml,使用5ml和10ml安瓿,再对其稳定性考察。

奥拉西坦注射液药品名称:通用名称:奥拉西坦注射液英文名称:Oxiracetam Injection商品名称:欧兰同成份:奥拉西坦适应症:用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。
规格:5ml:1g静脉滴注。
每日一次,每次4-6g,用前加入到5%葡萄糖注射液或0.9%氯化钠注射液100-250ml中,摇匀后静脉滴注。
可酌情增减用量,用药疗程为2-3周。
国外上市奥拉西坦注射液的用量范围是2-8g,但国内尚无低于4g、高于6g的用药经验。
不良反应:1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻,停药后可自行恢复。
2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差异,未发现严重不良事件。
禁忌:对本品过敏者、严重肾功能损害者禁用。
注意事项:1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
孕妇及哺乳期妇女用药:本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。
儿童用药:尚不明确。
老年用药:Lecaillon JB 等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除半衰期(t 1/2β)较健康青年人延长,曲线下面积(AUC)及血药峰浓度(C max )均略有升高,老年人在使用本品后消除速度稍慢,但与青年人相比无显著性差异。
药物相互作用:尚不明确。
药物过量:在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。
毒理研究:动物研究显示,奥拉西坦小鼠灌胃给药10g/kg 、静注给药2g/kg 和大鼠灌胃给药10g/kg 均未见动物死亡;未见致突变性、致癌作用及生殖毒性。
药理作用:奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。
机理研究结果提示,奥拉西坦可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP 的比值,使大脑中蛋白质和核酸的合成增加。

奥拉西坦注射液药品名称 :通用名称:奥拉西坦注射液英文名称:Oxiracetam Injection商品名称:欧兰同成份 :奥拉西坦适应症 :用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。
规格 :5ml : 1g用法用量 :静脉滴注。
每日一次,每次4-6g ,用前加入到5%葡萄糖注射液或%氯化钠注射液100-250ml中,摇匀后静脉滴注。
可酌情增减用量,用药疗程为2-3 周。
国外上市奥拉西坦注射液的用量范围是2-8g ,但国内尚无低于4g、高于6g 的用药经验。
不良反应 :1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻,停药后可自行恢复。
2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差异,未发现严重不良事件。
禁忌 :对本品过敏者、严重肾功能损害者禁用。
注意事项 :1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
孕妇及哺乳期妇女用药:本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。
儿童用药 :尚不明确。
老年用药 :Lecaillon JB等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除半衰期 (t 1/2 β) 较健康青年人延长,曲线下面积 (AUC) 及血药峰浓度 (C max ) 均略有升高,老年人在使用本品后消除速度稍慢,但与青年人相比无显著性差异。
药物相互作用 :尚不明确。
药物过量 :在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。
毒理研究 :动物研究显示,奥拉西坦小鼠灌胃给药10g/kg 、静注给药 2g/kg 和大鼠灌胃给药 10g/kg 均未见动物死亡;未见致突变性、致癌作用及生殖毒性。
药理作用 :奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。

奥拉西坦注射液处方工艺改进和稳定性研究摘要】目的:分析奥拉西坦注射液处方工艺改进和稳定性。
方法:选择奥拉西坦200.0g,加入3.45g磷酸二氢钠、0.5g乙二胺四乙酸二钠盐,加入注射水直至1000ml为制造工艺,使用高效液相色谱法对相关物质含量进行测定,实施影响因素实验,加速实验以及长期考察实验,确认其稳定性,实施过敏性实验以及溶血反应实验,评价药物的安全性。
结果:在0.002091~0.189521mg/ml之内,线性关系良好。
样品主峰面积为1378512,RSD=0.14%,12h内稳定性良好。
回收率实验平均回收率为99.51%。
RSD为0.32%。
重复实验证实:样本的平均值为100.8%,RSD为0.39%。
稳定性良好,安全性佳,奥拉西坦不存在溶血和凝集现象,无过敏性。
12mo药品性状,PH值以及有关物质等和0mo无显著差异。
结论:本实验制定的工艺处方安全性强,质量可靠。
稳定性良好,药物安全性高。
【关键词】奥拉西坦注射液;稳定性;质量控制;生产工艺【中图分类号】R94 【文献标识码】A 【文章编号】2095-1752(2017)26-0377-02奥拉西坦属于吡咯烷酮类药物,具有改善脑代谢的效果。
最早由意大利ISF公司合成。
我国在1991年开始研究该药物,并投入生产[1]。
奥拉西坦可以促进磷酰乙醇胺以及磷酰胆碱合成,进而提升大脑对于氧分子和葡糖的利用吸收,改变ATP/ADP比值,提升大脑内蛋白质以及核酸合成量。
这种药物神经毒性低,可以对记忆以及智能障碍者的记忆和学习能力起到改善效果。
由此可见,保证药物安全性,制造出质量过关的药物,有着相当重要的现实意义,结合实际情况,本文现就奥拉西坦注射液处方工艺改进和稳定性展开全面研究,现报告如下。
1.资料与方法1.1 实验材料与设备高效液相色谱仪;紫外线检测设备;电子分析天平;色谱工作站;精密酸碱度计;澄明度检测设备;智能微粒检测设备;集菌仪;生化培养箱;奥拉西坦对照物;奥拉西坦注射液;重蒸馏水。

某院注射用奥拉西坦临床使用情况分析摘要:目的分析和了解某医院注射用奥拉西坦在临床合理应用情况,指导临床合理用药,提高医院合理用药水平。
方法对医院2017年第三季度使用注射用奥拉西坦病历进行合理性点评,以了解该药在某院的临床使用现状。
结果注射用奥拉西坦在某院临床使用主要涉及神经内科、神经外科等八个科室,临床使用不合理情形主要为无适应症用药、给药剂量不适宜、给药时机不适宜。
结论某院临床常用注射用奥拉西坦基本合理,但仍然存在部分不合理使用的情况,提示临床医生应加强对所使用药品临床应用相关知识的学习,熟练掌握所选择药物的说明书内容,严格按照说明书的适应症、药理作用、用法用量等。
临床药师应采取有效措施对不合理用药情况进行干预和监督,加强和用药科室的沟通,从而提高全院医务人员对合理用药的认识,提高合理用药水平,保障患者用药安全。
1.基本情况奥拉西坦是作用于中枢网状结构的拟胆碱能益智药,临床主要用于治疗理化因素引起的脑损伤,各种脑缺氧和慢性脑功能不全等。
对痴呆、休克、老年性精神衰退综合征(如记忆衰退、适应性降低、老年虚弱和精神活动障碍等)、低能儿童的大脑发育以及正常人的记忆力、工作效率的提高均有一定疗效。
奥拉西坦可以改善高血压脑出血患者的认知功能,对轻、中度阿尔茨海默病口服奥拉西坦疗效优于吡拉西坦,在临床使用较为广泛。
近几个月以来,某院注射用奥拉西坦使用金额均位于全院用药用药金额前列,为评估注射用奥拉西坦在某院临床的应用现状,特对注射用奥拉西坦临床使用合理性进行专项分析。
2.病例来源与点评方法2.1 病历调取通过院电子系统调取2017年7月至2017年9使用注射用奥拉西坦的患者病例202份,按使用量由高到低以5:2的比例抽取病例,共抽取80份病例。
其中神经内科56份,神经外科16份,重症医学科8份。
2.2 数据提取通过Excel设计专用表格进行数据调取,提取内容包括(1)基本情况:患者姓名、性别、年龄、体重、住院(门诊)序号、科室、总用量;(2)临床特征:临床诊断、用药目的、剂量、频率、溶媒、疗程、住院天数、使用时机;(3)合理性评价:是否合理、不合理理由。
奥拉西坦注射液标准草案及起草说明奥拉西坦注射液 Oxiracetam injectionAolaxitan Zhusheye本品为奥拉西坦注射液,含奥拉西坦(C 6H 10N 2O 3)应为标示量的90.0~110.0%。
【性状】本品为白色透明液体。
【鉴别】(1)取本品内容物约10mg ,加水2ml 溶解,加高锰酸钾试液与氢氧化钠试液各1滴,溶液由紫色变成蓝色,渐变为绿色。
(2) 取本品内容物约10mg ,加盐酸1滴溶解,置水浴上加热驱除过剩的盐酸,加碘化钾试液与5%的碘酸钾溶液各1滴,溶液即变成棕色,再加淀粉指示液1滴,应显蓝色。
(3)取本品,加水制成每1ml 中含0.1mg 的溶液,用有关物质项下的色谱条件进行检测,进样20μl ,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)本品的红外光吸收图谱应与对照品的红外光吸收图谱一致(中国药典2005年版二部IV C )。
【检查】酸碱度 取本品0.1g ,加水10ml ,充分振摇,使溶解、滤过,取滤液依法测定(中国药典2005年版二部附录VI C )pH 值应为4.5~6.5。
溶液的澄清度与颜色 取本品1.0g ,加新沸过的冷水10ml 溶解后,溶液应澄清。
如显色,与黄色5号标准比色液(中国药典2005年版二部附录IX A 第一法)比较,不得更深。
水分 取本品,照水分测定法(中国药典2005年版二部附录Ⅷ M 第一法A )测定,含水分不得过2.0%。
有关物质 照高效液相色谱法(中国药典2005年版二部附录V D )测定。
色谱条件与系统适用性试验用氰基键合硅胶为填充剂;以甲醇一水(2∶3)为流动相;检验波长为214nm。
理论板数按奥拉西坦峰计算应不低于4000。
测定法取本品,加水制成每1ml中含1.0mg的溶液,作为供试品溶液。
量取适量,加水制成每1ml中含20μg的溶液,作为对照溶液。
取对照溶液10μl注入液相色谱仪进行预试,调节检测灵敏度。
奥拉西坦注射液以下内容仅供参考,请以药品包装盒中的说明书为准。
核准日期:2007年04月18日修改日期:2009年06月22日修改日期:2010年02月28日修改日期:2014年07月11日奥拉西坦注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:奥拉西坦注射液英文名称:Oxiracetam lnjection汉语拼音:Aolaxitan Zhusheye【成份】本品的主要成份为奥拉西坦,辅料为磷酸二氢钠盒乙二胺四乙酸二钠盐。
【性状】本品为几乎无色或微黄色澄明液体。
【适应症】用于脑损伤及其引起的神经功能缺失、记忆与智能障碍的治疗。
【规格】 5ml:1.0g【用法用量】静脉滴注,每次4.0g,每日一次,可酌情增减,用前加入100-250ml5%葡萄糖注射液或0.9%氯化钠注射液中,摇匀。
对神经功能缺失的治疗通常疗程为2周,对记忆与智能障碍的治疗通常疗程为3周。
【不良反应】据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒,恶心,精神兴奋,头晕,头痛,睡眠紊乱,但症状较轻,停药后可自行恢复。
【禁忌】对本品过敏者、严重肾功能损害者禁用。
【注意事项】 1、1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
【儿童用药】尚不明确【老年用药】若出现不良反应时,须减量。
【药物相互作用】尚不明确【药物过量】目前尚无本品药物过量反应的相关报道。
【药理毒理】药理作用本品为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。
机理研究结果提示,本品可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP的比值,使大脑中蛋白质和核酸的合成增加。
毒理研究动物研究提示:本品急性毒性低,小鼠灌胃给药10g/kg,静脉给药2g/kg和大鼠灌胃给药10g/kg均未见动物死亡;未表现出致突变、致癌作用及生殖毒性。
【药代动力学】奥拉西坦注射液经静脉给予健康受试者后,在体内的药代动力学符合二室模型,消除半衰期为3小时左右。
化学品安全技术说明书公司地址:上海化学工业区奉贤分区银工路28号E栋楼客服热线:400-133-2688 1 化学品及企业标识1.1 产品标识符化学品俗名或商品名:奥拉西坦CAS No.:62613-82-5别名:4-羟基-2-氧代吡咯烷-N-乙酰胺;2-(4-羟基-2-氧代-1-吡咯烷基)乙酰胺;1.2 鉴别的其他方法4-Hydroxy-2-oxopyrrolidine-N-acetamide1.3 有关的确定了的物质或混合物的用途和建议不适合的用途仅供科研用途,不作为药物、家庭备用药或其它用途。
2 危险性概述2.1 GHS分类健康危害严重损伤/刺激眼睛:EyeIrrit.2皮肤腐蚀/刺激:SkinIrrit.22.2 GHS 标记要素,包括预防性的陈述危害类型GHS07:感叹号;信号词 无危险申明H315 引起皮肤过敏。
H319 造成了严重的眼睛发炎。
警告申明P264 在处理后要彻底清洗双手或 … 。
P280 戴防护手套/防护服/护眼/防护面具。
P302+P352 如沾染皮肤:用大量肥皂和水清洗。
P305+P351+P338 如进入眼睛:用水小心清洗几分钟。
如果可以做到,摘掉隐形眼镜,继续冲洗。
P321 特殊明确的治疗见本标签上的...。
P332+P313 如发生皮肤刺激:求医/就诊。
P337+P313 如果发生眼刺激:求医/就诊。
?P362 脱掉受污染的衣服,清洗后方可重新使用。
RSHazard symbol(s) 无数据资料R-phrase(s) 无数据资料S-phrase(s) 无数据资料2.3 其它危害物-无3 成分/组成信息3.1 物质分子式 - C6H10N2O3分子量 - 158.164 急救措施4.1 必要的急救措施描述一般的建议请教医生。
出示此安全技术说明书给到现场的医生看。
如果吸入如果吸入,请将患者移到新鲜空气处。
如果停止了呼吸,给于人工呼吸。
请教医生。
在皮肤接触的情况下用肥皂和大量的水冲洗。
2016.08药物应用91奥拉西坦注射液的安全性评价李 娥 董润璁 田树红 符 健海南医学院海南省药物安全性评价研究中心 海南省海口市 571101【摘 要】目的:通过试验评价奥拉西坦注射液的安全性,为临床应用提供依据。
方法:奥拉西坦注射液用药毒性,本文通过静脉注射血管刺激性和过敏性试验来评价其安全性。
结果:奥拉西坦注射液注射不引起血管刺激性,亦不引起过敏反应。
结论:实验结果提示奥拉西坦注射液符合静脉注射用药要求。
【关键词】奥拉西坦注射液;安全性评价;静脉注射本品为吡拉西坦的类拟物,属促智药。
可改善记忆与智能障碍症患者的记忆和学习功能。
透过血脑屏障对特异中枢神经道路有刺激作用,提高大脑中ATP/ADP 的比值,促大脑中蛋白质和核酸的合成增加。
动物研究本品急性毒性低,小鼠灌胃给药10 g/kg ,静脉给药2 g/kg 和大鼠灌胃10 g/kg 均未动物死亡;未表现致突变、致癌作用及生殖毒性。
奥拉西坦注射液经静脉给予健康受试者后,在体内的药代动力学符合二室模型,消除半衰期为3小时左右。
奥拉西坦在体内广泛分布,主要以肾脏、肝脏和肺内浓度高。
小鼠口服奥拉西坦后,脑内于4小时可达药物的峰浓度。
药物与血浆白蛋白的结合率低,很少透过胎盘屏障,主要以原形从肾脏排出。
本实验以奥拉西坦注射液为研究对象,考察其制剂安全性,为临床用药提供参考。
1 材料与方法1.1 药品与试剂奥拉西坦注射液,规格:5mL :1.0 g ,批号:120301,由海南合瑞制药股份有限公司提供;平行对照品,规格:5mL :1.0 g ,批号:110903B ,由哈尔滨三联药业有限公司。
1.2 动物新西兰家兔6只,HD 豚鼠36只,由广东省医学实验动物中心提供,动物生产许可证号:SCXK (粤)2008-0002。
1.3 方法1.3.1 奥拉西坦注射液对家兔血管刺激性试验家兔6只,每日每只兔一侧耳缘静脉滴注奥拉西坦注射液7.0 mg/kg ,另一侧滴注等体积的氯化钠注射液,1次/d ,连续3 d ,每天给药前、后对动物和注射部位进行肉眼观察,末次给药后96 h ,处死供试品、平行对照品组各2只家兔,剪取含有血管的耳缘组织,用甲醛固定后进行病理学检查,提供病理照片。
我院注射用奥拉西坦使用点评与分析余张宁; 黄燕愉; 刘玉珊【期刊名称】《《药品评价》》【年(卷),期】2019(016)016【总页数】2页(P24-25)【关键词】注射用奥拉西坦; 专项点评; 合理用药【作者】余张宁; 黄燕愉; 刘玉珊【作者单位】厦门医学院附属第二医院药学部福建厦门 361021; 厦门市海沧医院药学部福建厦门 361026【正文语种】中文【中图分类】R743.3为规范我院辅助治疗药品的使用,根据我院《辅助治疗药品使用管理制度》,每月对进入药品消耗金额排名前二十位的辅助治疗药品进行专项点评,点评时随机抽取住院病历30份,门急诊处方50张进行点评。
根据《医院处方点评管理规范(试行)》、《处方管理办法》,药品说明书等,对在2017年注射用奥拉西坦进行点评分析,具体情况如下。
1 一般资料利用我院PASS临床药学管理系统提取当月使用注射用奥拉西坦的处方及出院病历,共随机抽取处方431张,病历270份进行点评,利用Excel数据表记录患者住院号/门诊号、年龄、姓名、就诊科室、临床诊断及用药明细等。
2 方法以注射用奥拉西坦说明书、《处方管理办法》及奥拉西坦相关研究文献为参考标准,分析其应用的合理性。
3 结果3.1 科室分布情况注射用奥拉西坦病历/处方科室分布及抽取情况见表1、表2。
3.2 不合理用药情况共抽查270份病历中合理病历共231份,合理率为85.56%;共抽查431张处方中合理用药352张,合理率为81.67%。
不合理用药类型见表3。
表1 使用注射用奥拉西坦病历科室分布(例/%)表2 使用注射用奥拉西坦处方科室分布(例/%)表3 注射用奥拉西坦病历/处方不合理用药类型(例/%)3.3 持续点评情况按照辅助用药规定,连续3个月合格率低于90%的,要停止使用3个月。
以月份为横坐标,当月病历/处方的合理率为纵坐标,使用奥拉西坦的持续点评情况见图1。
图1 奥拉西坦注射液持续点评情况4 讨论4.1 从表1、表2可见,我院注射用奥拉西坦主要在神经内科、神经外科和急诊外科使用,这与药品说明书适应证“用于脑损伤及其引起的神经功能缺失、记忆与智能障碍等症的治疗”相符合,科室分布基本合理。
奥拉西坦注射液
药品名称:
通用名称:奥拉西坦注射液
英文名称:Oxiracetam Injection
商品名称:欧兰同
成份:
奥拉西坦
用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。
5ml:1g
静脉滴注。
每日一次,每次4-6g,用前加入到5%葡萄糖注射液或0.9%氯化钠注射液100-250ml中,摇匀后静脉滴注。
可酌情增减用量,用药疗程为2-3周。
国外上市奥拉西坦注射液的用量范围是2-8g,但国内尚无低于4g、高于6g的用药经验。
不良反应:
1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻,
停药后可自行恢复。
2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差
异,未发现严重不良事件。
对本品过敏者、严重肾功能损害者禁用。
1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。
2.患者出现精神兴奋和睡眠紊乱时,应减量。
孕妇及哺乳期妇女用药:
本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。
尚不明确。
Lecaillon JB等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除半衰期(t1/2β)较健康青年人延长,曲线下面积(AUC)及血药峰浓度(C max)均略有升高,老年人在使用本品后消除速度稍慢,但与青年人相比无显著性差异。
药物相互作用:
尚不明确。
在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。
动物研究显示,奥拉西坦小鼠灌胃给药10g/kg、静注给药2g/kg和大鼠灌胃给药10g/kg均未见动物死
亡;未见致突变性、致癌作用及生殖毒性。
奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。
机理研究结果提示,奥拉西坦可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP的比值,使大脑中蛋白质和
核酸的合成增加。
应用本品进行了人体药代动力学研究,结果:单次静脉滴注(2.0g)血药峰浓度(Cmax)为96.15±3.58μg·ml-1,半衰期(t1/2)为3.84±0.64h,曲线下面积(AUC0-12)为256.26±16.84μg·ml-1·h-1,曲线下面积(AUC0-∞)为
276.74±18.11μg·ml-1·h-1,肾排泄速率常数(k e)为0.18±0.03h<>sup-1,平均滞留时间(MRT)为4.39±0.39h。
多次静脉滴注(2.0g)血药峰浓度C max为97.92±3.26ug·ml-1,半衰期(T1/2) 为4.14±0.82h,曲线下面积
(AUC0-12)为259.36±25.43μg. ml-1·h-1,曲线下面积(AUC0-∞)为285.59±27.38μg·ml-1·h-1,肾排泄速率常数(k e)为0.17±0.04h-1,平均滞留时间(MRT)为4.87±0.69h。
奥拉西坦多次静脉给药体内无蓄积;静脉给药后,血药浓度水平以及主要的药代动力学参数在个体间差异较小;
文献资料显示:
奥拉西坦在肝、肾中分布浓度较高,除脑脊液中的半衰期为300分钟(口服2.0g)、140分钟(静脉注射2.0g)外,在其余组织的半衰期与血浆中相似。
奥拉西坦主要通过肾脏代谢,48小时内90%以上的药物以原型从尿中排出,个体间差异很小;老年人与健康年轻人的肾脏消除速度无显著性差异。
性状:
本品为无色或几乎无色的澄明液体。
遮光,密闭,在阴凉干燥处(不超过20℃)保存。
曲颈易折玻璃安瓿,6支/盒。
暂定24个月
YBH01692006(试行)
国药准字H20060070
哈尔滨三联药业有限公司
脑代谢功能促进剂
2007年01月24日。