碳同位素2
- 格式:ppt
- 大小:134.00 KB
- 文档页数:48
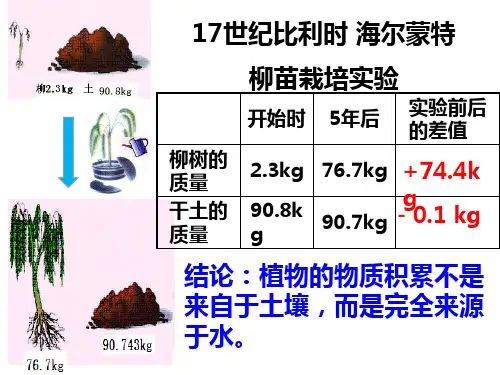

稳定碳同位素自然界有六种碳同位素:10C、11C、12C、13C、14C*和15C*。
主要有三种,它们的丰度是:12C-98.9%;13C-1.08%;14C-1.2×10-10%。
其中12C、13C是稳定同位素,14C是放射性同位素。
碳有两种稳定同位素:12C和13C,由于它们的质量不同,在自然界中的物理、化学和生物作用下产生分馏。
一般来说,在碳的有机循环中,轻同位素容易摄入有机质(例如烃、石油中富含12C,-30~-20‰)中;而在无机循环中,重同位素倾向于富集在无机盐(例如碳酸盐富含13C,海相灰岩约0‰)中。
碳同位素分馏包括动力学分馏(如光合作用、有机物的生物降解等)和平衡分馏(如大气CO2-溶解的HCO3--固体CaCO3系统)。
(1) 光合作用中的碳同位素动力分馏(6CO2+6H2O→C6H12O6+O2):由于轻同位素分子的化学键比重同位素分子的化学键易于破坏,因而光合作用的结果使有机体相对富集轻同位素(12C),而残留CO2中则相对富集重同位素(13C)。
叶子表面对两种二氧化碳(12CO2、13CO2)同位素分子吸收速度上的差异是造成这一分馏的主要原因。
光合作用中碳同位素分馏程度与光合碳循环途径密切相关。
根据CO2被固定的最初产物的不同,光合碳循环可分为C3、C4和CAM三种方式。
C3循环长,分馏大,δ13C=-23‰~-38‰;C4循环为短循环,分馏小,δ13C=- 12‰~-14‰;CAM循环介于C3与C4间,其13C的亏损程度也介于C3与C4植物间。
(2)生物氧化-还原作用过程中的碳同位素分馏:一方面,微生物通过氧化还原反应获取能量,加速氧化还原反应的进行。
另一方面,微生物在参与反应的过程中,对于同位素的利用具有选择性,优先选择利用化学能较弱的轻同位素化学键,使得轻同位素较重同位素更易被微生物所利用,进而产生显著的同位素分馏。
大气CO2-溶解的HCO3--固体CaCO3系统中的化学交换平衡反应:同位素平衡分馏只与温度有关,碳同位素分馏的结果是使固体碳酸盐中富集重同位素13C 从大气中的CO2到生物圈中有机碳化合物再到生物燃料和生物成因的甲烷,其碳同位素呈现出递减趋势,总体变化规律是氧化态的碳富集13C,还原态的碳富集12C。

碳的放射性同位素
碳的放射性同位素是指通过各种方式射出的具有放射性特性的碳同位素。
它是一种有用的放射性物质,可用于开展许多科学研究。
它也可以用来检测环境中污染物的浓度。
碳的放射性同位素可以从环境中发现,它们主要来源于太阳能射出的自然γ射线和核反应。
有时,它们也来源于可能发生的核反应,以及人为制造的核爆炸。
碳的放射性同位素由化学元素的变体组成,也就是其他常见元素的氘核或氙核组成,其同位素的半衰期范围可达千分之一秒至数百万年。
碳的放射性同位素可以帮助研究人员检测和测定污染物的量,更重要的是它可以应用于地下水、土壤和肥料中污染物的检测。
碳的放射性同位素可以测量准确的污染物的质量,可有效识别和定位污染物的源头,从而更好地控制污染物的活动。
在铀等危险有毒矿物的检测中,碳的放射性同位素也可以发挥作用。
可以测量核辐射是否泄漏至环境中,用于识别危险物质的分布情况,确定核辐射污染物的轨迹。
对于生物研究,碳的放射性同位素也很重要。
它可以用于追踪各种体外生物材料的运动特征,以及内部机体的结构和活动机制的研究,提供生物药物的研发和检测,以及有关基因和遗传调控机制的研究。
从以上可以看出,碳的放射性同位素是一种有用的放射物质,可以被广泛应用于工业生产和科学研究中,为人类提供了重要的作用。

c2化学名称摘要:1.引言2.C2 化学名称的含义3.C2 的化学性质4.C2 的实际应用5.结论正文:【引言】C2,即碳的第二个同位素,是一种碳原子核中含有两个中子的同位素。
在化学领域,C2 有着广泛的应用,特别是在核物理和放射性研究中。
本文将从C2 的化学名称、化学性质和实际应用等方面进行介绍。
【C2 化学名称的含义】C2 化学名称中的“C”代表碳元素,而“2”则表示该同位素的原子核中含有两个中子。
在元素周期表中,C2 的原子序数为6,质量数为12。
因此,C2 的化学名称为碳-12(^12C)。
【C2 的化学性质】C2,即碳-12,具有稳定的化学性质。
由于其原子核中的中子数量为2,与质子数量相等,这使得C2 具有稳定的原子结构。
在常温常压下,C2 以气态存在,呈无色、无味、无毒的性质。
C2 的化学性质与普通碳(C)相似,但在核物理和放射性研究中,C2 具有特殊的应用价值。
【C2 的实际应用】C2,即碳-12,在许多领域都有实际应用,尤其是在核物理和放射性研究中。
以下是C2 的一些主要应用领域:1.核物理研究:C2 被广泛用于核物理实验中,作为示踪原子。
由于C2 具有稳定的化学性质和较长的半衰期,它成为研究核反应和放射性衰变机制的理想示踪剂。
2.放射性药物:C2 在医学领域也有广泛应用,特别是在放射性药物治疗中。
例如,C2 可用于生产放射性药物如碳-12 标记的氨基酸、核苷酸等,这些药物在诊断和治疗癌症等疾病方面具有重要价值。
3.考古学和环境科学:C2 在考古学和环境科学领域也有应用。
通过检测文物中的C2 含量,可以推测文物的年代和来源;在环境科学中,C2 可用于研究碳循环过程和温室气体排放等。
4.工业领域:C2 在工业生产中也有一定的应用,如在石油化工、化学制品生产等方面的质量控制和分析。
【结论】C2,即碳-12,是一种具有稳定化学性质的重要同位素。
在核物理、放射性研究、医学、考古学、环境科学和工业等领域都有广泛的应用。

同位素例子同位素是一种原子中具有相同数量的质子和中子,但质子数量和中子数量不同的类型。
它们是原子的一个基本特性,被用来标识具有不同特性的原子。
本文尝试在不同的同位素例子中探讨原子的结构和特性。
每一种元素有不同的同位素,具有不同的质子数和中子数。
碳的4种同位素是碳-12、碳-13、碳-14和碳-15。
碳-12是碳的原子核的基本结构,它的原子核由6个质子和6个中子组成。
它的原子量为12,可以被认为是最常见和最稳定的同位素。
它是自然界中最常见的元素,占据整个大气中99.98%的量。
碳-13是碳-12的稳定同位素,原子核中有7个质子和6个中子,它的原子量为13。
尽管碳-13的质子数量比碳-12多一个,但由于它们的原子质量是不同的,它们仍可被称为稳定同位素。
碳-13的含量比碳-12低,但仍占大气中碳的0.01%,大多数情况下,它是碳的放射性同位素。
碳-14和碳-15也是碳的稳定同位素,都有6个质子和8个中子,但碳-14的原子量为14,碳-15的原子量为15。
由于高质子数,碳-14和碳-15是自然界中最不稳定的同位素,但其含量又比碳-13要高。
尽管它们是放射性同位素,但其辐射后存活时间较长,这就导致了它们在自然界中的存在。
此外,研究人员发现了许多其他的同位素,他们的结构和特性也有所不同。
在氟,氯,氧和氮这四种元素中,都可以发现多种同位素,这些同位素的原子核结构都不同,由此可以推断出它们对应的特性也是不同的。
例如,氟-18和氟-17是两种稳定同位素,它们的原子核由9个质子和10个中子组成,但前者质量比后者大2倍,它们的物质性质也不尽相同。
另外,氯-35也是稳定同位素,其原子核由17个质子和18个中子组成,其中氯-35与氯-37是放射性同位素,它们的原子核由17个质子和20个中子组成。
由于质子数量不同,氯-35和氯-37的特性也不尽相同,例如,氯-37的辐射更加强烈。
以上就是不同的同位素的例子,它们都有着不同的原子核结构,这就决定了它们的原子量,以及它们的物质性质,甚至放射性质质不同。


同位素地球化学目录一、碳的同位素组成及其特征 (1)1.碳同位素组成 (1)Ⅰ、碳的同位素丰度 (1)Ⅱ、碳的同位素比值(R) (1)Ⅲ、δ值 (2)2.碳同位素组成的特征 (2)Ⅰ.交换平衡分馏 (2)Ⅱ.动力分馏 (3)Ⅲ.地质体中碳同位素组成特征 (4)二、碳同位素在地质科学研究中的应用 (8)1. 碳同位素地温计 (8)2.有机矿产的分类对比及其性质的确定 (9)Ⅰ.煤 (9)Ⅱ.石油 (9)Ⅲ. 天然气 (11)碳同位素组成特征及其在地质科研中的应用一、碳的同位素组成及其特征1.碳同位素组成碳在地球上是作为一种微量元素出现的,但分布广泛,在地质历史中有着重要作用。
碳的原子序数为6 ,原子量为12.011,属元素周期表第二周期ⅣA族。
碳在地壳中的丰度为2000×10-6,是一个比较次要的微量元素。
在地球表面的大气圈、生物圈和水圈中,碳是最常见的元素之一,是地球上各种生命物质的基本成分馏。
碳既可以呈固态形式存在,又能以液态和气态形式出现。
它既广泛分馏布于地球表面的各层圈中,也能在地壳甚至地幔中存在。
总之,碳可呈多种形式存在于自然界中。
在有机物质和煤、石油中,以还原碳的形式存在,在二氧化碳气体和水溶液中,以氧化碳形式出现。
碳还可呈自然元素形式出现在某些岩石中(如金刚石和石墨)。
一般用同位素丰度、同位素比值和δ值来表示同位素的组成。
Ⅰ、碳的同位素丰度同位素丰度指同位素原子在元素总原子数中所占的百分比,自然界中的碳有2个稳定同位素:12C和13C。
习惯采用的平均丰度值分别为98.90%和1.10%。
由此可见,在自然界中碳原子主要主要是以12C的形式存在。
另外碳还有一个放射性同位素14C,半衰期为5730a。
放射性14C的研究,目前已发展成为一种独立的同位素地质年代学测定方法,主要应用于考古学和近代沉积物的年龄测定。
适合用于作碳稳定同位素分馏析的样品包括:石墨、金刚石等自然碳矿物,方解石、文石、白云石、菱铁矿、菱锰矿等碳酸盐矿物;石灰岩、白云岩、大理岩等全岩样品;各种矿物包裹体中的C O2和CH4气体以及石油、天然气及有机物质中的含碳组分馏等。


碳的同位素的用途性质碳是一种非常常见的元素,它在自然界中非常广泛地存在,并且具有多种同位素。
同位素是指具有相同原子序数(即原子核中的质子数)但质量数不同的原子。
碳的同位素有多种不同的质量数,其中最常见的是碳-12、碳-13和碳-14。
首先,碳的同位素具有不同的性质,这使得它们有着广泛的应用。
其中最常见的应用是在地质学和化学中的放射性碳dating技术。
碳-14是一种放射性同位素,它的半衰期约为5730年。
因此,通过测量一种物质中碳-14和碳-12的比例,可以确定物质的年龄。
这种技术被广泛应用于考古学和地质学中,用于确定物质的年代。
此外,碳的同位素对于研究生物化学过程也非常重要。
在生物体内,碳-12和碳-13的比例可以用于研究动植物的食物链关系和生态系统的结构。
由于碳-12和碳-13具有不同的质量,它们在生物过程中有着不同的生化反应速率。
通过测量不同生物体中碳-12和碳-13的比例,可以了解其所处的食物链位置和生态角色。
在化学工业中,碳的同位素也有广泛的应用。
例如,碳-13可以用于核磁共振(NMR)技术中,这是一种研究分子结构的重要工具。
通过将标记有碳-13的化合物注入到样品中,并观察其在NMR光谱中的信号,可以确定其结构和相互作用方式。
这种技术被广泛应用于有机化学和药物研发中,有助于研究化合物的结构和性质。
另外,碳的同位素也可以用于追踪环境中的污染物。
例如,碳-13的同位素比例可以用于追踪大气中的二氧化碳排放源。
不同来源的二氧化碳具有不同的碳-13含量,通过测量大气中的碳-13比例,可以确定不同来源的贡献程度。
这种技术对于研究气候变化和环境污染有着重要的意义。
此外,碳的同位素还可以用于医学影像学中的正电子发射断层显像(PET)技术。
在PET扫描中,通过将标记有碳-11或碳-14的放射性同位素注射到人体内,可以观察到活跃的细胞和器官。
这种技术对于诊断和治疗癌症、心脏病等疾病具有重要的价值。
总结来说,碳的同位素具有广泛的用途和性质。

c12相对原子质量
(实用版)
目录
1.碳的同位素
2.碳 -12 的原子结构
3.碳 -12 的相对原子质量
4.碳 -12 在科学研究中的应用
正文
1.碳的同位素
碳是一种化学元素,它的原子核中含有 6 个质子。
在自然界中,碳存在多种同位素,即原子核中中子数不同的碳。
这些同位素包括碳 -12(C-12)、碳 -13(C-13)和碳 -14(C-14)等。
同位素的存在使得碳的相对原子质量不再是一个固定值,而是一个范围。
2.碳 -12 的原子结构
碳 -12 是碳的一种稳定同位素,其原子核中含有 6 个质子和 6 个中子。
由于质子带正电荷,中子不带电荷,碳 -12 的原子核整体呈电中性。
在化学反应中,碳 -12 的原子核不会发生变化,因此它是一种非常稳定的同位素。
3.碳 -12 的相对原子质量
碳 -12 的相对原子质量是指其原子质量与质子质量的比值,通常取为 12。
这是因为在自然界中,碳 -12 同位素的丰度最高,其他碳同位素的丰度相对较低。
因此,在计算碳的平均原子质量时,通常以碳 -12 为基准。
4.碳 -12 在科学研究中的应用
碳 -12 作为一种重要的同位素,在科学研究中有着广泛的应用。
例如,在放射性碳定年法中,碳 -14 同位素被用来测定有机物的年龄。
由于碳 -14 的半衰期较长,可以用来研究地质年代、古代文明等方面的问题。
此外,在生物学、化学和环境科学等领域,碳同位素的研究也具有重要意义。
总之,碳 -12 作为碳的一种稳定同位素,具有重要的科学应用价值。

碳同位素测年法
碳同位素测年法分为常规碳—14测年法和加速器质谱碳—14测年
法两种。
当时,Libby发明的就是常规碳—14测年法,1950年以来,这种方法的技术与应用在全球有了显著进展,但它的局限性也很明显,即必须使用大量的样品和较长的测量时间。
于是,加速器质谱碳—14测年技术发展起来了。
1、C14鉴定法是用碳同位素来鉴定古物的年份;
2、碳14是碳元素的一种具放射性的同位素,其是透过宇宙射线撞击空气中的氮原子所产生;
3、碳14是自然界中碳元素有三种同位素,即稳定同位素12C、13C 和放射性同位素14C。
炭十四测年法可以精确到0 –6000 +/- 40 BP。
零BP(迄今)规定为公元1950年,以及(五)全球放射性碳含量不变的假设。
碳14的衰变需要几千年,正是大自然的这种神奇,形成了放射性碳定年的基本原理,使碳14分析成为揭示过去的有力工具。
在放射性碳定年过程中,首先分析样品中遗留的碳14。
被分析的样品的碳14比例可以说明自样品源死亡后流逝的时间。
报告的放射性碳定年结果是未校准年BP(迄今),其中BP是指公元1950年。
接着进行校准,将BP年转换为历年。
随后将该信息与准确的历史年龄联系起来。
碳同位素与矿物成因有统计,可用的碳资源对人类的重要性已经不言而喻,这些资源在环境和社会发展中起着至关重要的作用。
因此,研究碳资源的成因及其所蕴含的潜力,可以帮助充分利用这些资源,更好地促进人类和自然界的发展。
碳同位素是地球表面丰富的碳资源中比较重要的一种,它可以帮助我们了解地球内部结构,从而更好地利用碳资源。
碳同位素不仅可以让我们更好地了解地球内部的构造,而且也可以帮助我们了解深部的碳资源的成因和分布特征,从而更有效地利用这些资源。
碳同位素的成因大体可以分为两大类:一类是因表面外部因素(如气温、风力、云量等)而形成的,这一类的碳源主要来源于地表和空气;另一类是由于地表内部因素(如火山爆发、海底火山、活动岩石等)而形成的,这一类的碳源来源于地壳和海水。
矿物成因与碳同位素关系密切,它们之间存在着密切的因果关系。
矿物有从熔融态(岩浆)中形成、从变质岩中形成和从沉积中形成等三种成因,碳同位素成因可以用来帮助我们更好地了解这些三种成因的差异。
其中,熔融态(岩浆)形成的碳同位素主要来源于地壳层中的岩石,而变质岩和沉积岩形成的碳同位素则来源于地表层以及地下水层中的岩石。
总体而言,碳同位素与矿物成因之间的关系非常紧密,研究碳同位素可以使我们更好地了解矿物的成因,并有效地利用碳资源。
鉴于碳资源的重要性,未来的研究将会更多地关注碳同位素与矿物成因之间的关系,因为这样可以帮助我们更有效地利用碳资源,更好地促进人类和自然界的发展。
综上所述,碳同位素与矿物成因之间的关系是非常紧密的。
研究这一关系可以帮助我们更好地利用碳资源,从而促进人类和自然界的发展。
只有通过对碳同位素与矿物成因之间关系的详细研究,我们才能更好地利用碳资源,实现环境和社会的可持续发展。
碳的同位素
自然界中碳元素有三种同位素,即稳定同位素12C、13C和放射性同位素14C,14C的半衰期为5730年,14C的应用主要有两个方面:一是在考古学中测定生物死亡年代,即放射性测年法;二是以14C标记化合物为示踪剂,探索化学和生命科学中的微观运动。
同位素的概念
同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
一氧化碳里碳同位素一氧化碳(CO)是一种由碳和氧元素组成的化合物,它在自然界中广泛存在,并且对我们的生活产生了重要影响。
特别是在碳同位素的研究中,一氧化碳提供了宝贵的信息,揭示了许多关于地质学、化学和生物学的重要知识。
让我们来了解一下碳同位素的概念。
碳同位素是指具有不同质量数的碳原子,其核外电子结构相同。
其中最常见的是碳的两种同位素,即碳-12和碳-13。
在自然界中,碳-12的丰度远远高于碳-13,占据了大约98.9%的比例,而碳-13只占约 1.1%。
这种同位素比例的差异是由于自然界中的生物过程和地球化学过程所致。
随着科学技术的发展,人们开始利用碳同位素来研究各种自然现象。
其中,一氧化碳的碳同位素成分是一个重要的研究对象。
一氧化碳的来源非常广泛,包括自然界的火山喷发、森林火灾、生物代谢过程以及人类活动中的燃烧过程等。
不同来源的一氧化碳具有不同的碳同位素成分,通过测量样品中的碳同位素比值,可以确定这些一氧化碳的来源和形成机制。
通过对一氧化碳的碳同位素进行研究,科学家们可以追踪气候变化、环境污染以及生物地球化学循环等过程。
例如,在研究气候变化方面,科学家可以通过分析大气中一氧化碳的碳同位素组成,了解不同地区的温度变化和降水情况。
此外,一氧化碳的碳同位素还可以用于研究大气污染物的来源和传输途径,以及生物地球化学循环中碳的转化过程。
除了在环境科学领域的应用,一氧化碳的碳同位素也被广泛用于生物学和地质学的研究中。
例如,在生物学研究中,科学家可以通过分析生物体组织中一氧化碳的碳同位素组成,了解生物进食链的结构和功能。
在地质学研究中,一氧化碳的碳同位素可以揭示地下水来源和流动路径,以及地下油气的生成和迁移过程。
一氧化碳的碳同位素对于了解自然界的各种过程起着重要的作用。
通过对一氧化碳的碳同位素进行分析,科学家们可以揭示环境变化、生物进食链、地下水和油气等方面的重要信息。
这些研究不仅有助于我们更好地了解地球的演化和生命的起源,还为环境保护和资源利用提供了科学依据。
双碳同位素双碳同位素指的是同种元素碳的两个同位素,也称为C13-C12双碳同位素,它们的质量数分别为13和12。
这两种同位素在自然界中存在的比例很小,但是它们的存在对于科学研究有着重要的作用。
本文将从双碳同位素的定义、应用和测量方法等多个方面进行阐述。
一、双碳同位素的定义同位素是指在元素化学性质和原子序数相同的情况下,质量数不同的原子。
同位素的存在能够对化学反应、地质环境等方面产生影响。
其中,C13和C12是碳同位素存在的两种形式,它们的质量数分别为13和12。
而双碳同位素就是指同时包含C13和C12的化合物或物质。
二、双碳同位素的应用1. 生物学方面在生物学研究中,利用双碳同位素的方法可以追踪生物体内的代谢物流。
比如,通过双碳同位素示踪技术可以追踪葡萄糖在体内的代谢路径。
之前的研究发现,葡萄糖代谢所产生的乳酸对肿瘤生长起到了非常重要的作用。
而通过追踪葡萄糖代谢产物的双碳同位素,可以更加深入地研究和理解这一过程。
2. 地质学方面地质领域也利用双碳同位素的技术进行研究。
例如,通过双碳同位素的测量,可以了解生物碳在化石形成过程中的改变情况,进而研究生态系统的演化和过程。
此外,研究古代大气CO2浓度变化、生物群落结构等也可以通过双碳同位素的分析方法展开。
3. 食品安全方面双碳同位素分析技术在食品安全领域应用也非常广泛。
例如,可以考察农产品中添加的食品添加剂、检测水果、蔬菜中的农药残留等。
此外,在检测动物肉制品中的有害物质,如激素、抗生素和脂肪等,也可以利用双碳同位素的方法进行测量。
三、双碳同位素的测量方法双碳同位素的测量方法主要有质谱法和激光吸收光谱法两种。
质谱法是指通过质谱仪测量样品中C13和C12的相对含量来获得双碳同位素比值的方法。
利用质谱法进行双碳同位素测量的过程中,需要对样品进行常规预处理、加标处理等步骤,且需要精确控制实验环境温度、压力等因素。
激光吸收光谱法则是草地生态学中另一种较为常用的技术,利用CO2分子在其自身吸收光谱样品中的吸收特性和双碳同位素比值之间的关系用来获得测量值。