二价过渡金属离子与氨基酸相互作用
- 格式:pdf
- 大小:229.03 KB
- 文档页数:13

218Univ. Chem. 2023, 38 (10), 218–224收稿:2023-01-26;录用:2023-02-13;网络发表:2023-02-28*通讯作者,Email:*******************.cn基金资助:国家重点研发计划(2018YFC1602400)•知识介绍• doi: 10.3866/PKU.DXHX202301022 氨基酸手性色谱分离杜瑾,石宜灵,唐安娜*,孔德明南开大学化学学院,分析科学研究中心,天津市生物传感与分子识别重点实验室,化学国家级实验教学示范中心,天津 300071摘要:光学活性和立体构象不同的氨基酸,具有不同的生理活性和作用,因此,实现氨基酸的有效手性分离具有重要意义。
色谱法是常用的氨基酸手性分离方法,具有分离效率高、速度快、灵敏、成本低和绿色环保等特点,在氨基酸手性分离和检测领域应用广泛。
本文综述了色谱法在氨基酸手性分离方面的最新进展,并对其发展趋势进行了展望。
关键词:氨基酸;手性分离;色谱法中图分类号:G64;O6Chiral Separation of Amino Acids by ChromatographyJin Du, Yiling Shi, Anna Tang *, Deming KongResearch Center for Analytical Sciences, Tianjin Key Laboratory of Biosensing and Molecular Recognition,National Demonstration Center for Experimental Chemistry Education, College of Chemistry, Nankai University,Tianjin 300071, China.Abstract: Amino acids with different optical activities and stereo-configurations have different physiological activities and effects. Therefore, it is important to achieve the chiral separation of amino acids effectively. Chromatography is a commonly used method for the chiral separation and detection of amino acids, and is characterized by high separation efficiency, high speed, sensitivity, low cost, and environmental friendliness. In this paper, we review the recent progress of chromatographic methods in the chiral separation and analysis of amino acids and provide an outlook on their development trends.Key Words: Amino acids; Chiral separation; Chromatographic methods手性(Chirality)起源于希腊语,表达了某种化合物和其镜像化合物不能重叠的关系,正如人的左手和右手不能完全重叠(图1)。


生物无机化学思考题 Document number【980KGB-6898YT-769T8CB-246UT-18GG08】一 1什么是生物体的必需元素和有害元素区分必需元素和有害元素的标准是什么(1)宏量元素都是必需元素;而微量元素不一定都是必需元素。
必需微量元素:Fe、 Zn 、Cu、 Mn、 Cr、Mo、Co、Se、Ni 、V、Sn、 F 、 I、 Sr(Si、B).有害元素:指哪些存在于生物体内时,会阻碍生物机体正常代谢过程和影响生理功能的微量元素,如:Cd 、Hg、 Pb 、 As 、 Be等(2)条件(1)该元素直接影响生物体的生物功能,并参与正常代谢过程。
(2)该元素在生物体内的作用不可能被其它元素所代替。
(3)缺乏该元素时,生物体内会发生某种病变,补充该元素时,可防止异常的发生或使其恢复正常。
2. 有的元素既是人体必需的,又是对人体有害的,你如何理解这种看起来矛盾的现象“双重品格”。
即它们既是必需的,又是有害的。
例(元素浓度)Se是生物体重要的微量元素,对肿瘤有抑制作用,成人每天摄取量为100μg。
若长期低于50μg,可能引起癌症、心肌损伤等;但过量摄取又可能造成腹泻、神经官能症及缺铁性贫血等中毒反应,甚至死亡。
如(元素存在形式)铁是重要的必需微量元素,正常人体内的铁几乎全部被限制在特定的生物大分子结构包围的封闭状态之中,这样的铁才能担负正常的生理功能3生物体内的宏量元素包括哪些举例说明生物体内的微量元素。
宏量元素11种: C、H、 O、 N、 P 、S、Cl、K、 Na 、 Ca、 Mg宏量元素是指含量占生物体总质量%以上的元素。
微量元素:指含量占生物体总质量%以下的元素。
Fe、Cu、Zn 、Mn、Cr 、Se 、I 、Mo 、Si等4. 必需微量元素具有哪些主要的生物功能举例说明。
(硒)对免疫系统的影响1973年证明硒是代谢过氧化氢的酶—谷胱甘肽过氧化物酶(GSHPX)的必需成分。

氨基酸与金属离子配位机理
氨基酸是构成蛋白质的基本组成部分之一,也是生命体内的重要化学
物质。
由于氨基酸的结构中含有氨基和羧基,使得其与金属离子发生
配位反应成为可能。
在自然界中,氨基酸与金属离子的配位机理具有
重要的生物学、化学和物理学意义。
氨基酸与金属离子的配位机理主要取决于配位基团的性质、金属离子
的电子结构、反应条件等因素。
一般情况下,氨基酸中的羧基和氨基
可以分别与金属离子形成配位键,从而形成金属离子和氨基酸之间的
络合化合物。
对于氨基酸中的侧链基团,例如谷氨酸、天冬氨酸等,
它们也可以与金属离子发生配位反应。
氨基酸与金属离子配位机理的研究不仅有助于深入理解生物体内的生
物化学反应过程,而且也有助于设计和制备新型功能材料。
例如,氨
基酸和金属离子的配位反应可以产生多种多样的化合物,如荧光探针、膜分离剂、药物等,这些化合物具有广泛的应用前景。
此外,通过氨
基酸和金属离子之间的配位作用,还可以模拟和研究生命体系中一些
关键的生物过程,如催化、传导和调控等。
最近的研究表明,氨基酸中的碱性侧链基团,如精氨酸、赖氨酸等,
通常会选择性地与金属离子形成强配位键,而氨基酸中的酸性侧链基
团,如谷氨酸、天冬氨酸等,则更容易形成弱的配位键。
此外,氨基酸中的羟基和硫醇基也可以与金属离子通过配位反应相互作用。
总之,氨基酸与金属离子的配位反应是生物学、化学、物理学等多学科交叉的研究领域,并有广泛的应用前景。
随着科技的发展和研究技术的不断创新,相信氨基酸与金属离子的配位机理会有更深入的研究和开发。

氨基酸与金属离子配位机理引言氨基酸是构成生物体内蛋白质的基本组成单元,而金属离子在生物体内广泛参与各种重要生命过程。
氨基酸与金属离子之间的配位反应对于维持生物体内的正常功能至关重要。
本文将探讨氨基酸与金属离子的配位机理,旨在深入了解这一过程的原理和意义。
金属离子的特性与生物配位1.金属离子的电子结构使其具有活泼的化学性质和高度的反应活性。
2.金属离子常常与氨基酸的羧基和氨基配位形成配合物。
•金属离子可以与氨基酸的羧基中的羧酸根形成配位键。
•金属离子也可以与氨基酸的氨基中的氨根形成配位键。
•不同金属离子可以与氨基酸中的氨基或羧基发生不同的配位反应。
氨基酸与金属离子的配位方式1.单配位方式•这种方式下,金属离子与氨基酸的一个区域配位,形成一个配位键。
2.双配位方式•这种方式下,金属离子同时与氨基酸中的两个区域配位,形成两个配位键。
3.多配位方式•这种方式下,金属离子与氨基酸的多个区域配位,形成多个配位键。
氨基酸与金属离子的配位类型1.配位键的种类•配位键可以是共价键或离子键。
•共价键:金属离子与氨基酸中的某个原子共享电子对。
•离子键:金属离子通过电荷引力与氨基酸中的某个原子形成键。
2.配位键的强度•配位键的强度与氨基酸的化学性质和金属离子的电子结构有关。
•配位键的强度可以影响配位反应的速度和平衡常数。
氨基酸与金属离子的生物功能1.酶活性•在生物体内,很多酶活性依赖于金属离子的催化作用。
•氨基酸与金属离子的配位可以调控酶的催化活性和特异性。
2.结构稳定性•氨基酸与金属离子的配位可以增强蛋白质的结构稳定性。
•配位反应可以形成内部稳定的金属蛋白质结构。
3.信号传递•氨基酸与金属离子的配位可以参与细胞信号传递的过程。
•配位反应可以改变细胞内金属离子的浓度和分布。
结论氨基酸与金属离子之间的配位机理是生物体内多种重要生命过程的基础。
通过配位反应,金属离子与氨基酸的配位键可以影响酶活性、结构稳定性和信号传递等生物功能。

第26卷第3期Vol.26,No.3滨州学院学报Journal of Binzhou U niversity2010年6月J un.,2010氨基酸席夫碱金属配合物的研究进展收稿日期:2010-01-04 修回日期:2010-03-21基金项目:滨州学院青年人才创新工程科研基金项目(BZXYQNL G200704)作者简介:张 然(1982—),女,山东单县人,助教,硕士,主要从事氨基酸衍生物金属配合物研究,E Οmail :zhangran19820724@.张 然(滨州学院材料化学研究所,山东滨州256603) 摘 要:概述了近年来国内外在氨基酸席夫碱金属配合物领域的研究,探讨了氨基酸席夫碱配合物与DNA 之间作用机理,并对该领域的研究前景作出展望. 关键词:氨基酸席夫碱;金属配合物;DNA 中图分类号:O 621 文献标识码:A 文章编号:1673-2618(2010)03-0074-050 引言氨基酸是重要的生理活性物质,是生物体内合成蛋白质、激素、酶及抗体的原料,在生物体内参与多种生物化学过程.除作为肽及蛋白质的合成原料外,氨基酸其他形式的衍生物如氮取代或碳取代的酸、酯、酰胺、酰肼、盐以及金属配合物等大多也具有生物及生理活性[1-2].氨基酸等小分子生物配体的金属配合物不但具有重要生物功能,而且往往也是金属蛋白、金属酶等生命大分子配合物为维持其结构和功能所必需的活性中心[3].因此研究它们与金属元素的配位行为对金属氨基酸配合物体系的进一步完善和发展,也对金属离子在体内的存在形式和作用机理以及蛋白质的构效关系的认识有着重要的意义.近20多年来氨基酸席夫碱金属配合物的研究引起了许多化学工作者的兴趣,并报道了不少研究成果,主要涉及配合物的合成、结构和性质研究,且包括了大部分过渡金属离子[2-36].1 过渡金属氨基酸席夫碱配合物近年来,由于氨基酸的特殊结构,使其形成的氨基酸席夫碱及金属配合物研究领域显得尤为活跃.氨基酸席夫碱是指利用各种氨基酸与带有羰基的不同醛或酮进行反应得到的含有C =N 结构的产物.它是一类非常重要的被修饰了的氨基酸配体,其特点是含有多个强电负性的配位原子(N 、O ),具有较强的配位能力和多样的配位方式.当氨基酸席夫碱与过渡金属发生反应时,配体易通过亚胺上的氮、羧基上的氧与金属原子形成较稳定的五元、六元螯合环,文献已报道了大量的配合物及晶体结构[2-6].这些金属配合物可以作为研究维生素B6酶反应的优良模型[7],并对生物无机化学和医药方面有着重要的意义,其抗肿瘤药物活性比一般的席夫碱有机化合物效果更为明显,已经有人研究了这类配合物与DNA 的相互作用[28-32].毕思玮等[8]合成了氨基酸系列水杨醛席夫碱与Cu (Ⅱ)配合物,比较了配合物的抗菌活性与稳定性、结构间的关系,结果表明,抗菌活性随配体中氨基酸残基非配位基R 的增大而减小,这说明随稳定性的提高,抗菌活性减小.王忠等[9]合成了4-氯苯甲醛缩甘氨酸席夫碱的Co (Ⅱ)、Cu (Ⅱ)、Zn (Ⅱ)、Ni (Ⅱ)配合物,并测定分析了其组成与结构,抗菌活性实验表明,4种配合物对浅部真菌都有较强的抗菌作用.Casella 等[10]也合成了一系列不对称O 2载体模型化合物:Co (Sal ΟL ΟAA ),Co (Pdx ΟL ΟAA ),(Sal =水杨醛,Pdx =吡哆醛,AA =第3期张 然 氨基酸席夫碱金属配合物的研究进展丙氨酸、缬氨酸、苯丙氨酸、组氨酸).氨基酸及其衍生物的锌配合物抗菌活性的研究报道较多,其他应用报道较少.刘兴荣[11]等合成了5-硝基水杨酸缩甘氨酸schiff碱与Zn(Ⅱ)的配合物,并进行了抑菌活性实验,表明Zn(Ⅱ)配合物对枯草杆菌、杂色霉菌有抑菌活性.毕思玮等[12]合成了亮氨酸水杨醛席夫碱及其锌(Ⅱ)的配合物,进行了表征,并测定了配合物的稳定常数,抗菌活性实验表明,配合物的抗菌活性优于配体抗菌活性.范谦等[13]合成了组氨酸席夫碱Mn(Ⅱ)配合物,表征分析了其结构,并研究了该配合物对环己烯烯丙位氧化的催化性能,考察了温度、时间、溶剂、氧压力等因素对反应的影响.V.ParedesΟGarcía等[14]利用5-溴水杨醛和甘氨酸缩合的产物与Fe(NO3)3在甲醇溶液中形成配合物,甘氨酸中两个羧基氧分别与两个铁离子配位,起到桥联的作用.同时,甘氨酸中氨基氮原子和水杨醛中酚氧原子以及配位水中氧原子与铁离子形成六配位的变形八面体构型.2 稀土氨基酸席夫碱配合物通常是利用稀土盐与氨基酸席夫碱在醇溶液中反应制得,由于在碱性条件下稀土离子易沉淀,所以很难获得晶体.近年来,浙江大学的姚克敏课题组已对稀土氨基酸席夫碱配合物的研究做了大量的工作[15],并发现它们具有较好的催化性能.如配合物[LnCu2(H2T AL Y)(NO3)5](NO3)2・n H2O (H2T AL Y为4甘醇醛缩双赖氨酸席夫碱)可在不加助催化剂时单独催化聚合甲基丙烯酸甲酯(MMA),转化率可高达100%.3 还原型氨基酸席夫碱配合物氨基酸席夫碱及其配合物的生物活性研究,前人已经做了不少的工作[10-18].为了克服这类物质由于C=N双键的刚性而稳定性差的弱点,在保证活性基因的情况下,将席夫碱配体中的C=N双键还原为C-N单键.这使其结构具有更好的柔韧性,对于寻求稳定的模型配合物或高效低毒的杀菌药物等均有重要意义.从文献[18-22]来看,还原型氨基酸席夫碱配合物的研究大多集中于配合物的结构测定等表征,而对所合成的配合物的生物活性及活性影响因素的研究报道较少.胡久荣等[23]以水杨醛通过苯丙氨酸氨基的反应对其进行修饰,选择生命必须微量元素Cu(Ⅱ)作为中心离子,在乙醇和水的混合溶剂中合成了3种配合物,[Cu (Hsp he)(p hen)](ClO4)・3H2O、[Cu(Hsp he)(2, 2′Οbip y)](ClO4)、[Cu(Hsp he)(2,2′Οbipy)] (NO3).(Hsp he=N-(2-羟苄基)-DL-α-苯丙氨酸根,p hen=1,10-邻菲咯啉,2,2′-bipy= 2,2′-联吡啶),并对配合物的晶体结构及其抑菌活性进行了研究.4 氨基酸席夫碱配合物与DNA之间作用研究 DNA是由大量脱氧核糖核酸组成的大分子,其中的戊糖和磷酸基起着结构性的作用,而碱基则起着携带遗传信息的作用.配合物与DNA的结合按化学键来划分主要有共价键和非共价键两种,其中非共价键对了解金属配合物的抗肿瘤活性和其与DNA作用模式之间的关系起着非常重要的作用,主要包括3种方式:静电作用、沟面作用和插入作用[24-28].(1)静电作用.核酸是一种带负电荷的多聚阴离子,通常以钠盐形式存在.金属离子及许多配合物带有正电荷,因此它们可以与核酸在外层通过静电发生作用.(2)沟面作用.配合物结合在DNA的沟面,主要靠碱基疏水起稳定作用.(3)插入作用.配合物以含有平面芳香杂环的配体插入相重叠,通过Π-Π堆积作用相互结合.最近,发现氨基酸席夫碱的三元配合物对DNA有较好的插入或部分插入作用[29-31],因此这类配合物有可能成为新的DNA切割剂或抗癌和抗病菌药物,在医学上有着潜在的应用前景.研究氨基酸席夫碱的配合物与DNA相互作用有重要意义.利用紫外光谱方法检测DNA与配合物之间的相互作用是最常用的分析方法,增色效应和减色效应是与DNA双螺旋结构和空间构型密切相关的特有光谱性质,增色效应是配合物与DNA中碱基基团配位,DNA双螺旋结构改变的结果;而减色效应是化合物与DNA中磷酸基团静电作用,使DNA发生空间轴向收缩的结果[32-33].57滨州学院学报第26卷图1是配合物[YbL (H 2O )](NO 3)2・2H 2O (HL 即香兰素缩赖氨酸席夫碱)在不同DNA 浓度下的电子光谱[34],紫外光谱显示加入DNA 后,该配合物在280nm 、310nm左右的吸收峰强度均增(1)r =0,(2)r =0.30,(3)r =0.60,(4)r =1.19;r =c DNA /c M图1 DNA 对配合物[YbL (H 2O )](NO 3)2・2H 2O紫外光谱的影响强,且280nm 处的吸光度(A )随着DNA 与配合物浓度比(r =c DNA /c M )的增大而不断增强.配合物吸收峰的增强可能是由于磷酸基团上所带负电荷与稀土阳离子发生静电结合,使配合物在DNA 表面分子发生长距离自组装[35].5 展望及结论氨基酸席夫碱配合物的合成、晶体结构和结构特性与物质分子性质或生物活性或材料的定量关系,涉及生物学、配位化学、医学等学科领域中所关注的热点,亟待研究.由于含多功能基席夫碱配体及其配合物在立体化学、结构学、异构现象、磁学、光谱学、动力学和反应机理、配位反应、分析化学、催化、稳定剂、染料和颜料、摄影、电光显示以及农业等领域都有着重要的作用,而目前还未见有在氨基酸席夫碱配体中引入多功能基的研究的报道,因此此领域应该是将来的研究热点[36].总结了近几年过渡金属,稀土金属以及还原性氨基酸配合物的研究进展,重点讨论氨基酸席夫碱配合物与DNA 之间作用机理,并对氨基酸配合物领域的研究前景作出展望.氨基酸作为生物体内重要的生物活性组分,其金属配合物的结构与生物性能之间的关联是广大氨基酸工作者的研究热点.参 考 文 献:[1] Andrew St reitwieser J r ,Clayton H Heat hcock.Int roduction to organic chemist ry[M ].New Y ork :Macmillan Publishing Company ,1992.[2] 郭应臣,邱东方,包晓玉,等.L Ο苏氨酸铜(Ⅱ)超分子配合物的合成、晶体结构及性质[J ].化学通报,2010(1):79-82.[3] 倪嘉缵.稀土生物无机化学[M ].北京:科学出版社,1995.[4] 刘峥,王渊,葛彩叶.电有机合成3,5-二溴水杨醛缩丝氨酸过渡金属配合物的研究[J ].应用化工,2009,38(7):1017-1021.[5] 陈蔷薇,倪伟双,吴夏冰,等.氨基酸-镧配合物的合成及单晶培养研究[J ].广州化工,2009,37(6):126-127.[6] 耿杰,于海佳,张海元,等.稀土氨基酸配合物与核酸的相互作用[J ].化学进展,2009(5):866-871.[7] 祝振富,黎植昌.氨基酸Schiff 碱金属配合物的研究进展[J ].氨基酸和生物资源,1997(1):31-35.[8] 毕思玮,刘树祥.氨基酸水杨醛席夫碱与Cu (Ⅱ)配合物的合成及其抗菌活性和稳定性、结构间的关系[J ].无机化学学报,1996,12(4):423-425.[9] 王忠,吴自慎,严振寰.4-氯苯甲醛甘氨酸席夫碱及其Cu (Ⅱ)、Zn (Ⅱ)、Co (Ⅱ)、Ni (Ⅱ)配合物合成、表征及抗菌活性研究[J ].华中师范大学学报,1995,29(2):197-201.[10] Casella L ,Gullotti M.Synt hesis ,stereochemist ry ,and oxygenation of cobalt (Ⅱ)Οpyridoxal modelcomplexes :A new family of chiral dioxygen carriers[J ].Inorg Chem ,1986,25(9):1293.[11] 刘兴荣,刘培漫,李明霞,等.Co (Ⅱ)、Ni (Ⅱ)、Cu (Ⅱ)和Zn (Ⅱ)的5-硝基水杨酸缩甘氨酸Schiff 碱配合物的合成及表征[J ].山东医科大学学报,1995,33(3):257-259.6777第3期张 然 氨基酸席夫碱金属配合物的研究进展[12] 毕思玮,李桂芝.亮氨酸水杨醛席夫碱及其锌(Ⅱ)的配合物的合成、稳定性和抗菌活性[J].四川师范学院学报,1996,17(3):54-57.[13] 范谦,黎耀辉,程克梅.组氨酸席夫碱锰配合物的合成及环己烯催化氧化[J].四川大学学报,2001,38(2):230-234.[14] ParedesΟGarcía V,VenegasΟYazigi D,Latorre R O,et al.Elect ronic properties of mixed valence i2ron(Ⅱ,Ⅲ)dinuclear complexes wit h carboxylate bridges[J].Olyhedron,2006,25:2026-2032.[15] 姚克敏,李宁,黄巧虹.L n(Ⅲ)-Cu(Ⅱ)与直链醚-氨基酸新型schiff碱异核配合物的合成和催化[J].中国科学(B缉),1998,28(6):517.[16] 毕思伟,高恩庆,田君濂.N-亚水杨基氨基酸3d金属配合物的合成、表征和抑菌活性[J].应用化学,1995,12(6):13-16.[17] L uo Zengwei,Li Baohua,Fang Xiantao,et al.Novel chiral solvating agent s derived from nat ural a2mino acid:enantiodiscrimination for chiral aΟarylalkylamines[J].Tet rahedron Letters,2007,48: 1753-1756.[18] K oh L L,Ranford J D,Robinson W T,et al.Model for t he reduced Schiff base intermediate be2tween amino acids and Pyridoxal:copper(Ⅱ)co mplexes of N-(2-Hydroxybenzyl)amino acids wit h no npolar side chains and t he crystal st ruct ures of[Cu(N-(2-hydroxybenzyl)-d,l-ala2 nine)(p hen)]・H2O and[Cu(N-(2-hydroxybenzyl)-d,l-alanine)(imidazole)][J].Inorg Chem,1996,35:6466-6472.[19] Ranford J D,Vittal J J,Wu D.Topochemical Conversion of a hydrogenΟbonded t hreeΟdimensionalnetwork into a covalently bonded f ramework[J].Angew Chem Int Ed,1998,37:1114-1116.[20] Ranford J D,Vittal J J,Wu D.Thermal conversion of a helical coil into a t hreeΟdimensional chiralf ramework[J].Angew Chem Int Ed,1999,38:3498-3501.[21] Yang C T,Moubaraki B,Vittal J J,et al.Synt heses,st ruct ural properties and catecholase activityof copper(Ⅱ)complexes wit h reduced Schiff base N-(2-hydroxybenzyl)-amino acids[J].J Chem Soc,Dalton Trans,2004:113-121.[22] Yang C T,Moubaraki B,Murray K S,et al.Synt hesis,characterization and properties of ternarycopper(Ⅱ)complexes containing reduced Schiff base N-(2-hydroxybenzyl)-α-amino acids and1,10-p henant hroline[J].J Chem Soc,Dalton Trans,2003(5):880-889.[23] 胡久荣,梁福沛,陈自卢,等.铜(Ⅱ)-N-(2-羟苄基)-DL-α-苯丙氨酸-2,2′-联吡啶(或1,10-邻菲咯啉)三元配合物的合成、晶体结构及抑菌活性[J].无机化学学报,2006,22(11):1989-1995. [24] Pyle A M,Rehmann J P,Meshorer R,et al.MixedΟligand complexes of rut henium(Ⅱ):factorsgoverning binding to DNA[J].J Am Chem Soc,1989,111:3051-3058.[25] Wade W S,Derron P B.Alteration of t he sequence specificity of distamycin on DNA by replace2ment of an NΟmet hylpyrrolecarboxamide wit h pyridine-2-carboxamide[J].J Am Chem Soc, 1987,109:1574.[26] Wilson D,Wang YH,Kusuma S,et al.Binding st rengt h and specificity in DNA interactions:t hedesign of tdot.T specific intercalators[J].J Am Chem Soc,1985,107(17):4989-4995. [27] Ibanez V,Geacintor N E,Gagiano A G,et al.Physical binding of tet raols derived f rom7,8-di2hydroxy-9,10-epoxybenzo[a]pyrene to DNA[J].J Am Chem Soc,1980,102(17):5661-5666.[28] 胡亚敏,王兴明,张欢.金属配合物与DNA相互作用的研究进展[J].化学与生物工程,2007,24(8):1-4.87滨州学院学报第26卷[29] Chikira M,Tomizawa Y,Fukita D,et al.DNAΟfiber EPR st udy of t he orientation of Cu(Ⅱ)com2plexes of1,10-p henant hroline and it s derivatives bound to DNA:mono(p henant hroline)-cop2 per(Ⅱ)and it s ternary complexes wit h amino acids[J].J Inorg Biochem,2002,89(1):163-173.[30] 李红,乐学义,计亮年.邻菲咯啉-铜(Ⅱ)-L-亮氨酸配合物与DNA的结合[J].化学通报,2003,66(12):847-850.[31] 李红,乐学义,吴建中.铜(Ⅱ)邻菲咯啉蛋氨酸配合物与DNA相互作用的研究[J].化学学报,2003,61(2):245-250.[32] 张朝红,臧树良,耿兵,等.紫外和圆二色光谱法研究丁基锡化合物与牛血清白蛋白的相互作用[J].分析科学学报,2005,21(2):179.[33] 张朝红,苏欣,臧树良,等.用紫外光谱和荧光光谱研究三丁基锡化合物与脱氧核糖核酸的相互作用[J].分析科学学报,2006,22:267-270.[34] 陆晓红,林秋月,贺新前,等.稀土-香兰素缩赖氨酸席夫碱配合物的合成、表征及其与DNA作用的研究[J].中国稀土学报,2006,24(4):403-407.[35] 郭东方,何疆,曾正志.肉桂酸-邻菲罗啉-稀土三元配合物对DNA作用的光谱研究[J].中国稀土学报,2004,22(2):55-60.[36] 高恩君,赵淑敏,刘祁涛.混合配体配合物钯(Ⅱ)-联喹啉-苯乙基丙二酸根与DNA作用研究[J].无机化学学报,2004,20(2):191-194.R esearch Advances in Amino Acid Schiff B ase Metal ComplexesZHAN G Ran(I nstit ute of M ateri al Chemist ry,B i nz hou Universit y,B i nz hou256603,Chi na)Abstract:The research on metal complexes of amino acid schiff base in recent years is overviewed. The f unction of interactio n of metal complexes and DNA is also presented,and t he perspective in t his field is p ropected as well.K ey w ords:amino acid Schiff base;metal complexes;DNA(责任编辑:贾晶晶)。
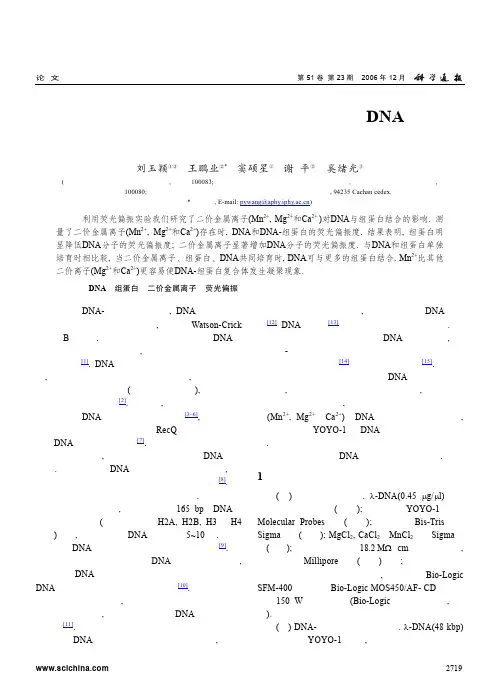
论文第51卷第23期 2006年12月利用荧光偏振研究二价金属离子对DNA与组蛋白结合的影响刘玉颖①②王鹏业②*窦硕星②谢平②奚绪光③(①中国农业大学理学院应用物理系, 北京 100083; ②中国科学院物理研究所软物质物理实验室, 北京凝聚态物理国家实验室, 北京 100080; ③法国国家科学研究中心应用生物技术与基因药理学实验室, 94235 Cachan cedex.*联系人, E-mail: pywang@)摘要利用荧光偏振实验我们研究了二价金属离子(Mn2+, Mg2+和Ca2+)对DNA与组蛋白结合的影响. 测量了二价金属离子(Mn2+, Mg2+和Ca2+)存在时, DNA和DNA-组蛋白的荧光偏振度. 结果表明, 组蛋白明显降低DNA分子的荧光偏振度; 二价金属离子显著增加DNA分子的荧光偏振度. 与DNA和组蛋白单独培育时相比较, 当二价金属离子、组蛋白、DNA共同培育时, DNA可与更多的组蛋白结合. Mn2+比其他二价离子(Mg2+和Ca2+)更容易使DNA-组蛋白复合体发生凝聚现象.关键词DNA 组蛋白 二价金属离子 荧光偏振在许多DNA-蛋白质复合体中, DNA分子双螺旋由于弯曲、拉伸、扭曲而变形, 不再呈Watson-Crick 经典的B型结构. 尽管人们认为蛋白质结合到DNA分子上可诱导这些形变发生, 但是对其作用机制人们还知之甚少[1]. DNA这种类似圆柱形且具有弹性的分子, 其内部弯曲、扭转以及整体的旋转, 都可以通过对它标记合适荧光染料(例如嵌入式染料), 然后测量荧光偏振度进行研究[2]. 近年来, 一些研究者利用荧光偏振监测DNA与蛋白质的结合情况[3~6], 例如荧光偏振已经用于埃希氏大肠杆菌RecQ解旋酶与单链和双链DNA结合特性的研究[7].真核生物中, 形成染色质时组蛋白与DNA紧密结合. 染色质是由DNA和蛋白质构成的复合物, 真核生物细胞核中的遗传物质被包装在染色质中[8]. 染色质复合物控制了基因活性和性状遗传. 染色质的基本亚单位是核小体, 其结构为约165 bp的DNA围绕组蛋白八聚体(由两组组蛋白H2A, H2B, H3和H4构成)两周, 这样导致了DNA被压缩了5~10倍. 染色质蛋白和DNA共同控制细胞内遗传物质的活动[9].溶液离子环境的变化对DNA结构有显著影响, 正确认识DNA结构对溶液环境依赖敏感性对阐明DNA结构和功能的关系是很必要的[10]. 二价金属离子广泛存在于活体内, 对生物器官维持正常的功能起着重要的作用, 金属离子可作为DNA功能的潜在调节器[11].由于DNA与组蛋白两者均为生物大分子, 它们之间的相互作用非常复杂, 如金属离子对DNA的结构[12]、DNA的凝聚[13]等因素都对其有重要的影响. 已有多种方法用于研究金属离子对DNA结构的影响, 例如紫外-可见分光光度测定法、圆二色谱、核磁共振谱、沉降平衡测量法[14]以及分子梳技术等[15].为了定量地研究金属离子对DNA与组蛋白结合的影响, 我们使用快速反应停流装置系统, 报道了一种新的定量研究方法, 该方法用于测量二价金属离子(Mn2+, Mg2+和Ca2+)对DNA与组蛋白结合的影响, 基于观测标有YOYO-1的DNA分子荧光偏振度的变化. 因此,荧光偏振实验提供了一种快速、重复性好、精确的方法用于检测DNA与组蛋白的相互作用.1材料与方法(ⅰ) 实验材料和仪器. λ-DNA(0.45 μg/μl)购自华美生物工程公司(中国); 荧光染料YOYO-1购自Molecular Probes公司(美国); 组蛋白和Bis-Tris购自Sigma公司(美国); MgCl2, CaCl2和MnCl2购自Sigma公司(美国); 所有的缓冲液由18.2 MΩ・cm高纯度水配制, 高纯度水由Millipore系统(法国)获得; 快速反应停流装置系统用于测量荧光偏振度, 它包含着Bio-Logic SFM-400混合器、Bio-Logic MOS450/AF- CD光学系统、150 W的氙汞灯源(Bio-Logic科学仪器公司, 法国).(ⅱ) DNA-组蛋白复合体的制备. λ-DNA(48 kbp)用荧光染料YOYO-1标记, 碱基对与染料分子之比第51卷 第23期 2006年12月论 文为10:1, 制备过程请参见文献[15]. 用Bis-Tris 缓冲 液(50 mmol/L, pH ≈6.6)稀释组蛋白溶液. 组蛋白浓度是DNA 的10~500倍. DNA/YOYO-1溶液(6.5 pmol/L)和稀释后的组蛋白溶液共同保温(37℃)培育3 h, 反应液体积为2 mL.(ⅲ) DNA-金属离子复合体溶液的制备. DNA- Mn 2+复合体的制备步骤是DNA/YOYO-1溶液(6.5 pmol/L)与MnCl 2共同保温(37℃)培育3 h. DNA-Mn 2+反应液体积为2 mL. MnCl 2溶液的浓度分别为10, 30,40和50 mmol/L. DNA-Ca 2+和DNA-Mg 2+复合体的制备步骤与DNA-Mn 2+复合体的制备步骤相同. CaCl 2和MgCl 2的浓度为50 mmol/L.(ⅳ) DNA-金属离子-组蛋白复合体溶液的制备. DNA-Mn 2+-组蛋白复合体的制备步骤是DNA, MnCl 2和组蛋白共同保温(37℃)培育3 h. DNA-Mn 2+-组蛋白反应液体积为2 mL. DNA-Ca 2+-组蛋白和DNA-Mg 2+- 组蛋白复合体的制备步骤与DNA-Mn 2+-组蛋白复合 体的制备步骤相同. 每种DNA-金属离子-组蛋白复 合体反应液体积为2 mL.(ⅴ) 荧光偏振度测量. MOS-450/CD 包括一个标 准的荧光偏振度测量模式. 该方法对激发光(100 kHz) 极性快速调制, 同步检测荧光强度, 以达到对样品的 偏振极化度准确快速的测量. 该方法不需机械的极 性化调节, 也不需G-因子校正, 只需要一个光电倍 增管. 荧光偏振度的值可以在单通带测量中获得. 在 测量荧光偏振度时, 光弹性调制器自动设置在半波 长模式, 这样激发光在水平分量和垂直分量之间以100 kHz 的频率转换. 应用Bio-Kine 软件(Bio-Logic) 通过两个散射信号实时计算荧光强度和荧光偏振度. 光调制器使激发光在竖直和水平两个偏振方向上依次变化. 在观测方向(y 轴方向)同时检测两个偏振方 向的光, 例如当激发光偏振方向为竖直方向时, 同时 检测偏振方向沿着z 轴和x 轴的散射光强I vv 和I vh [16],即 I v =I vh +I vv , (1)若激发光偏振方向为水平时, 检测到的信号为 I h =2×I vh , (2)由计算荧光偏振度的公式(I vv 和I vh )可以得到荧光偏振度A :A =(I vv −I vh )/(I vv +2×I vh )=(I v −I h )/(I v +0.5×I h ), (3)因此本实验中计算荧光偏振度的公式为A =(I v − I h )/(I v +0.5×I h ). (4) 2 结果2.1 组蛋白对DNA 荧光偏振度的影响荧光偏振实验广泛应用于测量高结合力的蛋白 质-核酸以及蛋白质-蛋白质相互作用. 溶液中的分子, 其分布是随机的, 而且从吸收光到发射光的时间内, 分子本身已经产生了转动, 荧光偏振度要降低; 因此 它是一种对分子大小很灵敏的探测手段. 用平面偏 振光去激发一个荧光系统, 可以产生偏振荧光. 通过 分析偏振荧光从而确定分子的大小、形状和流动性等 性质.组蛋白能降低λ-DNA 分子的荧光偏振度, 如图1(a). 组蛋白的浓度为DNA 的10~500倍, 随着组蛋白浓度的增加, 与对照组DNA 分子相比较, DNA-组 蛋白复合体的荧光偏振度显著降低.图1 (a) DNA-组蛋白复合体荧光偏振度随组蛋白与DNA 浓度比变化关系曲线; (b) DNA-Mn 2+复合体荧光偏振度随Mn 2+浓度变化关系曲线[DNA] = 6.5 pmol/L论 文第51卷 第23期 2006年12月在溶液中单独存在时, DNA 分子随机卷曲且有弹性[17], 此构型对应着一定的偏振度值. 在我们的实验条件下, DNA 分子的荧光偏振度在0.11左右. 实验结果表明组蛋白使DNA 分子发生凝聚; DNA-组蛋白分子可能呈现更紧密、更小的构型, 导致复合体分子比DNA 分子旋转更快, 对应较小的荧光偏振度值. 当组蛋白浓度为DNA 的500倍时, DNA-组蛋白复合体的偏振度为0.08, 如图1(a). 我们推断, 在此实验条件下, 荧光偏振度降低主要取决于DNA-组蛋白复合体分子构型的变化, 复合体质量的增加对偏振度影响不大, 可能由于组蛋白在此实验条件下不是以八聚体与DNA 结合的结果. 组蛋白以几聚体与λ-DNA 结合还需通过其他方法(如原子力显微观察)进一步验证.2.2 二价金属离子(Mn 2+, Mg 2+和Ca 2+)对DNA 荧光偏振度的影响Mn 2+显著增加λ-DNA 的荧光偏振度. 当Mn 2+浓度为50 mmol/L 时, 与对照组DNA(偏振度为0.107)相比较, DNA-Mn 2+荧光偏振度增加到0.152, 如图1(b). 拉曼光谱表明过渡金属离子(Mn 2+, Co 2+和Cu 2+)导致DNA 结构发生大的变化, 过渡金属离子对长的DNA 分子结构破坏能力较强; 这些金属离子主要与碱基对作用, 与磷酸骨架作用较弱[14]. 有观察表明二价金属离子(Mg 2+, Mn 2+和Cu 2+)可以诱导DNA 分子发生凝聚现象[18,19].为了研究二价金属离子、DNA 和组蛋白相互作用的快慢, 我们还进行了瞬时反应动力学观察. 当二价金属离子(Mg 2+, Ca 2+和Mn 2+)加入DNA 溶液的瞬间, 它们立即显著增加DNA 分子的荧光偏振度. DNA, 组蛋白和金属离子的相互作用, 开始是一个较快的反应过程, 混合的瞬间就有显著的变化, 然后是一个慢反应过程, 经过较长时间后趋于稳定(数据没有给出). 所以在每个荧光偏振实验中, 反应时间均为3 h.在荧光偏振实验中, 这三种金属离子(Mg 2+, Ca 2+和Mn 2+)的浓度均为50 mmol/L, 它们都能显著增加DNA 分子的荧光偏振度; Mn 2+效果最显著, 如图2. 我们推断这些二价金属离子可能使DNA 分子聚集在一起, 质量变大, 从而荧光偏振度增加. 有研究表明, 与碱基对有较高亲和力的金属离子容易引起DNA 聚集[14], 这三种金属离子与DNA 结合位点不同, 例如Mg 2+和Ca 2+主要与磷酸骨架结合, 能够中和一部分戊糖磷酸骨架上的负电荷; Mn 2+主要与富含电子结合位点的碱基对作用, 导致这三种离子对DNA 荧光偏振度影响不同.图2 DNA-金属离子复合体荧光偏振度[DNA]=6.5 pmol/L, [离子] =50 mmol/L在以前的实验中, 我们利用分子梳技术和荧光显微术直接观察到Mn 2+易导致DNA 分子聚集在疏水表面上[15]. 通过荧光偏振实验我们有力地证实了Mn 2+导致DNA 聚集确实在溶液中就已经发生. 目前, Mn 2+导致DNA 凝聚的机制仍然没有完全明确, 还需进一步研究.2.3 二价金属离子(Mn 2+, Mg 2+和Ca 2+)对DNA 与组蛋白结合的影响Mn 2+显著加强DNA 与组蛋白的结合. 我们实验了Mn 2+浓度为0~50 mmol/L 的情况下, 它对DNA 与组蛋白结合的影响. 当Mn 2+浓度为 5 mmol/L 或10 mmol/L 时, DNA-组蛋白-Mn 2+复合体的荧光偏振度明显低于DNA-组蛋白复合体(组蛋白与DNA 浓度比为100)的. 该现象表明当Mn 2+存在时, DNA-组蛋白复合体凝聚得更紧密, 具有更小的荧光偏振度; 与分子梳观察结果一致. Mn 2+促进DNA 与组蛋白结合, 如图3. 随着Mn 2+浓度逐渐增加, DNA-组蛋白-Mn 2+复合体的荧光偏振度相应增大. 尤其是当Mn 2+浓度大于30 mmol/L 时, DNA-组蛋白-Mn 2+复合体的荧光偏振度大于DNA-组蛋白复合体, 如图 3. 我们推论Mn 2+浓度越高, 则更多的DNA-组蛋白-Mn 2+复合体分子紧密聚集在一起. 因此我们提出了DNA-组蛋白、DNA-组蛋白-Mn 2+两种相互作用模型, 如图4.在相同的实验条件下, 我们同时研究了Mg 2+, Ca 2+和Mn 2+对DNA 与组蛋白结合的影响. 在离子浓度为5 mmol/L 时, DNA-组蛋白-Mg 2+, DNA-组蛋白-第51卷 第23期 2006年12月论 文Ca 2+和DNA-组蛋白-Mn 2+的荧光偏振度均低于DNA-组蛋白复合体的; 其中Mn 2+效果最显著, 如图 5. 我们推断这三种金属离子对DNA 与组蛋白结合起着相似的作用, 它们都可以加强DNA 与组蛋白结合.图3 DNA-组蛋白-Mn 2+复合体荧光偏振度随Mn2+浓度变化关系曲线[DNA] = 6.5 pmol/L, [组蛋白] = 650 pmol/L图4 组蛋白、Mn 2+与DNA 结合的示意图图5 DNA, DNA-组蛋白和DNA-组蛋白-金属离子复合体的荧光偏振度曲线[DNA] = 6.5 pmol/L, [组蛋白] = 650 pmol/L, [Mg 2+] = [Ca 2+] = [Mn 2+] =5 mmol/L当Mg 2+和Mn 2+存在时, 染色质构型会发生显著的变化, 可能是核小体长链排列成超螺旋高度压缩的形式[20]. 通过实验, 我们证实了二价金属离子可能改变了DNA 分子的构型, 这种构型更有利于DNA 分子与组蛋白结合; 同时, 这些金属离子(Mn 2+, Mg 2+和Ca 2+)易于使DNA-组蛋白复合体凝聚.分子梳技术可以很好地用于定性或半定量研究DNA 与蛋白质分子的相互作用及其随金属离子浓度的变化情况. 当二价金属离子、组蛋白共同存在时, 成梳的DNA-组蛋白复合体分子凝聚在疏水表面上. Mn 2+导致DNA-组蛋白复合体在疏水表面上不易拉伸[15]. 加入Mn 2+后, DNA-组蛋白复合体呈现许多亮点分布在PMMA 表面上, 因此我们推断DNA-组蛋白复合体在溶液中凝聚更紧密, 以致在PMMA 表面不能被拉伸开. 但是, 仅仅利用分子梳技术, 我们不能准确地知道这些生物大分子在溶液中的相互作用机制.与分子梳技术相比较, 荧光偏振实验具有以下优点: 一种非常快速的、重复性好、灵敏度高、精确的定量测量方法. 它可以在较大的浓度范围内(0~50 mmol/L)研究金属离子和DNA 的作用. 更重要的是, 荧光偏振实验是在溶液环境中实时观测二价金属离子对DNA 与组蛋白结合的影响, 因此我们通过荧光偏振实验很好地定量证实了分子梳实验结果.3 结论我们利用荧光偏振实验研究了二价(Mg 2+, Ca 2+和Mn 2+)金属离子对DNA 与组蛋白结合的影响, 得出如下结论:(ⅰ) 组蛋白导致DNA 分子凝聚成更紧密、体积较小的构型; 而二价金属离子(Mn 2+, Mg 2+和Ca 2+)可能诱导DNA 分子构型发生变化或聚集在一起;(ⅱ) 当二价金属离子(Mn 2+, Mg 2+和Ca 2+)、组蛋白共同存在时, 这些二价金属离子显著促进DNA 与组蛋白的结合. Mn 2+较其他离子更易使DNA-组蛋白复合体发生凝聚. 复合体分子的荧光偏振度及其形成与组蛋白、二价金属离子的浓度以及培育时间有关. 荧光偏振实验是一种新奇的定量研究方法, 该方法能有效地观测二价金属离子(Mn 2+, Mg 2+和Ca 2+)对DNA 与组蛋白结合的影响. 该方法操作迅速、重复性好、灵敏度高, 且非常精确.论 文第51卷 第23期 2006年12月致谢 感谢法国国家科学中心(CNRS)奚绪光研究员的大力支持, 本工作受国家自然科学基金(批准号: 60025516, 10334100)和中国科学院创新工程项目资助.参 考 文 献1 Leger J F, Robert J, Bourdieu L, et al. RecA binding to a singledouble-stranded DNA molecule: A possible role of DNA conformational fluctuations. Proc Natl Acad Sci USA, 1998, 95: 12295—12299[DOI]2 Collini M, Chirico G, Bianchi M E, et al. Rotational diffusion offlexible DNA fragments by modulated fluorescence anisotropy. J lumin, 1997, 72-74: 585—586[DOI]3 Heyduk T, Lee J C. Application of fluorescence energy transfer andpolarization to monitor Escherichia coli cAMP receptor protein and lac promoter interaction. Proc Natl Acad Sci USA, 1990, 87: 1744—1748[DOI]4 Guest C R, Hochstrasser R A, Dupuy C G. Interaction of DNA withthe Klenow fragment of DNA polymerase I studied by time-resolved fluorescence spectroscopy. Biochemistry, 1991, 30: 8759—8770[DOI]5 Rusinova E, Tretyachenko-Ladokhina V, Vele O E, et al. Alexa andOregon Green dyes as fluorescence anisotropy probes for measuring protein-protein and protein-nucleic acid interactions. Anal Biochem, 2002, 308: 18—25[DOI]6 Bar-Ziv R, Libchaber A. Effects of DNA sequence and structure onbinding of RecA to single-stranded DNA. Proc Natl Acad Sci USA, 2001, 98: 9068—9073[DOI]7 Dou S X, Wang P Y , Xu H Q, et al. The DNA binding properties of theEscherichia coli RecQ helicase. J Biol Chem, 2004, 279: 6354—6363[DOI]8 Weaver R F. Molecular Biology. 2nd ed. Beijing: China SciencePress, 2002. 380—3879 Felsenfeld G, Groudine M. Controlling the double helix. Nature,2003, 421: 448—453[DOI]10 Madhumalar A, Manju B. Structural insights into the effect of hy-dration and ions on A-tract DNA: A molecular dynamics study. Biophys J, 2003, 85: 1805—181611 Sun X G, Cao E H, Zhang X Y, et al. The divalent cation-inducedDNA condensation studied by atomic force microscopy and spectra analysis. Inorg Chem Commun, 2002, 5: 181—186[DOI]12 Chiu T K, Dickerson R E. 1 à crystal structures of B-DNA revealsequence-specific binding and groove-specific bending of DNA by magnesium and calcium. J Mol Biol, 2000, 301: 915—945[DOI] 13 Wissenburg P, Odijk T. Multimolecular aggregation in concentratedisotropic solutions of mononucleosomal DNA in 1 M sodium chlo-ride. Macromolecules, 1994, 27: 306—308 [DOI]14 Duguid J, Bloomfield V A, Benevides J, et al. Raman spectroscopyof DNA-metal complexes. I. Interactions and conformational effects of the divalent cations: Mg, Ca, Sr, Ba, Mn, Co, Ni, Cu, Pd, and Cd. Biophys J, 1993, 65: 1916—192815 刘玉颖, 王鹏业, 窦硕星, 等. 利用分子梳技术研究金属离子对DNA 与组蛋白结合的影响. 科学通报, 2005, 50(9): 854—860 16 Canet D, Doering K, Dobson C M, et al. High-sensitivity fluores-cence anisotropy detection of protein-folding events: Application to a-lactalbumin. Biophys J, 2001, 80: 1996—200317 LeTilly V, Royer C A. Fluorescence anisotropy assays implicatedprotein-protein interactions in regulating trp repressor DNA binding. Biochemistry, 1993, 32: 7753—7758[DOI]18 Ma C, Bloomfield V A. Condensation of supercoiled DNA inducedby MnCl 2. Biophys J, 1994, 67: 1678—168119 Sun X G, Cao E H, Zhang X Y, et al. The divalent cation-inducedDNA condensation studied by atomic force microscopy and spectra analysis. Inorg Chem Commun, 2002, 5: 181—18620 Emonds A X, Houssier C, Fredericq E, Electric birefringence ofDNA and chromatin: Influence of divalent cations. Biophys Chem, 1979, 10: 27—39(2006-08-14收稿, 2006-10-24接受)。

二价金属离子与牛血清白蛋白的相互作用高兴军;郭明;李兵;郭建忠;李铭慧【期刊名称】《浙江农林大学学报》【年(卷),期】2013(030)005【摘要】采用荧光光谱法和紫外光谱法研究了5种二价金属离子与牛血清白蛋白(BSA)的相互作用,通过生物大分子猝灭反应机制和结合位点模型研究发现锌离子Zn2+,镍离子Ni2+,钴离子Co2+和钙离子Ca2+均可导致牛血清白蛋白内源荧光猝灭,Zn2+,Ni2+和Co2+离子半径处在正常范围,能有效进入牛血清白蛋白结合位点与牛血清白蛋白结合形成超分子配合物,使牛血清白蛋白的二级结构发生改变,主要表现为静态猝灭.Ca2+离子半径较大,受空间位阻影响不能有效进入结合位点对BSA二级结构影响较小,不能与BSA形成配合物,表现为动态猝灭;而Mg2+由于大的水合半径阻碍了Mg2+与牛血清白蛋白的有效碰撞,使电子或能量的转移受阻,从而导致Mg2+对牛血清白蛋白内源荧光无猝灭作用.【总页数】7页(P777-783)【作者】高兴军;郭明;李兵;郭建忠;李铭慧【作者单位】浙江农林大学理学院,浙江临安311300【正文语种】中文【中图分类】S852.5【相关文献】1.二价金属离子与牛血清白蛋白的相互作用 [J], 高兴军;郭明;李兵;郭建忠;李铭慧2.二价金属离子与YycFN相互作用的NMR研究 [J], 刘婷;刘买利;姜凌3.二价铅离子与牛血清白蛋白相互作用的荧光光谱研究 [J], 刘勇;王川;潘可亮;李树伟;杨利;郁中山4.牛血清白蛋白、柠檬酸根和二价金属离子对人红细胞和兔小肠刷状缘囊泡摄取稀土离子的影响 [J], 杨惠雯;王伟;李荣昌;王夔5.以金纳米粒子为探针研究二价金属离子与脂质双层膜的相互作用 [J], 刘小花; 白海鑫; 李永芳; 侯影因版权原因,仅展示原文概要,查看原文内容请购买。

氢氧化物沉淀[导读]一、氢氧化物沉淀原理;二、氢氧化铝的沉淀。
一、氢氧化物沉淀原理除少数碱金属外,大多数金属的氢氧化物都属难溶化合物。
因此,在湿法冶金实践中,最常用的金属沉淀法是中和水解生成难溶氢氧化物沉淀,其典型的沉淀反应为:(1)相应的金属氢氧化物的溶度积为:(2)又从水的离解平衡知:(3)于是可以得到金属氢氧化物的如下关系:(4)式中K sp-金属氢氧化物的溶度积;K w-水的离子积。
由上式可知,在一定温度下,金属氢氧化物沉淀形成的pH值由该金属离子的价态及其氢氧化物的溶度积决定。
若规定=1mol∕L时为开始沉淀,=10-5mol∕L时为沉淀完全,则由上式可求出相应于金属氢氧化物开始沉淀和沉淀完全的pH值。
一些常见金属氢氧化物的溶度积及沉淀的pH值列在下表中。
表常见金属氢氧化物25℃下的溶度积及沉淀的pH值金属氢氧化物溶度积K sp lgK sp完全沉淀的最低pH值Ag(OH)-7.71Al(OH)3-33.50 4.90Be(OH)2-21.30Ca(OH)2-5.19Cd(OH)2-14.35 9.40Co(OH)2-14.90 8.70Co(OH)3-44.50 1.60Cr(OH)3-29.80 5.60Cu(OH)2-19.32 7.40Fe(OH)2-15.10Fe(OH)3-38.80 3.20Mg(OH)2-11.15 11.00Mn(OH)2-12.80 10.10Ni(OH)2-15.20 7.45Ti(OH)4-53.0 <0Zn(OH)2-16.46 8.10对一种具体的金属离子,都存在一种水解沉淀平衡:(5)由此水解平衡可得到溶液中剩余金属离子活度与溶液pH值的下述关系:(6)上式表明金属氢氧化物的溶解特征是pH的函数。
式中的K是水解反应式(5)的平衡常数。
比较式(6)与式(4)可知lgK=lgK sp-nlgK w。
函数关系(6)可绘成沉淀图。
莫讷缪斯以溶液pH值为横坐标,溶液中金属离子活度的对数为纵坐标,得到如图1的曲线。

方兴未艾的手性化学张来新;朱海云【摘要】The importance of chiral synthesis and chiral resolution in chiral chemistry was briefly intro-duced.Emphases are put on threeparts:First,synthesis,resolution,and applications of new chiral com-pounds;Second,applications of aggregation-induced emission to chiral chemistry;Finally,applications of chiral chemistry in reaction mechanism research .Future developments of chiral chemistry are prospected in the end .%简要介绍了手性化学中的手性合成、手性拆分的重要性。
重点介绍了:①新型手性化合物的合成拆分及应用;②聚集诱导荧光在手性化学中的应用;③手性化学在反应机理研究中的应用。
并对手性化学的发展进行了展望。
【期刊名称】《应用化工》【年(卷),期】2016(045)011【总页数】3页(P2167-2169)【关键词】手性化学;手性合成;手性拆分;应用【作者】张来新;朱海云【作者单位】宝鸡文理学院化学化工学院,陕西宝鸡 721013;宝鸡文理学院化学化工学院,陕西宝鸡 721013【正文语种】中文【中图分类】TQ061.51手性化学是研究手性化合物的结构、制备、理化性质、相互转变及应用的一门科学,是化学学科中最基本的科学范畴之一。
手性化学既涉及医药、农药、香料、环境、材料等应用性很强的领域,也与生命起源、分子立体结构等基础研究相关,故一直是物理、化学、生命、材料等学科领域的热门课题。

化学实验设计新型氨基酸锌金属配合物的制备姓名:学号:年级:班级: 学院: 导师:目录摘要 (1)1. 前言 (1)2. 实验目的 (2)3. 实验原理 (2)4•实验设备 (2)5•实验材料及试剂 (3)5.1试剂的配制 (3)5.2材料的处理 (3)5.2.1反应时间的选择 (3)5.2.2反应温度的选择 (3)5.2.3配合物配比的选择 (3)6. 实验操作步骤 (4)7. 结果及计算 (4)8. 讨论 (5)8.1 L 一甘氨酸及甘氨酸锌为例的红外与拉曼光谱分析 (5)参考文献 (8)新型氨基酸锌金属配合物的制备摘要氨基酸是生物体内大量存在的一类生物配体,是蛋白质、酶等的基本结构单元,研究稀土及过渡金属与氨基酸的相互作用将为探索稀土及过渡金属在生物体内的代谢及其生物效应提供基础。
为此,近年来,稀土及过渡金属氨基酸配合物的研究一直为人们所重视,尤其是近十年来发展迅速。
本文概述了近年来锌金属的氨基酸配位化合物的研究,主要介绍了它的性质、运用以及发展等。
对氨基酸配合物的性质研究,主要集中在讨论此类配合物的稳定性和成键特征等方面。
关键词:氨基酸锌金属配合物制备1. 刖言氨基酸是生物体内大量存在的同时具有氨基和羧基的双官能团生命小分子配体,是构成生物体内蛋白质、酶的基本结构单元⑴,氨基酸金属配合物等小分子配合物不仅具有重要生物功能,而且也往往是金属蛋白,金属酶等生物大分子配合物为维持其结构和功能所必需的活性中心。
研究过渡金属与氨基酸的相互作用将为探索过渡金属在生物体内的新陈代谢及其生物效应提供基础[2]。
L 一甘氨酸,L 一丙氨酸,L 一苏氨酸是三种蛋白质氨基酸,表2.1是三种氨基酸的结构式及基本性质⑶。
本论文以上述三种氨基酸作为配体,讨论了其与锌盐(氯化锌,硫酸锌,硝酸锌)的配位反应。
表2」三种氨基酸的基本性质Table 2A The main properties of tbree amino acid名称缩写结构式pKo-Nlh答电点(Pl)分子量甘氨酸甘H^N-CHj-COOH ZU 5.9775 (glycine)(Gl%G)丙亂酸丙HjN-CHCOOH2J4w 6.00(alanine)(AUA)CH J苏規酸苏HjN—CH- COOTCH OH 2.099J0 5.60119(theronine)(Thr,n1CH3金属氨基酸配合物的合成是通过无机盐与氨基酸在一定条件下反应制得的,制备方法可归纳为液相反应合成法阵[4-5]、固一液相反应合成法⑹.固相反应合成法[7]及电解合成法[8]、相平衡合成法[9]等。
二价铁和二价铜离子反应1.引言1.1 概述引言本文将探讨关于二价铁和二价铜离子反应的相关性质和反应特点。
作为两种常见的金属离子,二价铁离子和二价铜离子在化学反应中展现出一系列独特的特性和行为。
本文将分别介绍二价铁离子和二价铜离子的性质和反应,探讨它们在化学反应中的变化规律,以及它们之间的反应特点。
同时,本文还将对二价铁和二价铜离子的反应潜在应用和进一步研究方向进行探讨。
通过本文的阐述,读者将对二价铁和二价铜离子的反应有一个更全面的了解。
首先,我们将从概述二价铁离子和二价铜离子的性质和反应开始。
通过对它们的电子结构、氧化还原性质和常见反应类型的分析,我们将了解到二价铁离子和二价铜离子在化学反应中起到的关键角色,并且理解它们在不同条件下的反应行为差异。
在此基础上,我们将进一步研究二价铁离子和二价铜离子之间的反应特点,探究它们之间的电化学反应、络合反应以及其他可能的反应机制。
最后,我们将总结二价铁和二价铜离子的反应特点,并展望它们在环境保护、生物医学以及催化剂等领域的潜在应用和进一步研究方向。
通过本文的研究,我们希望能够全面了解二价铁和二价铜离子在化学反应中的行为特性,并为相关领域的进一步研究提供一定的参考依据。
在实际应用中,对二价铁和二价铜离子的反应特点有所了解,将有助于我们更好地利用它们的特性,开发出具有经济效益和环境友好性的化学反应方法。
同时,对于二价铁和二价铜离子的进一步研究,也有助于我们对其反应机理进行更深入的理解,为相关领域的科学研究提供更为可靠的理论基础。
接下来,我们将详细介绍二价铁离子的性质和反应。
1.2 文章结构本文将分为三个主要部分,分别是引言、正文和结论。
在引言部分,我们将对二价铁和二价铜离子反应的概述进行介绍。
包括二价铁和二价铜离子的性质和反应的基本特点。
在正文部分,我们将详细探讨二价铁离子的性质和反应,以及二价铜离子的性质和反应。
首先,我们将介绍二价铁离子的化学性质和特点,包括其物理性质、化学性质以及常见反应。
氨基酸与金属离子配位机理的重新解析氨基酸是生物体内重要的有机分子,它在许多生物化学过程中起着关键的作用。
而金属离子则常常与氨基酸形成配位化合物,对氨基酸的结构和功能产生一定影响。
本文将重新解析氨基酸与金属离子的配位机理,探讨它们在生物系统中的重要性和意义。
1. 引言在生物体内,金属离子与氨基酸的相互作用是一种广泛存在的生物配位化学现象。
许多重要的生物化学反应和生命过程都依赖于金属离子与氨基酸之间的配位作用。
本文将从深度和广度的角度出发,重新解析氨基酸与金属离子的配位机理。
2. 氨基酸的配位能力氨基酸由一羧基(-COOH)和一氨基(-NH2)基团组成,它们能够提供多个孤对电子,形成与金属离子的配位键。
不同的氨基酸具有不同的配位能力,这取决于它们的结构和侧链性质。
含有硫醇基团的半胱氨酸能够与金属离子形成较稳定的配合物。
3. 金属离子的选择性配位金属离子在生物体内与不同的氨基酸之间表现出选择性配位的特点。
这取决于金属离子本身的电荷、半径、价态等因素,以及氨基酸的结构和功能群。
二价金属离子往往与含有氨基和羧基的氨基酸形成配位键,而三价金属离子则更倾向于与含有酚羟基的氨基酸发生配位反应。
4. 配位键的形成和稳定性配位键的形成对于金属离子和氨基酸之间的相互作用至关重要。
配位键的性质取决于氨基酸提供的孤对电子数目、配位数以及金属离子的性质。
通常情况下,氨基酸提供的多个孤对电子能够形成与金属离子的多个配位键,增加配合物的稳定性。
5. 氨基酸与金属离子的功能氨基酸与金属离子形成的配合物在生物体内具有多种功能。
它们可以参与催化反应,如酶的活性中心中的金属离子;或者作为信号分子,传递细胞内外的信号。
氨基酸与金属离子的配位作用还可以调节蛋白质的结构和稳定性,影响其功能。
6. 生物体内的配位反应在生物体内,氨基酸与金属离子的配位反应受到生理条件的调控。
pH值、温度、离子浓度等因素都可以影响配位反应的进行。
一些辅因子如辅酶也能够与金属离子形成稳定的配合物,参与生物化学反应。
过渡金属离子对蛋白质水解作用的研究段海华1 前言我国的废弃蛋白质资源十分丰富。
仅十几亿人口每年的人发渣就达几十万吨。
猪、牛、羊、等牲畜的毛、蹄角以及鸡、鸭、鹅、等禽类的羽毛每年都在百万吨以上。
利用这些废弃蛋白质水解制取氨基酸,开发氨基酸资源,成了既利于环保,又符合可持续发展的绿色科研课题。
提高蛋白质的水解效率是开发氨基酸资源的最重要环节,也是化学界少人问津的难、重课题。
1.1 蛋白质水解研究综述氨基酸是蛋白质的基本结构单位。
蛋白质水解制取氨基酸的方法主要有酸水解法、碱水解法、酶水解法三种。
在美国,Brehm Josef 等人将动物或蔬菜磨成粉末,并以此为原料,在pH值10.0-14.0,70摄氏度以上反应,制得氨基酸。
另外,Blortz Doris 等人用肽链内切酶和肽链外切酶水解动物产品,制得口感较好的氨基酸。
不过,酶水解法的水解率太低,而碱水解法会使丝氨酸、苏氨酸、精氨酸以及半胱氨酸遭到破坏,并使其它的氨基酸外消旋化。
因此目前应用得最广泛的是酸水解法。
本实验正是采用酸水解法。
酸水解法中,盐酸水解法使用较为广泛,一般用6-10mol·L-1盐酸水解7-24h。
优点是氨基酸96不易被破坏,但盐酸易挥发,对设备、环境及生产工人的健康均有不良影响,且浓盐酸的浓度较低,生产过程中耗量大,运输费用大,脱酸费用高。
硫酸水解法一般用3-5 mol·L-1硫酸,水解时间同盐酸法相当。
优点是硫酸挥发性小,可选用石灰乳或碳酸钙中和脱酸,生成的硫酸钙沉淀经分离而除去,生产成本低。
不足之处是个别氨基酸如色氨酸会损失。
另外副产品硫酸钙也是一种良好的饲料添加剂,对畜禽补充钙,用硫酸钙优于用碳酸钙。
综合考虑,硫酸水解法优于盐酸水解法。
毛发等角质蛋白是随处可见的废弃蛋白。
羽毛被广泛用做羽绒原料,但鸭毛、鹅毛提绒后剩下约40-50% 羽毛梗未被利用,国内鸡毛大多数被白白扔掉,其粗蛋白含量在80% 左右,因此从羽毛中提取复合氨基酸前景广阔。
上岗证考试氨基酸分析仪/离子色谱仪试题姓名科室分数一、填空题(每空2分,共40分)1.氨基酸自动分析仪是在高效液相色谱法的原理指导下创建的,按分离机制分,它属于色谱法。
2.经典的氨基酸分析方法是采用法来分离各种氨基酸,分离后的氨基酸与进行柱后反应,然后定量测定。
3.一般氨基酸与茚三酮的显色反应释放NH3呈,最大吸收波长为,而脯氨酸不释放NH3,最大吸收波长为,故氨基酸分析仪检测器都设计成双通道。
4.L-8800氨基酸分析仪色谱分离柱填料活性基团是。
5.每种氨基酸有D-构型和L-构型,蛋白质中的氨基酸都是L-构型,组成蛋白质的20种氨基酸除甘氨酸外,都有一个不对称碳原子,即а-碳原子,а-碳原子有四个不同取代基分别为、、和R基团,不同氨基酸的R 基团不同。
6.OPA(邻苯二甲醛)在硫醇存在下,与氨基酸反应生成物质,激发波长340nm, 发射波长455nm。
7.氨基酸在PH 的条件下都带正电荷,在阳离子交换树脂上均被吸附,但结合强度各不相同。
8.不同氨基酸与离子交换树脂的亲和力大小排序氨基酸>氨基酸> 氨基酸> 及氨基酸。
9.提高流动相PH值,氨基酸正电荷减少,吸附力减弱,氨基酸在离子交换柱上的洗脱顺序是和氨基酸、氨基酸、氨基酸。
10.蛋白质水解方法有、、,酸水解法水解彻底,但色氨酸遭破坏;用NaOH水解色氨酸不被破坏,但有消旋作用,丝氨酸、苏氨酸、精氨酸、胱氨酸遭不同程度破坏。
11.蛋白质水解常用方法是6mol/L盐酸水解法,用量为蛋白质质量的500-5000倍,在℃水解小时,可达90%以上水解,空气可以使蛋、胱氨酸氧化,酪、组氨酸破坏,需抽真空或充氮气,12.离子色谱是液相色谱的一种,主要用于的分离。
13.与常规HPLC相比,离子色谱仪主要差异在于在色谱柱之后和检测器之前,离子色谱带有,离子色谱的流路系统主要采用材料。
14.离子色谱主要由输液系统、进样系统、分离系统、、检测系统等几个部分组成;离子色谱的检测器分为两大类,即电化学检测器和光学检测器。
四川理工学院毕业设计(论文)氨基酸Schiff碱配合物的合成及其催化PNPA水解的研究学生:蒋聪学号:06131010109专业:化学班级:2006.1指导教师:蒋维东四川理工学院化学与制药工程学院二O一O年六月四川理工学院毕业论文(设计)中文摘要氨基酸Schiff碱配合物的合成及其催化PNPA水解的研究摘要氨基酸Schiff碱及其金属配合物具有良好的抗炎、抗菌、抗癌等生物活性而有望成为高效、低毒、可供临床使用的新药物而引起人们的极大关注。
目前,这类配合物被作为模拟水解酶应用于催化酯水解领域还相当少见。
本文合成了一系列L-丝氨酸Schiff碱金属配合物并进行表征,考察了其中七种配合物对对硝基苯酚乙酸酯(PNPA)水解的催化性能。
研究结果表明,这些氨基酸Schiff碱金属配合物表现出较好的催化性能和酸碱稳定性。
关键词:L-丝氨酸;氨基酸Schiff碱;PNPA;水解;人工水解酶I四川理工学院毕业论文(设计) 英文摘要 IISynthesis of Amino acids Schiff Base Metal complex ed Compounds and Studies on p -nitrophenyl Acetate (PNPA) Cleavage by itsABSTRACTAmino acid Schiff base and corresponding metal complex have been attracted more and more attention because they possess some favorable anti-inflammation, antibacterial, and anticancer activities, furthermore, they have great potential application in the field of new drugs for clinical medicine due to their properties including efficient and low toxicity. However, there is less report that evaluates the catalytic activity of various transition metal complexes with amino acid Schiff base.In this thesis, a series of L-serine Schiff base metal complexes were synthesized and characterized. Moreover, seven synthetic Schiff base metal complexes were employed as mimic hydrolytic enzyme models catalyzing p -nitrophenyl acetate (PNPA) hydrolysis. The observations indicate that these complexes have higher activity and acid-base stability toward the hydrolysis of PNPA.Key words : L-serine, amino acid Schiff base, PNPA, hydrolysis, artificial hydrolases四川理工学院毕业论文(设计)目录目录中文摘要.. (Ⅰ)英文摘要.. (Ⅱ)1绪论 (1)前言 (1)1.1 Schiff碱的概述 (1)1.2氨基酸类Schiff碱金属配合物的作用 (2)1.3人工酶和天然酶 (4)1.4水解金属酶 (4)1.5 Schiff碱配合物模拟水解酶 (5)1.6研究构想 (6)2实验部分 (8)2.1 仪器与试剂 (8)2.1.1 实验仪器 (8)2.1.2实验试剂 (9)2.2原料的合成 (9)2.2.1 5-氯水杨醛的合成 (9)2.2.2 5-溴水杨醛的合成 (9)2.3四种氨基酸Schiff碱(L1~L4)的合成 (9)2.3.1 L-丝氨酸与水杨醛Schiff碱(L1)的合成 (9)2.3.2 L-丝氨酸与5-氯水杨醛Schiff碱(L2)的合成 (10)2.3.3 L-丝氨酸与5-溴水杨醛Schiff碱(L2)的合成 (10)2.3.4 L-丝氨酸与2-羟基萘甲醛Schiff碱(L4)的合成 (10)2.4氨基酸Schiff碱金属配合物的合成 (11)2.4.1 L-丝氨酸与水杨醛Schiff碱(L1)金属配合物的合成 (11)2.4.2 L-丝氨酸与5-氯水杨醛Schiff碱(L2)金属配合物的合成 (11)2.4.3 L-丝氨酸与5-溴水杨醛Schiff碱(L3)金属配合物的合成 (12)2.4.4 L-丝氨酸与2-羟基萘甲醛醛Schiff碱(L4)金属配合物的合成 (13)2.5 PNPA水解反应动力学测定 (13)2.5.1缓冲化的金属配合物溶液的配制 (13)2.5.2 PNPA水解反应动力学测定 (13)2.5.3 光谱扫描 (14)3结果与讨论 (15)3.1实验数据记录和光谱扫描 (15)III四川理工学院毕业论文(设计)目录3.1.1水解速率数据记录 (15)3.1.2 光谱扫描分析 (15)3.2 PNPA水解的机理及动力学 (16)3.3反应体系pH对金属配合物催化PNPA水解的影响 (17)3.4催化剂结构对金属配合物催化PNPA水解的影响 (18)3.5 底物浓度对金属配合物催化PNPA水解的影响 (18)4结论与展望 (19)4.1 主要结论 (19)4.3 后续研究工作的展望 (19)参考文献 (20)致谢 (22)IV四川理工学院毕业论文(设计)绪论1 绪论前言在我们的地球上,生活着形形色色、千姿百态的生物。