1—18号元素的结构性质特点
- 格式:doc
- 大小:35.50 KB
- 文档页数:1

元素推断中的1-18号元素的知识清单1-氢:原子结构特点:无中子,原子半径最小,阳离子是一个质子。
原子序数最小。
元素及其化合物的特征:氢气是最轻的气体。
2-氦:原子结构特点:最外层为2个电子,但不是第IIA族的元素。
2电子体,同周期的阴离子和下一个周期的阳离子都是2电子体。
3-锂:原子结构特点:最外层电子数为里层电子数的一半。
元素及其化合物的特征:锂是最轻的金属,保存在石蜡中。
锂电池质轻,容量大。
(质量相等时,失去的电子数最多)4-铍:原子结构特点:最外层的电子数等于里层电子数,等于电子层数。
元素及其化合物的特征:铍的化学性质与铝的非常相似。
写一写:写出氧化铍和氢氧化铍与氢氧化钠反应的化学方程式:5-硼(略)6-碳:原子结构特点:最外层电子数等于电子层数的2倍,正负化合价的绝对值相等,代数和为零。
元素及其化合物的特征:含碳的化合物是所有化合物中最多的,氢化物中含氢量最高,有多种同素异形体(如:金刚石石墨碳-60等),金刚石是自然界中最硬的单质。
写一写:二氧化碳的电子式和结构式分别为和工业上制粗硅制水煤气镁条在二氧化碳中的燃烧7-氮:元素及其化合物的特征:氨气是中学化学中唯一碱性的气体,易液化。
该元素的气态氢化物和最高正价氧化物对应的水化物反应能生成离子化合物。
硝酸是强氧化性酸之一。
写一写:氮气的电子式和结构式分别为和。
氨气的电子式碳酸氢铵与氢氧化钠共热的离子方程式浓硝酸稀硝酸和铜炭反应的化学方程式8-氧原子结构特点:最外层电子数为内层电子数的3倍元素及其化合物的特征:是地壳中含量最高的元素,氧有两种同素异形体(氧气和臭氧),能和氢和钠形成A2B和A2B2型的化合物。
水为无色无味液体。
写一写:水和过氧化氢的电子式、结构式和共价键的类别分别为9-氟元素及其化合物的特征:氟无正价氟气是最活泼的非金属单质,浅黄绿色的气体,氟化氢是最容易生成且最稳定的氢化物。
写一写:氟气与水的反应10-氖原子结构特点:10电子体,同周期的阴离子、氢化物和下一个周期的阳离子都是10电子体。


矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。


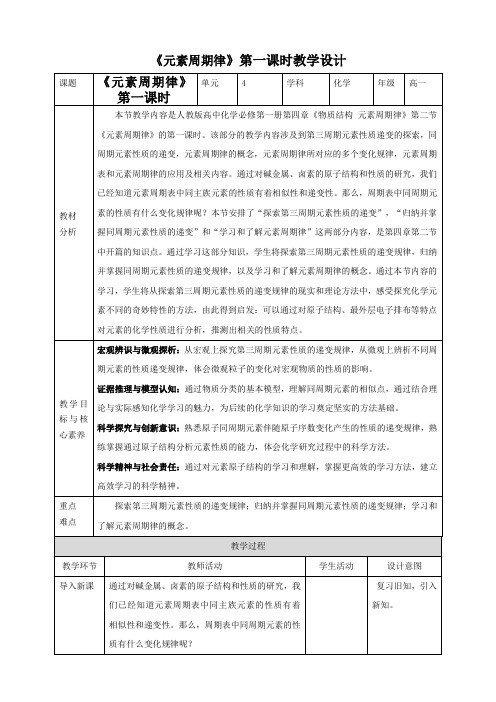
《元素周期律》第一课时教学设计讲授新课一、1~18号元素的特点1~18号元素的特点注:稀有气体元素的原子半径测定与相邻非金属元素的测定依据不同,数据不具有可比性,故不列出。
1~18号元素的特点1~18号元素的特点【设疑】观察下表,思考:随着原子序数递增,元了解同周期元素的原子半径大小及化合价,探索出规律。
素原子的核外电子排布、原子半径和化学价各呈现什么规律性变化?【设疑】观察下表,思考:随着原子序数递增,元素原子的核外电子排布、原子半径和化学价各呈现什么规律性变化?随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性变化。
核外电子层数相同,原子半径逐渐变小,化合价逐渐升高。
当K层为最外层时,最多能容纳2个电子数除了K层,其他各层为最外层时,多能容纳8个电子数。
【设疑】元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性变化?第三周期元素性质的递变取一小段镁条,用砂纸除去表面的氧化膜,放到试管中。
向试管中加入2mL水,并滴入2滴酚酞溶液,观察现象。
观察表格,思考问题。
总结规律无明显现象。
因为镁和冷水不反应。
过一会儿,加热试管至液体沸腾,观察现象。
与钠和水的反应相比,镁和水的反应难易程度如何?生成了什么物质?有气体产生,溶液变成红色反应式:Mg + 2H2O ——Mg(OH)2 + H2↑钠的金属性要比镁大得多,所以与水反应钠比镁要剧烈得多。
所谓金属性就元素的原子失去电子的能力。
元素的金属性越强,越容易失电子被氧化。
第三周期元素性质的递变向试管中加入2mL 1mol/L AlCl3溶液,然后滴加氨水,直到不再产生白色絮状Al(OH)3沉淀为止。
将沉淀分装在两只试管中,向一支试管中滴加2mol 盐酸,向另一只试管中滴加2mol/LNaOH溶液。
边滴加边振荡,观察现象。
Al(OH)3在酸或强碱溶液中都能溶解,表明它既能与酸发生反应,又能与强碱溶液发生反应。
反应的离子方程式分别如下:Al(OH)3 + 3H+——Al3+ + 3H2OAl(OH)3 + OH-——AlO-2 + 2H2O金属元素的氢氧化物钠、镁、铝是金属元素,都能形成氢氧化物。
1-18号元素的变化规律
化学元素周期表中1-18号元素的变化规律主要包括以下几个方面:
1. 原子半径的变化规律:整个周期内,从左到右原子半径逐渐减小,而同一族元素从上到下原子半径逐渐增大。
2. 电负性的变化规律:整个周期内,从左到右原子电负性逐渐增大,而同一族元素从上到下电负性逐渐减小。
3. 电离能的变化规律:整个周期内,从左到右原子电离能逐渐增大,而同一族元素从上到下电离能逐渐减小。
4. 原子量的变化规律:整个周期内,从左到右原子量逐渐增大,而同一族元素从上到下原子量逐渐增大。
5. 元素的化学性质:同一族的元素具有相似的化学性质,整个周期内,由于电子结构的变化,元素的化学性质也发生相应的变化。
需要注意的是,虽然周期表中元素的变化规律较为明显,但在具体的实验和应用中,元素的性质受到多种因素的影响,因此需要进行详细的研究和分析。
1—18号元素的结构性质特点(1)H:①原子半径最小;②外层电子数=周期数;③电子总数=电子层数;④第ⅠA族中唯一形成共价化合物的元素;⑤在化合物中该原子的数目虽有改变,但该元素原子质量分数改变不大;⑥原子序数最小;⑦没有中子;⑧成酸、碱必需的元素;⑨单质密度最小,最轻的气体;⑩与氧可生成两种液体:H2O、H2O2;单质是电解水产物之一;单质可由金属与酸反应得到。
(2)He:①最外层属饱和结构,但唯一个不是8电子;②电子总数是电子层数的二倍。
(3)Li:①最外层电子数是次外层的一半;②碱金属中不能形成过氧化物;③热核反应原料之一;④密度最小的轻金属;⑤保存于石蜡中。
(4)Be:①最外层电子数=次外层电子数;②最外层电子数=电子层数③价态为+2价(5)B:①最外层电子数比次外层多一个;②BF3属非极性分子(本章后边将学到);③氢化物为B2H6(了解就可以);④硼酸(H3BO3)可洗涤皮肤上的碱液;⑤硼砂(Na2B4O7、10H2O)是硼酸盐玻璃材料。
(6)C:①最外层电子数是次外层的二倍;②是形成化合物种类最多的元素;③有石墨、金刚石、足球碳(C60)等几种同素异形体,(第六章后边将学到);④氧化物有CO、CO2;⑤氢化物有多种最简单的是CH4(特别注意H、C、O分子式)⑥最高价含氧酸是H2CO3。
(7)N:①最外层电子比次外层多3个;②单质在空气中含量最多;③除稀有气体外难与其它物质反应;④化肥三元素之一(N、P、K);⑤氢化物为NH3;⑥氧化物形式最多(6种:N2O、NO、N2O3、NO2、N2O5);⑦含氧酸有HNO3、HNO2;⑧气态氢化物水溶液唯一呈碱性。
(8)O:①最外层电子数目是次外层的三倍;②地壳中含量最多;③占空气体积的21%;④能形成H2O2、H2O、Na2O2、Na2O等价态氯化物;⑤单质助燃(9)F:①最外层电子数比次外层多5个;②除H后前18号元素中原子半径最小;③无正价;④不能被任何物质氧化;⑤能与水反应置换水中的氧;⑥CaF2难溶、AgF溶于水;⑦无含氧酸;⑧HF为弱酸。
1—18号元素的结构性质特点
(1)H:
①原子半径最小;
②外层电子数=周期数;
③电子总数=电子层数;
④第ⅠA族中唯一形成共价化合物的元素;
⑤在化合物中该原子的数目虽有改变,但该元
素原子质量分数改变不大;
⑥原子序数最小;
⑦没有中子;
⑧成酸、碱必需的元素;
⑨单质密度最小,最轻的气体;
⑩与氧可生成两种液体:H2O、H2O2;
○11单质是电解水产物之一;
○12单质可由金属与酸反应得到。
(6)C:
①最外层电子数是次外层的二倍;
②是形成化合物种类最多的元素;
③有石墨、金刚石、足球碳(C60)等几种同
素异形体,(第六章后边将学到);
④氧化物有CO、CO2;
⑤氢化物有多种最简单的是CH4;
⑥最高价含氧酸是H2CO3。
(7)N:
①最外层电子比次外层多3个;
②单质在空气中含量最多;
③难与其它物质反应;
④化肥三元素之一(N、P、K);
⑤氢化物为NH3;
⑥氧化物形式最多(6种:
N2O,NO,N2O3,NO2,N2O5);
⑦含氧酸有HNO3、HNO2;
⑧气态氢化物水溶液唯一呈碱性。
(8)O:
①最外层电子数目是次外层的三倍;
②地壳中含量最多;
③占空气体积的21%;
④能形成H2O2、H2O、Na2O2、Na2O等价态氧
化物;
⑤单质助燃
(9)F:
①最外层电子数比次外层多5个;
②除H后前18号元素中原子半径最小;
③无正价;
④不能被任何物质氧化;
⑤能与水反应置换水中的氧;
⑥CaF2难溶、AgF溶于水;
⑦无含氧酸;
⑧HF为弱酸。
(11)Na:
①最外层电子数是最内层的1/2;
②前18号元素原子半径最大;
③氧化物对应的水化物为NaOH;
④能形成氧化物Na2O和过氧化物Na2O2;
⑤与K的合金形成原子能反应堆的导热材料。
(12)Mg:
①最外层电子数=最内层电子数,次外层电子
数是最外层电子数的4倍;
②Mg(OH)2是难溶性的中强碱;
③Mg遇冷水难反应,遇热水放H2;
④MgCl2为苦卤、MgSO4为泻盐。
(13)Al:
①最外层比次外层少5个电子;
②最外层电子数=电子层数;
③铝是金属元素但具有一定的非金属性;
④Al2O3是两性氧化物;
⑤Al(OH)3是两性氢氧化物;
⑥地壳中含量最多的金属元素。
(14)Si:
①最外层电子数是次外层的一半,最内层的2
倍;
②地壳中含量排第二位;
③只有一种氧化物SiO2;
④气态氢化物SiH4;
⑤含氧酸为H4SiO4;
⑥H2SiO3是唯一难溶酸。
(15)P:
①最外层比次外层少3个电子;
②氢化物为PH3;
③对应的酸为H3PO4、H3PO3;
④常见白磷、红磷二种单质。
(16)S:
①最外层比次外层少2个电子;
②最外层与最内层电子数之和=次外层电子
数;
③氢化物H2S、剧毒;
④氧化物有SO2、SO3;
⑤对应的水化物H2SO3、H2SO4;
⑥对应的盐常见的有Na2S、NaHS、Na2SO3、
NaHSO3、Na2SO4、NaHSO4。
(17)Cl:
①最外层比次外层少一个电子,比最内层多5
个电子;
②有多种化合价-1、+1、+3、+5、+7;
③对应的含氧酸有HClO、HClO2、HClO3、HClO4;
④HClO4是目前发现的含氧酸中的最强酸。