原子结构与元素的性质高考总复习
- 格式:docx
- 大小:517.91 KB
- 文档页数:15


2024年总结高考化学必考知识点(____字)1. 化学基础知识原子与元素:原子结构、元素周期表、元素的性质与分类。
化学键与化合物:离子键、共价键、金属键,化合物的命名与化学式写法。
化学反应:化学反应的基本类型、化学平衡、化学方程式的平衡写法与判定。
2. 物质的组成与结构基本粒子:质子、中子、电子,质子数、中子数、电子数的关系。
原子结构:原子核、电子壳层结构,电子的排布规律(阿布居尔定律)。
元素周期表:元素周期表的组成、元素周期表的特点,周期表中的周期性规律。
化学键与分子结构:离子键、共价键、金属键,分子的形状与性质。
3. 化学变化与能量化学反应的能量变化:焓变、吸热反应与放热反应,化学反应中的能量守恒原理。
化学反应速率:反应速率与反应条件的关系,影响反应速率的因素。
化学平衡:平衡常数、平衡常数与温度的关系,影响平衡位置的因素。
4. 酸碱与盐酸碱理论:酸碱的定义、酸碱中离子的生成与反应。
酸碱性与pH值:酸碱的判定、酸碱溶液的浓度及pH值。
盐与酸碱中性化反应:盐的命名与性质,酸碱中性化反应的判定与计算。
5. 化学反应的平衡平衡态的表达与判定:化学平衡的判定、平衡常数的计算。
化学平衡条件:化学平衡的条件、平衡常数与温度的关系。
化学反应的平衡常数:平衡常数的定义、计算方法与应用。
6. 电化学与电解质电解质溶液:电解质的概念、强电解质与弱电解质。
离子在溶液中的行为:离子的迁移、电解质的电解。
电化学电池:电化学电池的基本概念、电动势的计算和性质。
7. 化学反应动力学化学反应速率:化学反应速率的概念、速率定律,速率与浓度的关系。
催化剂:催化作用的原理与应用。
反应平衡与速率:平衡与速率的关系,平衡与速率的偏离与调节。
8. 化学材料科学材料的种类与性质:金属材料、聚合物材料、无机非金属材料。
材料的制备与应用:金属的提取、聚合物的合成、合成材料的应用。
化学材料的特殊性质:超导性、光电性、磁性等特殊性质的材料。
9. 化学与人类社会化学史与化学进展:化学的起源与发展,化学技术对社会的影响与进展。


原子结构与元素的性质1.按电子排布,可以把周期表中的元素划分为5个区,以下元素属于p区的是() A.Fe B.Mg C.Br D.Cu【答案】C【解析】Fe的外围电子排布式为3d64s2,属于d区元素,A项错误;Mg的外围电子排布式为3s2,属于s区元素,B项错误;Br的外围电子排布式为4s24p5,属于p区元素,C 项正确;Cu的外围电子排布式为3d104s1,属于ds区元素,D项错误。
故选C。
2.下列关于原子结构与元素周期表的说法正确的是()A.电负性最大的元素位于周期表的左下角B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期IIIA族C.2s轨道在空间呈双球形分布D.基态原子3p能级电子半充满的原子第-电离能小于3p能级有两个未成对电子的原子【答案】B【解析】A项,非金属越强,则电负性越大,电负性最大的元素位于周期表的右上角,A项错误;B项,某基态原子的价电子排布式为4s24p1,可知最外层为第四层,且含有3个电子,该元素位于周期表第四周期IIIA族,B项正确;C项,s能级的轨道为球型,则2s轨道在空间呈球形分布,C项错误;D项,核外电子半充满为稳定结构,则基态原子3p能级电子半充满的原子第一电离能大于3p能级有两个未成对电子的原子,D项错误;故选B。
3.电子排布式为[Ar]3d54s2的元素是()A.稀有气体元素B.过渡元素C.主族元素D.卤族元素【答案】B【解析】在最外能层p轨道上填充有电子且未满时,一定为主族元素;最外能层p轨道上未填充电子,而在d(或f)轨道上填充有电子的元素,一定是过渡元素。
故电子排布为[Ar]3d54s2的元素为过渡元素。
故选B。
4.基态原子的核外电子排布式为[Kr]4d105s1的元素所属的区、周期和族为()A.p区、第五周期、第ⅠB族B.ds区、第五周期、第Ⅰ族C.d区、第四周期、第ⅠB族D.ds区、第五周期、第ⅠB族【答案】D【解析】依据Cu原子的核外电子排布[Ar]3d104s1进行迁移,则可推断出核外电子排布式为[Kr]4d105s1的元素属于第五周期第ⅠB族元素,位于ds区。


高考化学复习考点知识突破解析原子结构与性质1.在基态多电子原子中,关于核外电子能量的叙述错误的是()A.最易失去的电子能量最高B.电离能最小的电子能量最高C.p轨道电子能量一定高于s轨道电子能量D.在离核最近区域内运动的电子能量最低【答案】C【解析】A.能量越高的电子通常离核越远,故最易失去的电子能量最高,A正确;B.电离能最小的电子只需要较少的能量即可脱离原子核的吸引,故其能量最高,B正确;C.p轨道电子能量不一定高于s轨道电子能量,同一能层的p轨道电子能量高于s 轨道电子能量,C不正确;D.根据能量最低原理可知,在离核最近区域内运动的电子能量最低,D正确。
综上所述,关于核外电子能量的叙述错误的是C。
2.下列有关元素锗及其化合物的叙述中正确的是A.锗的第一电离能高于碳而电负性低于碳B.四氯化锗与四氯化碳分子都是四面体构型C.二氧化锗与二氧化碳都是非极性的气体化合物D.锗和碳都存在具有原子晶体结构的单质【答案】BD【解析】碳和锗同主族,碳在第二周期,而锗在第四周期,锗是金属元素,故其第一电离能低于碳,A错;四氯化锗和四氯化碳都是分子晶体且构型相同,B对;金属的氧化物不是气体,C错;锗和碳都易于形成四个键,能形成原子晶体结构的单质,D对。
3.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。
完成下列填空:(1)铝原子核外电子云有______种不同的伸展方向,有_____种不同运动状态的电子。
(2)镓(Ga)与铝同族。
写出镓的氯化物和氨水反应的化学方程式_____。
【答案】(1)4 13 (2)GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓【解析】(1)铝原子核外电子云有s、p,分别有1种、3种,共有4中不同的伸展方向,其核外有13个电子,则有13种不同运动状态;(2)类似氯化铝与氨水反应,则镓的氯化物和氨水反应的化学方程式为GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓;4.下列叙述正确的有_______。


原子结构与性质1.下列有关化学用语正确的是( )A.某元素基态原子的电子排布图:B.NH4Cl电子式为C.Ca2+基态电子排布式为1s22s22p63s23p6D.F原子的结构示意图:解析:选C A中电子排布图应为,错误;B中电子式为,错误;D中结构示意图应为,错误。
2.(2018·唐山模拟)在d轨道中电子排布成,而不能排布成,其最直接的根据是( )A.能量最低原理 B.泡利原理C.原子轨道构造原理 D.洪特规则解析:选D 据图知,4个电子占据不同的轨道且自旋状态相同,其根据是洪特规则。
3.下列关于价电子构型为4s24p4的原子的描述正确的是( )A.其电子排布式为1s22s22p63s23p64s23d104p4B.其价电子排布图为C.其4p轨道电子排布图为D.其电子排布式可以简化为[Ar]3d104s24p4解析:选D A项,其基态原子电子排布式为1s22s22p63s23p63d104s24p4,错误;B项,违反了洪特规则,错误;C项,违反了泡利原理,错误。
4.(2018·银川模拟)下列基态原子的核外电子在原子轨道上的能量大小关系不正确的是( )A.5s>4s B.4s>3dC.5d>4f D.5p>4d解析:选B B项,3d能级的能量高于4s能级的能量,B项错误。
5.(2018·忻州模拟)下列叙述中正确的是( )A.同周期元素中,第ⅦA族元素的原子半径最大B.第ⅥA族元素的原子,其半径越大,越容易得到电子C.当各轨道处于全满、半满、全空时原子较稳定D.同一周期中,碱金属元素的第一电离能最大解析:选C 同周期元素中,从左至右原子半径依次减小,所以同周期元素中,第ⅦA族元素的原子半径最小,A错误;第ⅥA族元素的原子,其半径越大,越不容易得电子,B错误;当各轨道处于全满、半满、全空时,能量最低,原子较稳定,C正确;同一周期中,碱金属元素的第一电离能最小,D错误。

原子结构与元素的性质专题复习与总结物质结构、元素周期律是中学无机化学的重要理论基础,它可以指导元素周期表中每一主族元素的学习和运用;同时在高考中它占有重要的地位。
原子结构与元素的性质这一专题主要让学生在已有的原子内部结构的知识基础上,进一步探索原子核外电子的运动特征与规律,同时探究所有元素之间在性质上有何规律性,主要抓住结构决定性质这一主张展开,现就本专题总结如下:一、考点与热点透视1、原子结构和同位素的考查,常以重大科技成果为知识背景,寓教于考,突出教育性与实践性,常考的热点有:①关于原子的组成及各基本粒子之间的关系。
②注意对电性关系的考查。
③同位素的概念及其应用。
④原子核外电子的排布规律及原子结构示意图,电子排布式、轨道式的书写。
2、元素性质的递变规律即元素周期律。
常考的热点有:①原子核外电子的排布、原子半径、元素主要化合价、元素的第一电离能和元素电负性的周期性变化。
②原子轨道和能级的理解及其应用。
③元素金属性和非金属性强弱的比较及其应用。
④了解焰色瓜及其应用。
⑤理解元素周期表中元素的位置、结构、性质三者之间的变化关系。
二、知识精析1、原子的结构:2、核外电子的运动①形象描述??电子云。
原子核外电子绕核高速运动是没有确定的轨道,就好像一团“带点电荷云雾”称之为“______”。
电子云密集(单位体积内小黑点多)的地方,表示电子出现的__________;反之,电子云稀疏(单位体积内小黑点少)的地方,电子出现的___________。
②原子核外电子的排布:③元素周期表中各区、周期、族元素的原子核外电子排布的规律。
④原子结构示意图,电子排布式、轨道式的书写。
如:Mg:原子结构示意图:______________ 电子排布式_____________轨道表示式为_______________。
3、元素性质的递变规律:①原子核外电子排布的周期性:②元素第一电离能的周期性变化同一周期,随着原子序数的增加,充分的第一电离能逐渐________。

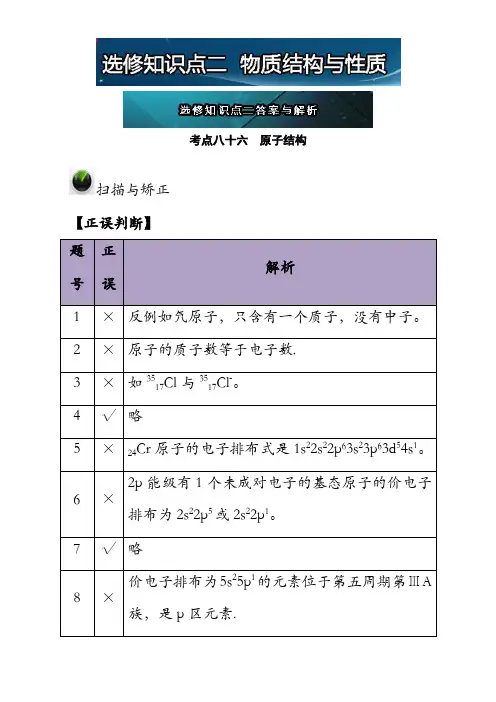
考点八十六原子结构扫描与矫正【正误判断】题号正误解析1×反例如氕原子,只含有一个质子,没有中子。
2×原子的质子数等于电子数.3×如3517Cl与3517Cl-。
4√略5×24Cr原子的电子排布式是1s22s22p63s23p63d54s1。
6×2p能级有1个未成对电子的基态原子的价电子排布为2s22p5或2s22p1。
7√略8×价电子排布为5s25p1的元素位于第五周期第ⅢA 族,是p区元素.实训与超越【7+1模式】9 √ 略10 × 某些元素各能层的能级是从s 能级开始至f 能级结束.11 ×各能层所含有最多的电子数一定是该能层序数平方的2倍. 12 × 3p 能级有三个轨道.13 √ 略14 √ 略15 √ 略16 × 选项据能量最低原理可知离核近,能量低。
17 √ 略18 × 位于同一周期。
19 × 如果某一基态原子3p 能级上仅有2个电子,它们分别位于两个轨道,自旋状态相同.20 ×该轨道表式不是最外层带电子的,是原子核外的所有电子的。
的为SO错误!,由图(b)中的阳离子结构可知含有Cu2+、4个NH3、2个H2O,阳离子符号为Cu(NH3)4(H2O)2]2+,含有共价键、配位键;加热化合物时根据配位键强弱确定首先失去的成分。
考点八十七原子结构与元素的性质扫描与矫正【正误判断】题号正误解析1×同周期元素第一电离能与原子半径递变规律不同.2√略3√略4×F无正价,O最高出现的是+2(OF2中),无+6价。
5√同周期中碱金属元素的第一电离能最小,稀有实训与超越【7+1模式】题号答案解析1C A选项应为Ne]3s23p2,B选项应为Ar]3d54s2,D选项应为Ne]3s23p63d34s2.2A A选项元素属于同一主族,电负性从上到下依次减小;B选项元素属于同一周期,电负性从左到右依次增大;C、D两个选项元素的相对位置如下图所强,非金属性增强,最高价氧化物对应的水化物酸性增强。
第1讲原子结构与元素的性质[考纲要求] 1.能规范书写常见元素(1~36号)原子核外电子的电子排布式和电子排布图。
2.运用原子核外电子跃迁等解释某些实际问题。
3.用电离能、电负性等解释元素的某些性质。
4.掌握周期表各区、周期、族的原子核外电子排布规律及元素性质的递变规律。
考点一原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的________是不同的,按照电子的________差异将其分成不同能层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里的电子的________也可能不同,又将其分成不同的能级,通常用____________等表示,同一能层里,各能级的能量按__________的顺序升高,即:________________________。
(3)原子轨道:电子云轮廓图给出了电子在__________________的区域。
这种电子云轮廓图称为原子轨道。
原子轨道轨道形状轨道个数sp特别提醒第1能层(K),只有s能级;第2能层(L),有s、p两种能级,p能级上有三个原子轨道p x、p y、p z,它们具有相同的能量;第3能层(M),有s、p、d三种能级。
2.原子核外电子排布的原理(1)能量最低原理:即:电子尽先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为构造原理示意图,亦即基态原子核外电子在原子轨道上的排布顺序图:(2)泡利不相容原理一个原子轨道最多容纳____个电子,并且____________相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先__________________,并且____________相同。
洪特规则特例:当能量相同的原子轨道在________(p6、d10、f14)、________(p3、d5、f7)和________(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
选修3 物质结构与性质 第一节 原子结构与性质考纲定位1.了解原子核外电子的运动状态、排布原理和能级分布,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
2.了解电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及简洁应用。
4.了解电负性的概念,并能用以说明元素的某些性质。
考点1| 原子核外电子排布 [基础学问整合]1.能层、能级和原子轨道能层 K L MN能级 1s 2s 、2p3s 、3p 、3d 4s 、4p 、4d 、4f原子轨道数目 1 1+3=4 1+3+5=9 1+3+5+7=16最多容纳电子数目2818322.原子轨道的外形、数目及能量关系 (1)轨道外形⎩⎨⎧s 电子的原子轨道呈球形对称p 电子的原子轨道呈哑铃形(2)s 、p 、d 、f 能级上原子轨道数目依次为1、3、5、7,其中n p x 、n p y 、n p z 三个原子轨道在三维空间相互垂直,各能级的原子轨道半径随能层数(n )的增大而增大。
(3)能量关系⎩⎪⎪⎨⎪⎪⎧①相同能层上原子轨道能量的凹凸:n s<n p<n d<n f②外形相同的原子轨道能量的凹凸:1s<2s<3s<4s ……③同一能层内外形相同而伸展方向不同的原子轨道的能量相等,如2p x、2p y、2p z轨道的能量相同3.原子核外电子排布规律(1)能量最低原理:原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理:原子的核外电子在填充原子轨道时,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按着能级的能量由低到高的挨次依次填充的,填满一个能级再填一个新能级,这种规律称为构造原理。
构造原理示意图:(2)泡利原理:在一个原子轨道里,最多只能容纳2个电子,且它们的自旋状态相反。
(3)洪特规章:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
原子结构与性质一、单选题1.下列比较正确的是()①与冷水的反应速率:K>Na>Mg②热稳定性:HF>H2Se>H2S③结合质子的能力:CH3CH2O->CH3COO->HCO3-④离子半径:Cl->O2->Al3+A.①④B.②③C.②④D.①③【答案】A【解析】①金属性越强,与水反应越剧烈,金属性: K>Na>Mg,与冷水的反应速率: K>Na>Mg,故正确;②非金属性越强,气态氢化物越稳定,非金属性:F>S>Se,所以热稳定性: HF>H2S>H2Se,故错误;③酸性越弱,酸越难电离,对应的酸根离子越易结合氢离子,乙酸的酸性大于碳酸,乙醇为中性,所以结合质子的能力: CH3CH2O->HCO3->CH3COO-,故错误;④电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小, Cl-有3个电子层, O2-、Al3+有2个电子层,O的原子序数小所以O2-半径比Al3+大,所以离子半径: Cl->O2->Al3+,故正确;结合以上分析可知,只有所以正确的有①④;综上所述,本题正确选项A。
2.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag =Tl+ +2Ag+ 且已知Ag++Fe2+=" Ag" + Fe3+ 则下列推断正确的是()A.Tl+最外层有3个电子B.氧化性:Tl3+ >Ag+>Fe3+C.还原性:Tl+>Ag D.铊位于第五周期IIIA族【答案】B【解析】A、铊(Tl)与铝同主族,主族元素原子最外层电子相同,选项A错误;B、Tl3++2Ag=Tl+ +2Ag+,且Ag++Fe2+=Ag+Fe3+,氧化剂Tl3+的氧化性大于氧化产物Ag+,氧化剂Ag+的氧化性大于氧化产物Fe3+,所以氧化性顺序为Tl3+>Ag+>Fe3+,选项B正确;C、Tl3++2Ag=Tl++2Ag+,反应中还原剂Ag的还原性大于还原产物Tl+,选项C错误;D、原子序数为81,和铝同主族,结合核外电子排布规律写出原子结构示意图判断,铊位于第六周期第ⅢA族,选项D错误;答案选B。
第十一单元物质结构与性质(选考)第1节原子结构与性质一、选择题1.下列说法正确的是()。
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相像B.Zn2+的最外层电子排布式为3s23p63d10C.基态铜原子的最外层电子排布图:D.基态碳原子的最外层电子排布图:2.下列轨道表示式中,能正确表示该元素原子的最低能量状态的是()。
A.B.C.D.3.Cr原子处于基态时,价电子排布可用电子排布图表示成,而不是。
下列说法中,正确的是()。
A.这两种排布方式都符合能量最低原理B.这两种排布方式都符合泡利原理C.这两种排布方式都符合洪特规则D.这个实例说明洪特规则有时候和能量最低原理是冲突的4.下列各组元素的性质正确的是()。
A.第一电离能:B>Al>GaB.电负性:F>N>OC.最高正价:F>S>SiD.原子半径:P>N>C5.(2019年湖北黄冈期末)人们常将在同一原子轨道上运动的、自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。
以下有关主族元素原子的“电子对”和“未成对电子”的说法,错误..的是()。
A.核外电子数为奇数的基态原子,其原子轨道中肯定含有“未成对电子”B.核外电子数为偶数的基态原子,其原子轨道中肯定不含“未成对电子”C.核外电子数为偶数的基态原子,其原子轨道中肯定含有“电子对”D.核外电子数为奇数的基态原子,其原子轨道中可能含有“电子对”6.(2019届河北定州中学期中)第三周期元素的基态原子中,不行能出现d电子,主要依据是()。
A.能量守恒原理B.泡利不相容原理C.洪特规则D.近似能级图中的依次3d轨道能量比4s轨道高7.(2019届安徽安庆六校联考)以下有关结构与性质的说法不正确...的是()。
A.下列基态原子中:①1s22s22p63s23p2;②1s22s22p3;③1s22s22p2,电负性最大的是②B.下列基态原子中:①[Ne]3s23p2;②[Ne]3s23p3;③[Ne]3s23p4,第一电离能最大的是③C.某主族元素的逐级电离能分别为738、1451、7733、10 540、13 630……,当它与氯气反应时生成的阳离子是X2+D.物质的熔点凹凸:金刚石>晶体硅>钠>干冰二、非选择题8.(1)(2019年安徽卷)C、N、O、Al、Si、Cu是常见的六种元素。
原子结构与元素的性质1.原子核外电子排布与周期的划分周期外围电子排布各周期增加的能级元素种数ⅠA族0族最外层最多容纳电子数一1s11s221s2二2s12s22p682s、2p8三3s13s23p683s、3p8四4s14s24p684s、3d、4p18五5s15s25p685s、4d、5p18六6s16s26p686s、4f、5d、6p32七7s187s、5f、6d(未完)……(2)观察分析上表,讨论原子核外电子排布与周期划分的关系①元素周期系形成的原因:元素原子核外电子排布发生周期性的变化。
②元素周期系的形成过程③元素周期系的特点:每一周期(除第一周期外)从碱金属元素开始,到稀有气体元素结束,外围电子排布从n s1递增至n s2n p6;元素周期系的周期不是单调的,而是随周期序号的递增逐渐增多,同时,金属元素的数目也逐渐增多。
2.原子核外电子排布与族的划分族数ⅠAⅡAⅢAⅣAⅤAⅥAⅦA价电子排布式n s1n s2n s2n p1n s2n p2n s2n p3n s2n p4n s2n p5列数121314151617价电子数1234567副族元素21Sc22Ti23V24Cr25Mn29Cu30Zn族数ⅢBⅣBⅤBⅥBⅦBⅠBⅡB价电子排布式3d14s23d24s23d34s23d54s13d54s23d104s13d104s2价电子数目34567(3)依据上述表格,讨论族的划分与原子核外电子排布的关系①同主族元素原子的价层电子排布完全相同,价电子全部排布在n s或n s n p轨道上。
价电子数与族序数相同。
②稀有气体的价电子排布为1s2或n s2n p6。
③过渡元素(副族和Ⅷ族)同一纵行原子的价层电子排布基本相同。
价电子排布为(n-1)d1~10n s1~2,ⅢB~ⅦB族的价电子数与族序数相同,第ⅠB、ⅡB族和第Ⅷ族不相同。
(1)最外层电子排布与周期表的关系①原子的电子层数=能级中最高能层序数=周期序数。
②主族元素原子的最外层电子数=主族元素原子的价电子数=主族序数。
(2)对价电子认识的误区提醒①价电子不一定是最外层电子,只有主族元素的价电子才是最外层电子。
对于过渡元素还包括部分内层电子。
②元素的价电子数不一定等于其所在族的族序数,这只对主族元素成立,对部分过渡元素是不成立的。
③同一族元素的价电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价电子排布也不相同。
例1价电子排布式为5s25p3的主族元素是()A.第五周期ⅢA族B.51号元素C.非金属元素D.Te【考点】原子结构与元素周期表的关系【题点】价电子与元素周期表的关系答案B解析5s25p3,5指的是电子层数,即属于第五周期,价电子指的是最外层电子数,主族元素所在族序数等于最外层电子数,即属于第ⅤA族元素,按照核外电子排布的规律,推出此元素是锑(Sb),B正确。
例2某元素的原子序数为29,试问:(1)此元素原子的电子总数是________个。
(2)它有________个电子层,有________个能级。
(3)它的价电子排布式是________________。
(4)它属于第________周期________族。
(5)它有________个未成对电子。
【考点】原子结构与元素周期表的综合【题点】原子结构与元素周期表的综合答案(1)29(2)47(3)3d104s1(4)四ⅠB(5)1解析解答该题需掌握原子核外电子排布与元素周期表的关系和原子核外电子排布的规律。
根据核外电子排布原理,该元素的电子排布式应为1s22s22p63s23p63d104s1,共有29个电子,故为Cu元素。
从核外电子排布式中可以得出n=4,有四个电子层,所以为第四周期元素,价电子排布式为3d104s1,所以在ⅠB族。
价电子的电子排布图为,所以有1个未成对电子。
1.根据核外电子的排布分区按电子排布式中最后填入电子的能级符号可将元素周期表分为s 、p 、d 、f 4个区,而ⅠB 、ⅡB 族这2个纵行的元素的核外电子因先填满了(n -1)d 能级而后再填充n s 能级而得名ds 区。
5个区的位置关系如下图所示。
2.根据元素的金属性和非金属性分区根据原子结构特征判断元素在元素周期表的位置 电子排布式――→确定价电子排布式――→确定例3 (2018·扶余市第一中学期末)根据电子排布的特点,Cu 在周期表属于( ) A.ds 区 B.p 区 C.d 区 D.s 区 【考点】元素周期表的分区【题点】元素周期表的分区及应用电子的原子④最外层电子形成全满结构的原子A.②③B.①③C.②④D.①④【考点】元素周期表的分区【题点】元素周期表分区的应用答案B解析最外层有3个电子的原子,其最外层电子排布式为n s2n p1,只能是第ⅢA族元素的原子,①正确;最外层电子排布式为n s2的原子,既可能是第ⅡA族元素的原子,也可能是过渡元素的原子,还可能是He原子,②错误;最外层有3个未成对电子的原子,其最外层电子排布式一定为n s2n p3,位于第ⅤA族,③正确;最外层电子形成全满结构的原子,包括n s2、n s2n p6等结构的原子及钯原子,可能位于多个区,④错误。
学习小结:核外电子排布与元素周期表的关系1.比较判断下列各组微粒半径的大小,并说明原因。
(1)Ba>Sr,同族元素,电子的能层数越多,半径越大。
(2)Ca>Sc,同周期元素,电荷数越大,半径越小。
(3)S2->S,同一元素,电子数越多,半径越大。
(4)Na+>Al3+,具有相同的电子层结构的离子,核电荷数越大,半径越小。
(5)Pb2+>Sn2+,同族元素的离子,所带电荷相同,电子层数越多,半径越大。
(6)Fe2+>Fe3+,同一元素的离子,电子数越少,正电荷数越高,半径越小。
2.微粒半径大小的判断方法规律。
(1)同周期元素的原子半径、最高价阳离子半径、最低价阴离子半径:随着核电荷数增多,都依次减小(稀有气体除外)。
(2)同主族元素的原子半径、相同价态阳离子半径和阴离子半径:随着核电荷数增多,都依次增大。
(3)核外电子排布(即电子层结构)相同的离子半径:随核电荷数增多,半径依次减小。
(4)同种元素形成的粒子半径:阳离子<中性原子<阴离子,且阳离子价态越高,半径越小。
如:Fe3+<Fe2+<Fe,Cl<Cl-,H+<H<H-。
(5)核电荷数和电子数都不同的粒子,一般要找参考物。
如比较Al3+和S2-,可找出与Al3+电子数相同,与S2-同一主族的元素O2-来比较,因为Al3+<O2-,且O2-<S2-,故Al3+<S2-。
“三看”比较微粒半径的大小“一看”电子的能层数:当电子的能层数不同时,能层数越多,半径越大。
“二看”核电荷数:当电子的能层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子的能层数和核电荷数均相同时,核外电子数越多,半径越大。
例5下列原子半径大小顺序正确的是()①1s22s22p3②1s22s22p63s23p3③1s22s22p5④1s22s22p63s23p2A.③>④>②>①B.④>③>②>①C.④>③>①>②D.④>②>①>③【考点】微粒半径的大小与比较【题点】原子半径的大小与比较答案D解析由核外电子排布式可知,①、②、③、④四种元素分别是N、P、F、Si,结合原子半径的递变规律可知,大小顺序为④>②>①>③。
例6下列化合物中阴离子半径和阳离子半径之比最大的是()A.LiIB.NaBrC.KClD.CsF【考点】微粒半径的大小与比较【题点】离子半径的大小与比较答案A解析碱金属离子半径:r(Li+)<r(Na+)<r(K+)<r(Cs+),卤素离子半径:r(F-)<r(Cl-)<r(Br-)<r(I-),显然,阴离子半径和阳离子半径之比最大的是LiI。
1.元素第一电离能的概念与意义(1)概念:①第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能,符号:I1。
②逐级电离能:气态基态一价正离子再失去一个电子成为气态基态二价正离子所需的最低能量叫做第二电离能,第三电离能和第四、第五电离能依此类推。
由于原子失去电子形成离子后,若再失去电子会更加困难,因此同一原子的各级电离能之间存在如下关系:I1<I2<I3……(2)意义:可以衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。
2.元素第一电离能变化规律(1)第一电离能的变化趋势如下图所示:(2)观察分析上图,总结元素第一电离能的变化规律①对同一周期的元素而言,从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子。
②同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越易失去电子。
③具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值较大。
如稀有气体的电离能在同周期元素中最大,N为半充满、Mg为全充满状态,其电离能均比同周期相邻元素大。
3.电离能的应用(1)根据电离能数据,确定元素原子核外电子的排布及元素的化合价。
如Li:I1≪I2<I3,表明Li 原子核外的三个电子排布在两个能层上(K、L能层),且最外层上只有一个电子,易失去一个电子形成+1价阳离子。
(2)判断元素的金属性、非金属性强弱:I1越大,元素的非金属性越强;I1越小,元素的金属性越强。
电离能的变化规律(1)电离能数值的大小主要取决于原子的核电荷数、原子半径及原子的电子构型。
(2)第一电离能的变化规律例7下列有关电离能的说法,正确的是()A.第一电离能越大的原子失电子的能力越强B.第一电离能是元素的原子失去核外第一个电子需要的能量C.同一周期中,主族元素原子第一电离能从左到右越来越大D.可通过一种元素各级电离能的数值,判断元素可能的化合价【考点】元素的电离能【题点】元素第一电离能的概念及递变规律答案D解析①第一电离能是气态电中性原子失去核外第一个电子需要的能量;②元素原子的第一电离能越大,表示该元素的原子越难失去电子;③从总的变化趋势上看,同一周期中元素的第一电离能从左到右逐渐增大,但有反常,如I1(N)>I1(O)。
例8元素X的各级电离能数据如下:则元素X的常见价态是()A.+1B.+2C.+3D.+6答案C解析对比表中电离能数据可知,I1、I2、I3数值相对较小,至I4数值突然增大,说明元素X 的原子中,有3个电子容易失去,因此,该元素的常见化合价为+3。
方法规律元素的各级电离能逐渐增大并且会有突跃,一般第一次突跃前的电离能所对应的电子是最外层电子,对于金属元素来说,该类电子的个数就是该元素的最高正化合价。