原子结构与元素性质
- 格式:doc
- 大小:721.50 KB
- 文档页数:33
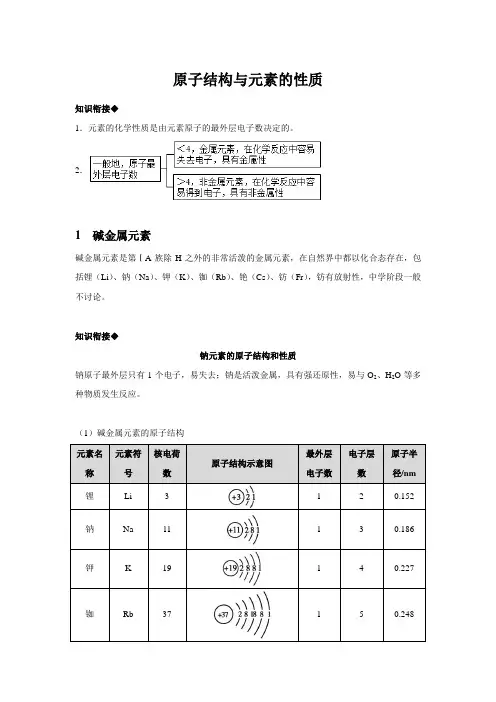
原子结构与元素的性质知识衔接◆1.元素的化学性质是由元素原子的最外层电子数决定的。
2.1 碱金属元素碱金属元素是第ⅠA族除H之外的非常活泼的金属元素,在自然界中都以化合态存在,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr),钫有放射性,中学阶段一般不讨论。
知识衔接◆钠元素的原子结构和性质钠原子最外层只有1个电子,易失去;钠是活泼金属,具有强还原性,易与O2、H2O等多种物质发生反应。
(1)碱金属元素的原子结构由表中信息分析可知:(2)碱金属单质的主要物理性质(3)教材P94·探究碱金属化学性质的比较①碱金属与氧气的反应K+O2KO2(超氧化钾)2Na+O2Na2O2钾的焰色钠的焰色总结◆相同条件下,碱金属从Li到Cs,与O2反应越来越剧烈,产物越来越复杂,说明金属越来越活泼。
名师提醒(1)做碱金属化学性质的比较实验时,碱金属一般取绿豆大小为宜。
若用量过多,实验时易发生危险。
在使用前,要用滤纸吸干钾、钠等金属表面的煤油。
未用完的钾、钠要放回原试剂瓶。
(2)碱金属在空气中加热与O2反应,Li与O2反应主要生成Li2O,Na与O2反应生成Na2O2,K与O2反应生成KO2,Rb和Cs遇空气立即燃烧,生成更复杂的产物。
改变反应条件,K 也能与O2反应生成K2O、K2O2。
②碱金属与水的反应总结◆相同条件下,碱金属从Li到Cs,与水反应越来越剧烈,说明金属越来越活泼,反应方程式可用通式表示:2R+2H2O===2ROH+H2↑。
名师提醒(1)碱金属单质与H2O反应生成强碱和H2,Li反应剧烈(但比Na弱),Rb和Cs遇H2O 立即燃烧、甚至会爆炸。
着火时,不能用水灭火,必须用干燥的沙土扑灭(2)由于Li、Na、K能与O2和H2O反应,故实验室中Na、K保存在煤油中,Li(密度比煤油的小)常保存在液体石蜡中。
(3)碱金属与盐溶液反应时,可以看作是碱金属先与H2O反应生成碱和H2,而非直接与盐发生置换反应。

原子结构与元素的性质原子是构成所有物质的基本单位。
原子结构与元素的性质之间存在密切的关系。
原子结构包括原子的核和电子壳层,而元素的性质则取决于这些结构的特征。
在本文中,我将详细探讨原子结构与元素性质之间的关系。
原子结构可以通过元素的原子序数和质子数来描述。
原子的核心由质子和中子组成,质子带有正电荷,中子是中性的。
质子数决定了元素的原子序数,而中子的数量决定了元素的同位素。
原子核外围则是由电子壳层组成。
电子是带有负电荷的粒子,它们以不同的能级围绕核心转动,每个能级可以容纳一定数量的电子。
电子的数目与元素的原子序数相等。
原子结构对元素性质的影响主要体现在原子的化学性质和物理性质上。
原子的化学性质包括元素的化学反应性、反应类型和化学键的形成。
原子的物理性质则包括元素的物理状态、密度、熔点、沸点和电导率等。
首先,原子结构决定了元素的原子半径。
原子半径是指原子中心到电子壳层边界的距离。
随着原子核的电荷数增加,原子的半径减小。
这是因为质子带有正电荷,而电子带有负电荷,它们之间存在电磁力的相互作用。
根据库仑定律,质子和电子之间的排斥力越大,原子半径就越小。
其次,原子结构还决定了元素的化学反应性。
元素的化学反应性取决于电子结构中未填满的能级。
具有未填满能级的元素更容易发生化学反应,以获得稳定的电子结构。
例如,碱金属元素的电子结构中有一个未填满的s能级,因此它们很容易失去一个电子,与其他元素形成阳离子。
另外,原子结构也影响了元素的物理性质。
原子的物理性质主要由原子核和电子之间的相互作用力以及电子之间的相互作用力决定。
原子核和电子之间的相互作用力决定了原子的密度和硬度。
电子之间的相互作用力决定了原子的熔点和沸点。
还有一些元素的性质与原子的同位素有关。
同位素具有相同的质子数,但不同的中子数。
由于中子的数量不同,同位素的质量也会有所不同。
同位素的存在可以影响元素的物理性质,例如稳定同位素的存在可以提高元素的熔点和沸点。

元素的原子结构及其化学性质元素是组成物质的基本单位,其原子结构和化学性质是研究化学的基础。
本文将详细介绍元素的原子结构及其化学性质。
一、原子结构原子是最小的物质单位,具有无限的分解能力。
在现代原子理论中,原子结构被分为三个组成部分:质子、中子和电子。
质子和中子位于原子核中心,占据原子的大部分质量,而电子则绕核旋转,占据大部分原子的体积。
原子核的电荷为正电荷,电子的电荷为负电荷,因此原子整体带有净电荷为0的性质。
元素的质子数为每种元素的唯一特征,称作原子序数。
原子序数为1的元素是氢(H),原子序数为2的元素是氦(He),以此类推。
元素的核外层的电子数,决定了元素的性质和化学反应能力。
原子的电子排布方式是按照“能量最低、能级最少”的原则排布,也称作能级填充原则。
二、周期表元素的周期性是指,在同一周期内,原子核内的质子数不断增加,电子数不断增加,外层电子在同一层次上填满,导致原子性质的周期性变化。
Dmitri Mendeleev将元素按照原子序数和化学性质排列,并形成了我们熟知的现代元素周期表。
周期表的竖列为元素的族,每个族的元素具有相似的物理和化学性质。
周期表的水平行被称为一周期,同时在相邻一周期内的元素具有相似的元素化学性质。
由此,周期表成为研究元素化学性质和性质周期性的基础。
三、元素的化学性质元素的化学性质包括元素的原子结构、元素的反应活性和元素的物理性质。
1. 元素的反应活性元素的反应活性是指元素自身或与其他物质发生反应的能力。
化学反应是通过原子的失去或获得电子实现的,因此,原子外层的电子数越少,该元素就越容易与其他元素反应形成化合物。
金属元素与非金属元素的反应活性是不同的。
金属元素在化学反应中,通常是丧失外层电子形成离子,再和其他原子形成化合物。
非金属元素则通常是在反应中获得一个或多个外层电子,形成阴离子或分子化合物。
元素的反应活性可以通过电位高低、键结构和化学结构等来指示。
2. 元素的物理性质元素的物理性质包括元素的密度、熔点、沸点和硬度等特征。

原子结构与元素的性质原子结构是指原子内部的组成和排列方式。
了解原子结构对于理解元素的性质和元素间的相互作用具有重要意义。
本文将分别从电子结构、质子中子和核结构、元素周期表三个方面探讨原子结构与元素性质的关系。
电子结构是指原子中电子的组织和排列。
电子质量较小,带负电荷,存在于原子的能级中。
电子也分为主量子数、角量子数和磁量子数。
主量子数决定电子的能级,角量子数决定电子的角动量,磁量子数则决定电子的磁性。
电子的排布遵循泡利不相容原理、阴影填充原理和洪特规则。
波利不相容原理表明在同一原子中的任意两个电子不能拥有完全相同的四个量子数。
这是因为电子都带负电荷,如果它们有相同的量子数,则它们的相互斥力将会非常大,从而导致原子不稳定。
所以在每个轨道上的电子数是有限的。
阴影填充原理指出,当填充电子时,首先填充最低能量轨道。
每个轨道最多容纳2个电子,这两个电子的自旋方向相反。
洪特规则是指电子在能量相同的轨道上填充时,会尽可能地使轨道电子数最多。
这意味着电子首先会填充每个轨道的一个电子,然后再填充第二个电子。
不同原子的电子结构不同,这导致了元素在化学性质上的差异。
例如,原子中最外层的电子称为价电子,是决定元素化学性质的关键。
价电子的数量和分布将影响元素的化学反应性质、化合价、电负性等。
根据元素的周期性表现,我们可以发现元素的性质随着原子序数的增加而变化。
在原子的质子中子和核结构方面,质子和中子密集地集中在原子的中心,形成原子核。
质子质量为1,中子质量几乎与质子相同。
原子核的正电荷来自质子,负电荷则由电子提供并且平衡了正电荷。
原子核的电子数目和质子数目相等,使得原子整体电中性。
原子中子质子数目的差异决定了同位素。
中子数量的不同会影响原子的稳定性、核衰变和放射性。
原子核的结构对元素的性质也产生着重要影响。
质子和中子的数量不同会影响原子核的质量。
同位素之间的核能量差异导致了核反应和核能的应用。
例如,核裂变和核聚变是通过改变原子核的结构来释放巨大能量的反应。

原子结构与元素的性质关系在科学领域中,原子结构与元素的性质之间存在着密切的关系。
原子结构是指元素中原子的组成方式,包括了原子的质子、中子和电子等组成部分。
而元素的性质则是指元素在化学反应中所表现出来的特征或行为。
一、原子结构的基本组成原子是构成物质的基本单位,它由中心的原子核和环绕核的电子云组成。
原子核是由带正电的质子和不带电的中子组成的。
质子的电荷为正,数量决定了元素的原子序数,而中子则决定了原子的质量数。
原子核的质量集中在中子和质子之间,而体积非常微小。
电子云则是由带负电的电子组成的,电子数量等于质子数量,使得原子整体呈电中性。
二、电子的能级分布电子云有不同的能级,数目多少由原子的电子层决定。
电子层是以固定的能量级别划分的,最内层能量最低,外层依次递增。
每个电子层都有一定的电子容纳数目,第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子,依此类推。
电子的排布遵循普遍准则:填满低能级的电子层后再填高能级。
三、元素的性质与电子结构的关系元素的性质与其原子的电子结构密切相关。
以下通过几个方面来探讨。
1. 原子的尺寸原子的尺寸主要由其电子云的外延决定,是指从原子核到外层电子所在轨道的距离。
一般来说,原子越大,电子云外扩程度越大。
原子尺寸影响着元素的性质,如金属的导电性就与其较大的原子尺寸有关,因为原子尺寸大意味着留给电子移动的空间更多。
2. 原子的电离能和电子亲和能电离能是指从一个原子中移走一个电子所需的能量。
电子亲和能则是指一个原子从其它原子那里接收一个电子所释放的能量。
通常来说,元素的电离能和电子亲和能越大,其原子可以更容易地失去或获得电子。
例如,碱金属元素的电离能很低,容易失去电子形成阳离子,而卤素元素的电子亲和能很高,易于接受电子形成阴离子。
3. 原子的化合价原子的化合价是指一个原子在化学反应中与其他原子结合时提供或接受的电子数目。
元素的化合价与其电子云最外层的电子数目有关。
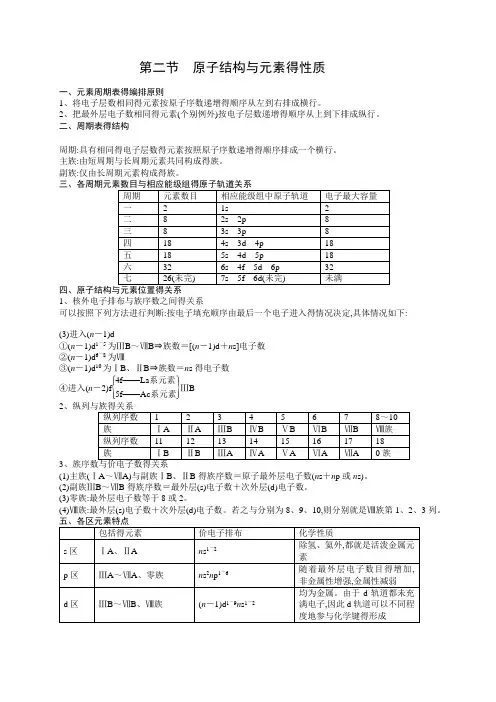
第二节 原子结构与元素得性质一、元素周期表得编排原则1、将电子层数相同得元素按原子序数递增得顺序从左到右排成横行。
2、把最外层电子数相同得元素(个别例外)按电子层数递增得顺序从上到下排成纵行。
二、周期表得结构周期:具有相同得电子层数得元素按照原子序数递增得顺序排成一个横行。
主族:由短周期与长周期元素共同构成得族。
副族:仅由长周期元素构成得族。
1、核外电子排布与族序数之间得关系可以按照下列方法进行判断:按电子填充顺序由最后一个电子进入得情况决定,具体情况如下:(3)进入(n -1)d①(n -1)d 1~5为ⅢB ~ⅦB ⇒族数=[(n -1)d +n s]电子数②(n -1)d 6~8为Ⅷ③(n -1)d 10为ⅠB 、ⅡB ⇒族数=n s 得电子数④进入(n -2)f ⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫4f ——La 系元素5f ——Ac 系元素ⅢB 23(1)主族(ⅠA ~ⅦA)与副族ⅠB 、ⅡB 得族序数=原子最外层电子数(n s +n p 或n s)。
(2)副族ⅢB ~ⅦB 得族序数=最外层(s)电子数+次外层(d)电子数。
(3)零族:最外层电子数等于8或2。
(4)Ⅷ族:最外层(s)电子数+次外层(d)电子数。
若之与分别为8、9、10,则分别就是Ⅷ族第1、2、3列。
1、同周期,从左到右,原子半径依次减小。
2、同主族,从上到下,原子或同价态离子半径均增大。
3、阳离子半径小于对应得原子半径,阴离子半径大于对应得原子半径,如r(Na+)<r(Na),r(S)<r(S2-)。
4、电子层结构相同得离子,随核电荷数增大,离子半径减小,如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
5、不同价态得同种元素得离子,核外电子多得半径大,如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
特别提醒在中学要求得范畴内可按“三瞧”规律来比较微粒半径得大小“一瞧”能层数:当能层数不同时,能层越多,半径越大。

化学元素的原子结构与性质化学元素是构成物质的基本单位,每个元素都有独特的原子结构和性质。
了解元素的原子结构对于理解元素性质和化学反应至关重要。
本文将介绍化学元素的原子结构和性质,并探讨二者之间的关系。
一、原子结构化学元素的原子由原子核和围绕核运动的电子构成。
原子核由质子和中子组成,质子带正电荷,中子不带电。
原子核带有正电荷,而电子带有负电荷,这种相反电荷之间的吸引力维持着电子围绕原子核运动。
原子的质子数决定了元素的原子序数,也称为元素的核电荷数。
原子中的电子以能级或轨道的形式存在。
每个能级具有一定数量的子壳,而每个子壳又包含一定数量的轨道。
每个轨道最多可以容纳一对电子,且电子在同一个轨道上自旋方向相同。
轨道按照能级从低到高排列,分为K、L、M、N等不同的字母表示。
二、元素性质不同元素的原子结构导致了它们的性质差异。
元素的性质可以分为物理性质和化学性质。
1. 物理性质物理性质是指物质不发生化学变化时所表现出的性质。
这些性质主要包括颜色、硬度、密度、熔点、沸点等。
例如,金属元素通常具有良好的导电性和导热性,这与它们具有自由电子和紧密排列的结构有关。
2. 化学性质化学性质是指物质与其他物质发生化学反应时所表现出的性质。
元素的化学性质主要取决于其原子结构中的电子配置。
原子的外层轨道电子数目决定了元素的化学反应活性。
一般来说,内层电子较稳定,不易被其他原子接触,而外层电子较活跃,容易参与化学反应。
三、原子结构与性质的关系元素的原子结构决定了元素的性质,这正是因为不同元素具有不同的原子结构,才能体现出它们独特的性质。
1. 周期表和元素性质元素周期表是一种将元素按原子序数和电子结构排列的方式。
通过周期表的布局,我们可以观察到一些明显的规律,例如,元素的周期性重复性质。
这是因为周期表中的元素具有相似的电子配置,导致它们具有类似的化学性质。
2. 价电子和化学反应价电子是指原子最外层轨道上的电子,也是参与元素化学反应的主要电子。

原子结构与元素的性质一,原子结构与元素周期表元素周期系的一个周期:碱金属开始,稀有气体结束元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复元素周期系的周期并不是单调的,每一周期里的元素并不总是一样多,而是随周期序号的递增渐渐增多,同时,金属元素的数目也逐渐增多我们可以形象的把元素周期系的周期发展比喻为螺壳上的螺纹元素周期表的结构与原子结构的关系是最基本的化学知识之一二,元素周期律元素的性质随核电荷数的递增发生周期性的递变,称为元素周期律1,原子半径原子半径大小取于两个相反的因素:电子的能层数,核电荷数。
电子的能层越多,电子之间的负电排斥将使原子的半径增大;核电荷数越多,核对电子的引力也就越大,将使原子的半径缩小2,电离能第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量上述表述中的气态、基态、电中性、失去一个电子等都是保证最低能量的条件规律:同一周期元素的第一电离能从左到右依次增大同一主族元素的第一电离能从上到下依次下降3,电负性元素相互化合,可理解为原子之间产生化学作用力,形象的叫做化学键,原子中用于形成化学键的电子称为键合电子电负性:用来描述不同元素的原子对键合电子吸引力的大小电负性越大的原子,对键合电子的吸引力越大以氟的电负性4.0作为相对标准,得出各元素的电负性(稀有气体未计)规律:一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小。
电负性可作为判断元素的金属性和非金属性强弱的尺度。
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,电负性在1.8左右的元素,既有金属性,又有非金属性。
科学探究:对角线规则:在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的(在空气中燃烧的产物,氢氧化物的酸碱性,含氧酸酸性的强弱)锂、镁;铍、铝;硼、硅。


《原子结构与元素的性质》讲义一、原子结构原子是化学变化中的最小粒子,但原子本身也具有复杂的结构。
原子由原子核和核外电子构成,原子核又由质子和中子组成。
质子带正电荷,中子不带电,电子带负电荷。
原子中质子数等于电子数,因此整个原子呈电中性。
原子核的体积很小,但却集中了原子的绝大部分质量。
核外电子在原子核外的空间里做高速运动。
电子在核外的运动状态并不是随意的,而是具有特定的分层排布规律。
我们可以用电子层来描述电子的运动区域,分别称为 K、L、M、N 等层。
电子在不同的电子层上具有不同的能量。
离原子核越近的电子层,电子的能量越低;离原子核越远的电子层,电子的能量越高。
二、原子核外电子排布电子在原子核外的排布遵循一定的规律。
首先,各电子层最多容纳的电子数为2n²个(n 为电子层数)。
例如,第一层最多容纳2 个电子,第二层最多容纳 8 个电子。
其次,最外层电子数不超过 8 个(当 K 层为最外层时,电子数不超过 2 个)。
原子为了达到稳定结构,会通过得失电子或形成共用电子对的方式来使最外层电子数达到 8 个(或 2 个)的稳定结构。
这种电子的得失或共用电子对的形成,决定了原子的化学性质。
例如,钠原子的核外电子排布为 2、8、1,最外层只有 1 个电子,容易失去这个电子形成带正电荷的钠离子;而氯原子的核外电子排布为 2、8、7,最外层有 7 个电子,容易得到 1 个电子形成带负电荷的氯离子。
三、元素周期表元素周期表是化学中非常重要的工具,它按照原子序数递增的顺序排列元素,同时将具有相似化学性质的元素放在同一纵行。
周期表共有 7 个横行,称为周期;18 个纵行,称为族。
同一周期的元素,电子层数相同,从左到右原子序数递增,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,最外层电子数相同,从上到下电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
元素周期表中的元素性质呈现周期性的变化规律,这与原子结构的周期性变化密切相关。

原子结构与元素性质的关系在化学领域,原子结构和元素性质之间存在着密切的关系。
原子结构指的是一个元素中原子的组成以及原子中各个组成部分的排列方式,而元素性质则是指一个元素所特有的化学和物理性质。
本文将从电子结构、质子和中子的数量以及元素周期表的角度探讨原子结构和元素性质之间的紧密联系。
1. 电子结构对元素性质的影响原子的电子结构决定了元素的化学性质。
电子结构由电子的能级和轨道组成。
首先,能级决定了原子的化学稳定性。
稳定的原子通常具有完全填满的能级,即每个能级的电子数达到该能级的容量上限。
例如,氢气原子中只有一个能级,其容量为2个电子,因此氢气相对较不稳定。
而氖气原子具有完整的第二能级,其容量为8个电子,因此氖气非常稳定。
稳定性对于元素的反应性、化合价等方面具有重要影响。
其次,原子的电子轨道决定了元素的物理性质,尤其是电子的运动行为。
不同轨道形状和能量导致了电子在原子中的分布情况以及对外界电场的响应。
例如,s轨道是球形对称的,电子在s轨道中呈现球形云集中的形态,这就解释了为什么s轨道中的电子比其他轨道更容易参与化学反应。
而p轨道有三个不同的形态,每个形态在不同空间方向上分布,这使得p轨道中的电子能够更容易发生能级跃迁。
因此,电子结构是化学反应的基础,直接决定了元素的化学性质。
2. 质子和中子对元素性质的影响质子和中子是原子的核心组成部分,它们的数量直接决定了一个原子的质量数和原子量。
质子的数量决定了一个元素的原子序数,从而确定了元素的位置以及化学性质。
例如,氢气原子中只有一个质子,因此它的原子序数为1。
氢气的化学性质与其他元素存在较大差异。
而氦气原子有两个质子,因此它的原子序数为2,与氢气相比,氦气的化学性质也有所不同。
原子量的差异也导致了同位素的存在,同位素有着不同的核子组成,因此在某些情况下具有不同的化学性质。
中子的数量对于原子的稳定性和核反应有重要影响。
正常情况下,原子的中子数量与质子数量相等或接近相等。
原子结构与元素性质人们对原子结构的认识不断深入,原子结构与元素性质之间的关系也日益清晰。
本文将介绍原子结构的组成和元素性质的相关内容。
一、原子结构的组成原子是构成物质的基本单位,由电子、质子和中子组成。
电子被围绕在原子核外的轨道上,具有负电荷;质子位于原子核内部,具有正电荷;中子也位于原子核内部,没有电荷。
原子核的正电荷与电子的负电荷相等,使得原子呈现整体电中性。
原子的质量主要集中在原子核中,电子的质量可以忽略不计。
根据电荷的不同,原子核和电子围绕的轨道处于静电吸引和斥力的平衡状态。
二、元素的性质与原子结构元素是由具有相同原子数目的原子组成的纯物质。
每个元素都有其特定的性质,这些性质与原子结构有密切关系。
1. 原子序数和元素周期表元素周期表是根据元素的原子序数排列的一张表格。
原子序数表示元素原子核中质子的数目,也决定了元素的化学性质。
原子序数依次增加,元素的性质也会发生相应变化。
2. 原子半径与电子壳层原子半径是指从原子核到最外层电子轨道的距离。
原子的外层电子越远离原子核,原子半径越大。
电子层数也会影响原子半径,层数增加,原子半径也会增加。
原子半径的变化会影响元素的化学反应性能和金属特性。
3. 电子的能级与原子结合能原子中的电子被分布在不同能级上,每个能级上最多容纳一定数量的电子。
电子的能级和分布方式直接影响元素的化学反应性质和原子的结合能。
原子的结合能是指原子中质子和中子的总和。
原子核越稳定,结合能越大,相应的,元素的化学活性就越低。
4. 元素的离子化倾向和电负性元素的离子化倾向是指元素形成离子的倾向程度。
原子的电子亲和焓和电离能是衡量元素离子化倾向的重要指标。
电子亲和焓是指一个原子获得一个电子时释放的能量,电离能是指一个原子失去一个电子时需要的能量。
元素的电负性是指元素原子对电子的亲和能力,在化学键中起到重要作用。
电负性较大的元素会吸引其他元素的电子,形成共价键或离子键。
5. 同位素与放射性同位素是指具有相同原子序数但质量数不同的元素。
原子结构与元素性质原子是构成物质的最基本单位,其结构和性质是我们理解物质世界的基石。
原子的结构包括核和电子,而元素性质则反映了不同原子之间的差异。
首先,让我们来看一下原子的结构。
原子核位于原子的中心,由质子和中子组成,质子具有正电荷,中子则没有电荷。
电子以轨道的形式围绕着核运动,具有负电荷。
质子和中子合称为核子,而核子的数量决定了原子的质量数。
而质子的数量则决定了原子的原子序数,即各种元素的特征标志。
原子的核和电子之间通过电磁力相互作用。
核内的质子具有正电荷,电子则具有负电荷。
根据库仑定律,相同电荷之间的作用力是排斥的,而相反电荷之间的作用力是吸引的。
正电荷引力作用于负电荷,使得电子能够围绕原子核相对稳定地运动。
尽管电子以轨道形式围绕原子核运动,但它们的确切位置不能确定,而是呈现出一种概率分布。
这是由于电子的波粒二象性所致。
根据量子力学理论,电子存在于一系列能级中,每个能级可以容纳一定数量的电子。
这些能级以不同的壳层和子壳层来表示。
例如,第一能级是最靠近原子核的,可以容纳最多2个电子。
第二能级可以容纳最多8个电子,第三能级可以容纳最多18个电子,依此类推。
元素性质是由原子的结构决定的。
第一个决定因素是原子的电子排布。
每个壳层和子壳层上的电子数量不同,决定了元素的化学性质。
例如,氢原子只有一个电子,位于第一能级。
氧原子有8个电子,分布在两个能级上,其中第一能级有2个电子,第二能级有6个电子。
氧原子的第二能级最外层是满的,因此具有化学上的稳定性。
其次,原子的核子数量也会影响元素的性质。
质子和中子的数量决定了原子的质量,而质子的数量决定了原子的原子序数。
原子的质量和原子序数决定了元素的同位素和同位素在自然界中的丰度。
另一个影响原子性质的因素是电子的能级结构。
能级结构会影响原子的化学反应性能。
当原子接受或者释放能量时,电子可以从一个能级跳到另一个能级。
当电子从低能级跳到高能级时,需要吸收能量,当电子从高能级跳到低能级时,会释放出能量。
原子结构与元素与的性质原子结构是物质的基本组成单位。
元素是由具有相同原子序数的原子组成的物质,是化学反应无法分解的物质。
原子结构与元素的性质密切相关,通过研究原子结构,可以揭示元素的特性和行为。
原子的结构可以分为三个主要组成部分:质子、中子和电子。
质子和中子位于原子核中,而电子则围绕着核外层轨道运动。
质子和中子具有相同的质量,质子带有正电荷,中子是中性粒子。
电子带有负电荷,其质量比质子和中子小得多。
原子的质量主要由质子和中子的总和决定,而电子的数量则决定着原子的电性。
原子核中的质子和中子的数量决定了元素的原子序数和质量数。
原子序数是指元素的质子数量,质量数是指元素的质子和中子数量的总和。
质子数量决定了元素的化学性质和元素周期表的排列。
例如,氢原子只有一个质子,因此其原子序数为1,而氧原子有8个质子,原子序数为8、元素周期表将元素按照其原子序数排列,每个新的原子序数意味着新增一个质子。
原子的电子层结构也对元素的性质有重要影响。
电子围绕原子核外层轨道运动,不同层次的电子具有不同的能量级别和角动量。
最靠近核的1s层只能容纳2个电子,其次是2s层和2p层,分别可以容纳2个和6个电子。
较外层的电子能级越高,离核越远,能级也越高。
电子的填充顺序遵循洪特规则:按照能级递增和同一能级中的电子自旋相反的原则进行填充。
原子的化学性质主要由其电子结构决定。
化学反应通常涉及电子的重新排列或共享。
原子具有空的能级或部分空的能级会更稳定,因此它们具有更强的化学活性。
一般来说,在化学反应中,原子倾向于通过损失、获得或共享电子来达到最稳定的电子结构。
这解释了为什么不同元素之间会发生化学反应并形成化合物。
原子结构和元素的性质还可以通过研究原子谱学来研究。
原子谱学研究原子吸收或放射特定波长的辐射时的行为。
通过测量原子吸收或发射光谱,可以确定元素的存在和类型。
不同元素具有不同的能级结构和电子跃迁,因此会产生不同的谱线。
这种技术在元素分析和识别中得到广泛应用。
原子结构与元素性质首先,我们来看原子结构。
原子是物质的基本组成单位,由原子核和围绕在核外的电子构成。
原子核由质子和中子组成,质子带正电荷,中子不带电。
电子带负电荷,围绕原子核中心的轨道上运动。
原子的质量主要集中在原子核中,电子的质量相对较小。
原子核的结构对元素的性质有着重要的影响。
首先是质子的数量。
质子决定了原子的元素特性,也就是原子的原子序数(或称为质子数)。
不同的元素由于质子数不同,其原子核中的质子数也不同。
例如,氢的原子核中只有一个质子,而氧的原子核中有八个质子。
这种质子数的差异直接导致了不同元素之间的化学性质的不同。
例如,氢原子倾向于与其他元素共价结合形成化合物,而氧原子倾向于形成带有负电荷的离子。
另外一个影响原子结构的因素是中子的数量。
中子数决定了原子的同位素。
同位素指的是拥有相同质子数但中子数不同的原子。
同位素在化学性质上基本相似,但可能在核反应、放射性衰变等方面有所不同。
原子核外的电子结构也对元素的性质产生了很大的影响。
电子是带负电荷的,它们通过电子云的方式环绕在原子核附近的轨道上。
电子的运动状态由量子力学描述,也就是由其波函数决定。
有几个重要的概念需要我们了解:主量子数、角量子数、磁量子数和自旋量子数。
主量子数决定了电子所在轨道的能级,角量子数决定了电子在轨道上的角动量大小和形状,磁量子数决定了电子角动量在空间中的方向,而自旋量子数决定了电子自旋的方向。
电子的分布和排布遵循泡利不相容原理,即每个电子在一个原子中都有唯一的一组量子数和自旋状态。
这也反映了原子结构的稳定性和宏观性质的多样性。
原子核的正电荷和电子的负电荷相互吸引,使得电子在原子核附近形成一个相对稳定的电子云。
不同元素的电子排布方式和数量不同,这直接决定了元素的化学性质。
例如,元素周期表就是将元素按照电子结构的规律排列而成的工具。
元素周期表的左侧为金属元素,右侧为非金属元素,而位于两者之间的为过渡元素。
此外,电子的排布方式还决定了原子之间的化学键的形成。
原子结构和元素的性质原子结构是指原子的组成和构造方式,包括原子的核心和电子分布。
元素的性质则是指元素在化学反应中表现出的特性和行为。
原子结构由原子核和围绕核的电子组成。
原子核位于原子的中心,由质子和中子组成。
质子带正电荷,中子不带电荷。
原子核的质量约为整个原子质量的99.9%,但体积仅为整个原子体积的0.01%。
电子以环绕核的方式存在于原子外部,在电子层中运动。
电子的质量很小,约为质子质量的1/1836,并且带有负电荷。
原子核的质子数等于元素的原子序数,决定了元素的化学性质。
质子数不同的元素属于不同的元素,如氢元素的原子核只包含一个质子,氧元素的原子核包含八个质子。
中子数的不同会导致同一原子的同位素。
电子的数目等于质子数,也决定了元素的化学性质。
电子的排布同样影响元素的性质。
化学性质是指元素在与其他物质反应时的性质。
元素的化学性质与其原子的化学键或键的特性有关。
元素可以与其他元素形成离子键或共价键。
离子键是由正离子和负离子之间的相互吸引力形成的,共价键是由共享电子形成的。
元素的共价键通常决定了元素的化学活性和稳定性。
元素的化学性质还与其元素的电子层排布以及电子的能级和轨道分布有关。
原子的电子排布决定了元素的电子亲和能和电离能。
电子亲和能是指一个原子吸收一个外部电子形成阴离子时释放的能量。
电离能是指一个原子失去一个电子形成阳离子时需要吸收的能量。
这些能量的大小决定了元素的化学反应的易进行程度。
此外,元素的性质还与元素的周期表位置有关。
周期表是按照原子核电荷数增加的顺序排列的元素表。
周期表可以用来预测元素的性质。
元素周期表中的元素具有相似的性质,这是因为它们具有相似的电子结构。
元素周期表的分组和周期给出了元素的外层电子数和不同电子层之间的能量差。
总的来说,原子结构和元素的性质是密切相关的。
原子结构决定了元素的物理性质,而元素的化学性质则由元素的原子结构及其与其他物质的相互作用来决定。
对于理解元素的性质和行为,了解原子结构提供了重要的基础。
原子结构和元素的性质原子结构是指构成物质的最小单元,原子的组成和排列方式。
了解原子结构对于理解元素的性质至关重要。
在本文中,我们将探讨原子结构和元素性质的关系。
原子由三个基本组成部分组成:质子、中子和电子。
质子和中子位于原子核中,而电子则绕核旋转。
质子带有正电荷,中子中性,电子带有负电荷。
质子和中子的总数称为原子核的质量数,而电子的数量称为原子的电荷数。
原子的核外层电子规定了原子元素的化学特性。
原子核和核外电子的相对数量决定了元素的原子量。
原子量是原子质量单位的数量,而不是原子的质量。
例如,氢原子的原子量约为1克/摩尔,而铅原子的原子量约为207克/摩尔。
元素的性质可以分为物理性质和化学性质。
物理性质是指描述物质外部特征和观察到的变化的特征。
它们可以用于对物质进行分类,如密度、熔点、沸点和颜色。
这些性质与元素的原子结构相关。
例如,原子的大小和电荷分布决定了元素的密度和熔点。
原子核的质量数决定了元素的相对原子质量,从而影响了密度。
化学性质是指描述物质在与其他物质反应时发生的变化的特性。
它们涉及元素与其他元素结合形成化合物的能力。
原子的电子结构决定了元素的化学性质。
例如,原子的外层电子数决定了元素的化合价,即元素与其他元素结合的能力。
元素的化学性质还包括元素与酸、碱和氧化剂等物质的反应性。
元素的周期表是一种按照原子结构和性质排列的方式。
它把元素按照原子核的质量数和原子的电荷数进行分类。
周期表的排列方式揭示了元素间的关系和模式。
原子结构相似的元素被放置在同一列中,被称为“族”,具有类似的化学性质。
原子核质量逐渐增加的元素被放置在同一行中,被称为“周期”。
元素的周期表排列方式反映了原子结构对元素性质的影响。
例如,同一族的元素具有相似的原子结构,因此具有类似的化学性质。
例如,群1元素(如钠和钾)具有相似的外层电子配置,都有一个外层电子,因此它们具有相似的化学性质。
此外,原子结构的改变也会导致元素性质的变化。
第二节原子结构与元素的性质一、元素周期表的编排原则1.将电子层数相同的元素按原子序数递增的顺序从左到右排成横行。
2.把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
二、周期表的结构周期:具有相同的电子层数的元素按照原子序数递增的顺序排成一个横行。
主族:由短周期和长周期元素共同构成的族。
副族:仅由长周期元素构成的族。
1.核外电子排布与族序数之间的关系可以按照下列方法进行判断:按电子填充顺序由最后一个电子进入的情况决定,具体情况如下:(3)进入(n -1)d①(n -1)d 1~5为ⅢB~ⅦB ⇒族数=[(n -1)d +n s]电子数②(n -1)d 6~8为Ⅷ③(n -1)d 10为ⅠB、ⅡB ⇒族数=n s 的电子数④进入(n -2)f ⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫4f ——La 系元素5f ——Ac 系元素ⅢB 2.3.(1)主族(ⅠA~ⅦA)和副族ⅠB、ⅡB 的族序数=原子最外层电子数(n s +n p 或n s)。
(2)副族ⅢB~ⅦB 的族序数=最外层(s)电子数+次外层(d)电子数。
(3)零族:最外层电子数等于8或2。
(4)Ⅷ族:最外层(s)电子数+次外层(d)电子数。
若之和分别为8、9、10,则分别是Ⅷ族第1、2、3列。
1.同周期,从左到右,原子半径依次减小。
2.同主族,从上到下,原子或同价态离子半径均增大。
3.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,如r (Na +)<r (Na),r (S)<r (S 2-)。
4.电子层结构相同的离子,随核电荷数增大,离子半径减小,如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
5.不同价态的同种元素的离子,核外电子多的半径大,如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
特别提醒在中学要求的畴可按“三看”规律来比较微粒半径的大小“一看”能层数:当能层数不同时,能层越多,半径越大。
“二看”核电荷数:当能层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当能层数和核电荷数均相同时,核外电子数越多,半径越大。
七、电离能1.第一电离能(1)每个周期的第一个元素(氢和碱金属)第一电离能最小,稀有气体元素原子的第一电离能最大,同周期中自左至右元素的第一电离能呈增大的趋势。
(2)同主族元素原子的第一电离能从上到下逐渐减小。
2.逐级电离能(1)原子的逐级电离能越来越大首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去电子都是能级较低的电子,所需要的能量多;同时,失去电子后离子所带正电荷对电子吸引更强,从而电离能越来越大。
(2)金属元素原子的电离能与其化合价的关系一般来讲,在电离能较低时,原子失去电子形成阳离子的价态为该元素的常见价态。
如Na的第一电离能较小,第二电离能突然增大(相当于第一电离能的10倍),故Na的化合价为+1,而Mg在第三电离能、Al在第四电离能发生突变,故Mg、Al的化合价分别为+2、+3。
八、元素电负性的应用1.元素的金属性和非金属性及其强弱的判断(1)金属的电负性一般小于 1.8,非金属的电负性一般大于 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
(2)金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
(3)同周期自左到右,电负性逐渐增大,同主族自上而下,电负性逐渐减小。
(4)电负性较大的元素集中在元素周期表的右上角。
2.化学键的类型的判断一般认为:如果两个成键元素原子间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素原子间的电负性差小于1.7,它们之间通常形成共价键。
图1(1)上表中的实线是元素周期表的部分边界,请在表中用实线补全元素周期表的边界。
(2)元素甲是第三周期、第ⅥA族元素,请在下边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外层电子排布。
(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:______>______;甲、乙的最高价氧化物水化物的酸性强弱为:______>______(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的________,请写出元素在元素周期表中的位置与元素原子结构的关系:________________________________________________________________________。
解析(1)略(2)因甲位于第三周期、第ⅥA族,则应是硫元素,答案为(3)因乙元素的3p亚层只有一个电子,即其电子排布式为1s22s22p63s23p1,即乙元素是Al,其原子半径大于硫,甲、乙的最高价氧化物对应水化物分别为H2SO4和Al(OH)3,显然酸性前者强于后者。
(4)元素周期律的本质是核外电子排布的周期性变化。
因此元素周期表不是随意设定的,并且元素在周期表中的位置与原子结构密切相关,元素的周期数即为原子核外电子层数;元素所在主族数即为原子结构的最外层电子数。
答案(1)(2)(3)Al S H2SO4Al(OH)3(4)周期性变化元素的周期数即为原子核外电子层数,元素的主族序数即为原子结构的最外层电子数本题考查元素周期律及元素周期表的有关知识,综合性较强,解答本题的关键是掌握元素在周期表中位置、结构、性质三者之间的关系以及同一周期元素性质的递变规律。
可根据元素性质的递变规律体会周期表中不同位置的元素具有不同的结构,所以应该具有不同的性质。
不同元素的原子在分子吸引电子的能力大小可用一数值x来表示,若x越大,则原子吸引电子的能力(1)通过分析x值的变化规律,确定N、Mg的x值围:______<x(Mg)<________;______<x(N)<________。
(2)推测x值与原子半径的关系是________________________________________________________________________。
(1)某有机物结构式为:,在S—N中,你认为共用电子对偏向谁?__________(写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是____________。
(5)预测元素周期表中,x值最小的元素位置____________(放射性元素除外)。
解析由所给数据分析知:同周期,从左到右x值逐渐增大;同主族,从上到下,x值逐渐减小,则(1)同周期中x(Na)<x(Mg)<x(Al),同主族中x(Mg)<x(Be),综合可得:0.93<x(Mg)<1.57,同理:2.53<x(N)<3.44。
(2)x值在周期表中的递变规律与原子半径的恰好相反,即:同周期(同主族)中,x 值越大,其原子半径越小。
(3)对比周期表中对角线位置的x值可知:x(B)>x(Si),x(C)>x(P),x(O)>x(Cl),则可推知:x(N)>x(S),故在S—N中,共用电子对应偏向氮原子。
(4)查表知:AlCl3的Δx =1.55<1.7,又x(Br)<x(Cl),所以AlBr3的Δx应小于AlCl3的,为共价键。
(5)根据递变规律,x值最小的应为Cs(Fr为放射性元素)位于第六周期ⅠA族。
答案(1)0.93 1.57 2.53 3.44 (2)x值越小,半径越大(3)氮(4)共价键(5)第六周期ⅠA 族归纳总结是学习过程中很重要的一种能力,在做该题时可以先找出x值相差不大的元素,分组比较,x 值较大的一组应为非金属元素,x值较小的一组应为金属元素。
然后,再对同一组中的元素的x值进行比较找出变化规律。
不同元素的气态原子失去最外层一个电子所需要的能量,设其为E,如图所示。
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族不同元素的E值变化的特点是:______________________。
各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期,随原子序数增大,E值增大。
但个别元素的E值出现反常现象。
试预测下列关系式中正确的是_________________________________________________________(填写编号,多选倒扣分)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的围:________<E<________。
(4)10号元素E值较大的原因是________________________________________________________________________。
解析此题考查了元素第一电离能的变化规律和同学们的归纳总结能力。
(1)从H、Li、Na、K等可以看出,同主族元素随元素原子序数的增大,E值变小;H到He、Li到Ne、Na到Ar呈现明显的周期性。
(2)从第二、三周期可以看出,第ⅢA和ⅥA族元素比同周期相邻两种元素E值都低。
由此可以推测E(砷)>E(硒)、E(溴)>E(硒)。
(3)根据同主族、同周期规律可以推:E(K)<E(Ca)<E(Mg)。
(4)10号元素是稀有气体元素氖,该元素原子的最外层电子排布已达到8电子稳定结构。
答案(1)随着原子序数的增大,E值变小周期性(2)①③(3)485 kJ·mol-1738 kJ·mol-1(4)10号元素为氖,该元素原子的最外层电子排布已达到8电子稳定结构要综合考虑图示信息,抓住同一主族(如原子序数为1、3、11、19的碱金属族)的E值的大小,同一周期(如3~10号元素)E值的大小规律,且要注意哪些有反常现象。
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )A.K、Na、Li B.Al、Mg、Na C.N、O、C D.Cl、S、P解析本题考查了元素第一电离能的递变规律,由同周期中从左到右,元素的第一电离能逐渐增大知,B、D选项中均逐渐降低;同主族中,从上到下,原子半径增大,第一电离能逐渐减小,故A项正确。
答案 A①通常情况下,第一电离能大的主族元素电负性大,但ⅡA族、ⅤA族元素原子的价电子排布分别为n s2、n s2n p3,为全满和半满结构,这两族元素原子第一电离能反常。