科粤版九年级化学下册7.2物质溶解的量
- 格式:ppt
- 大小:1.93 MB
- 文档页数:37

九年级化学7.2 物质溶解的量粤教版【本讲教育信息】一. 教学内容:7.2 物质溶解的量1. 了解饱和溶液与不饱和溶液的概念2. 了解溶解度的概念,温度对一些固体物质的影响。
3. 了解溶解度曲线的意义二. 教学重点:对饱和溶液、溶解度的理解三. 教学难点:溶解度四. 教学过程:7.2 物质溶解的量(一)复习提问1、什么是溶液?溶液是一种或一种以上的物质分散在另一种物质里,形成的均匀的、稳定的混合物。
2、澄清石灰水、稀盐酸这两种溶液中溶质分别是什么?氢氧化钙、氯化氢气体(二)讲授新课1. 饱和溶液和不饱溶液提出问题日常生活的经验可以告诉我们,糖、食盐易溶解在水中,但是一杯水是否能够无限制地溶解糖或食盐呢?⑴演示实验:向两个烧杯中分别加入15mL水,然后分别不断地向两个烧杯中加入糖和食盐的晶体,边加边振荡。
观察现象:开始,糖和食盐晶体不断溶解,形成透明溶液;最后,大量加入糖和食盐晶体,开始出现晶体不溶解的现象。
(两个烧杯中,糖和食盐晶体都有剩余)⑵小结:在一定温度下,一定量的水中,糖和食盐晶体并不能无限制地溶解⑶总结归纳得出:饱和溶液:在一定的温度下,在一定量的溶剂里,不能再溶解某溶质的溶液叫做该溶质的饱和溶液。
不饱和溶液:在一定的温度下,在一定量的溶剂里,还能继续溶解某溶质的溶液叫做该溶质的不饱和溶液。
⑷问:判断某温度下,某溶液是否饱和的方法是什么?答:加入溶质的晶体,看是否能溶解,不溶则是饱和溶液,否则为不饱和溶液。
(或观察溶液底部是否有晶体存在等方法。
)提出问题在讲溶液“饱和”与“不饱和”时,为什么一定要指明“一定温度”和“一定量溶剂”呢?实验①加热上述含有糖晶体的溶液:观察现象:温度升高后,原来没溶解的糖又溶解了小结:升高温度时,原来的饱和溶液变为不饱和溶液实验②向含有食盐晶体的试管中加入30mL水;观察现象:加水后,原来没溶解的氯化钠又溶解了小结:加水后,原来的饱和溶液变为不饱和溶液总结:在升高温度或增加溶剂量的情况下,原来饱和的溶液就会变为不饱和溶液。

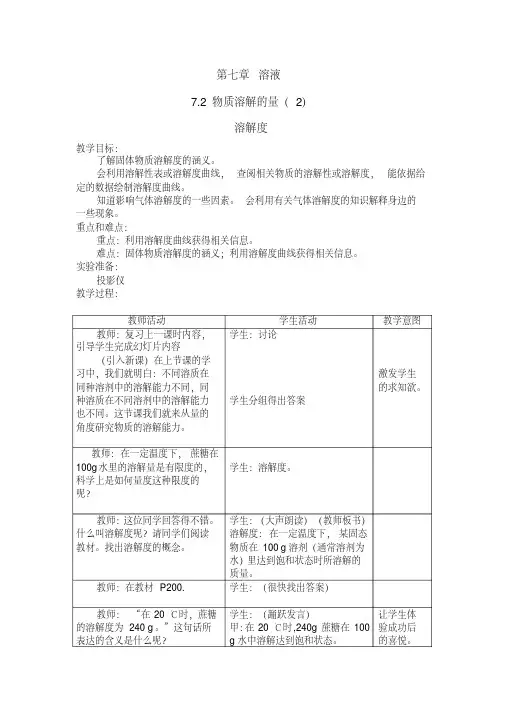





7.2 物质溶解的量(第二课时)教学设计教学目标:知识与技能:1. 明确固体溶质溶解度的概念,初步学会绘制和查阅溶解度曲线图。
2. 知道气体溶解度的表示方法及其影响因素。
3. 理解溶解量、溶解性与溶解度的关系。
4. 学习用溶解度知识对一些日常生活现象的解释。
过程与方法:学会根据不同温度下溶质的溶解度绘制溶解度曲线的方法。
情感、态度、价值观:培养学生理解内因是变化的依据,外因是变化的条件,外因通过内因而起作用的辩证思想。
课型:新授课课时:第二课时教学重点:固体物质的溶解度,初步学会绘制和查阅溶解度曲线图。
教学难点:溶解量、溶解性与溶解度的关系;学会使用溶解度曲线判断温度与溶解度的变化关系。
教具:多媒体、坐标纸、导学案教学过程:情境引入:利用冬天捞碱、夏天晒盐的两张图片引入教师:请小组长反馈学生导学案的完成情况学生展示交流:(二)、固体物质的溶解度:1、溶解量:概念溶解性:概念溶解性包括哪些内容并回忆交流以前学过有些气体的溶解度。
2、固体物质的溶解度:概念3、理解固体溶解度概念的四个要素:一定温度、100g溶剂、饱和溶液、溶质的质量(单位:克)目的:检查学生自主学习的结果【合作交流】“在20 ℃时,某物质的溶解度为21.5 g。
”这句话所表达的含义是什么呢?学生交流,表达自己的理解。
教师展示含义:在20℃时,该物质在100g水中达到饱和状态时溶解的质量为21.5g。
或者能够说:在20℃时,在100g水中最多能溶解21.5g该物质。
【巩固练习】(1).在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____。
(2).在0℃时,100g水中最多可溶解13.3g硝酸钾,则0℃时硝酸钾溶解度是____。
目的:进一步理解固体溶质溶解度的含义4. 溶解度与溶解性的关系:教师:溶解性是说明物质溶解水平的定性表示方法,而溶解度是定量衡量溶解性的尺度,是溶解性的定量表示方法。
溶解度值越大,表明该温度下,物质的溶解水平越强.那么怎么用溶解度来衡量物质的溶解性呢?学生展示交流:溶解性易溶可溶微溶难溶或不溶20℃溶解度大于10g1-10g0.01-1g小于0.01g【练习应用】(1)20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙的溶解性是___溶物质。


7.2 物质溶解的量-科粤版九年级化学下册教案
一、教学目标
1.了解物质溶解的量以及其计算方法。
2.掌握物质溶解的量在实际应用中的应用。
3.培养学生的实验能力和科学探究精神。
二、教学重难点
重点
1.物质溶解的量的概念。
2.物质溶解的量的计算方法。
难点
1.物质溶解的量在实际应用中的应用。
三、教学内容及过程安排
A. 展示
1.展示一张图片,图片中有两瓶水,其中一瓶中加入了三块方糖,然后让学生观察两瓶水的不同处。
2.引导学生体验并总结:经过加入固体溶质后,水的溶解度增大,容纳的溶质的质量增大,这就是物质溶解的量。
B. 实验
1.实验一:设想有 2 克氯化钠溶解在 100 毫升水中,请问能否全部溶解?如果不能,还能溶解多少氯化钠?在实验过程中要注意测量物质的溶解量和计算物质溶解的量。
2.实验二:设想有 5 克葡萄糖以每分钟 50 毫升的速度溶解在 100 毫升水中,请问需要多长时间才能将全部葡萄糖溶解?实验过程中要注意观察物质的溶解过程和测量溶解物质和计算物质溶解的量。
C. 巩固,拓展
1.学生结合实际,思考物质溶解的量在生活中的应用。
例如:调配药物、制作糖果、加工金属等。
2.老师根据学生的思考提醒学生掌握物质溶解的量在生活中的应用,更加深入地理解物质溶解的实质。
四、课堂扩展
1.课后分组完成一个小实验,探究物质溶解量与溶解的物质、溶剂温度等的关系。
2.小组讨论并撰写实验报告,介绍小组实验的过程和结果,并归纳物质溶解的量与其他因素的关系。
