高中化学选修5有机化学讲义
- 格式:docx
- 大小:3.45 MB
- 文档页数:136

第一节 合成高分子化合物的基本方法[学习目标定位] 1.知道并会应用有关概念:单体、高聚物、聚合度、链节、加聚反应和缩聚反应等。
2.熟知加聚反应和缩聚反应的原理,会写相应的化学方程式,学会高聚物与单体间的相互推断。
一、加成聚合反应1.加成聚合反应(加聚反应)已知乙烯分子间相互反应生成聚乙烯的化学方程式如下:n CH 2===CH 2――→催化剂 CH 2—CH 2。
(1)像这种由含有不饱和键的化合物分子以加成反应形式结合成高分子化合物的反应叫加成聚合反应,简称加聚反应。
(2)能够进行聚合反应形成高分子化合物的低分子化合物称为单体;高分子化合物中化学组成相同、可重复的最小单位称为链节;含有链节的数目称为聚合度,通常用n 表示。
(3)聚合物的平均相对分子质量等于链节的相对质量×n 。
【练一练】 写出丙烯发生加聚反应的化学方程式,并注明高聚物的单体、链节、聚合度:――→催化剂。
2.常见的加聚反应写出下列物质发生加聚反应的化学方程式: (1)丙烯酸: n CH 2===CH —COOH ――→催化剂。
(2)1,3-丁二烯:n CH 2===CH —CH===CH 2――→催化剂CH 2—CH===CH —CH 2。
(3)乙烯、丙烯(1∶1)共聚:n CH 2===CH 2+n CH 2===CH —CH 3――→催化剂 (或。
(4)丙烯与1,3-丁二烯(1∶1)共聚:n CH 2==CH —CH 3+n CH 2==CH —CH==CH 2――→催化剂(或。
1.加聚反应的特点(1)单体必须是含有双键、三键等不饱和键的化合物。
例如,烯、二烯、炔、醛等含不饱和键的有机物。
(2)发生加聚反应的过程中没有副产物(小分子化合物)产生,只生成高聚物。
(3)聚合物链节的化学组成跟单体的化学组成相同,聚合物的相对分子质量为单体相对分子质量的整数倍。
2.由单体推断加聚物(高分子化合物)的方法将单体的不饱和键的碳链单独列一行,再把不饱和键按正确的方式打开,找到正确的链节,即可写出其化学式。
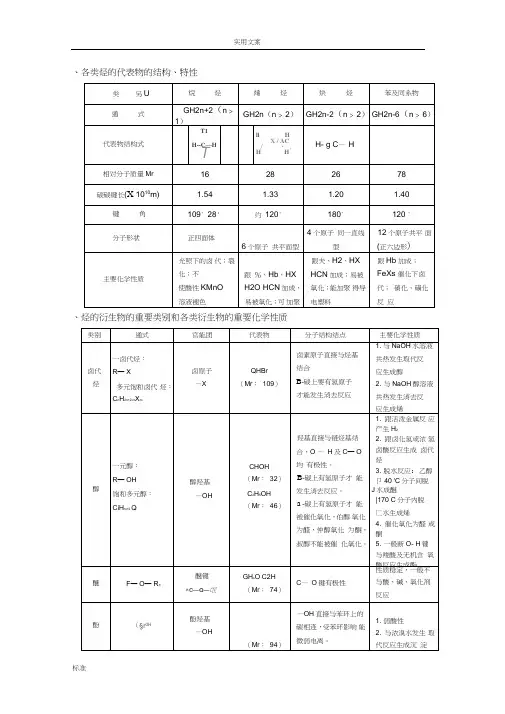
、各类烃的代表物的结构、特性、烃的衍生物的重要类别和各类衍生物的重要化学性质三、有机物的鉴别鉴别有机物,必须熟悉有机物的性质(物理性质、化学性质),要抓住某些有机物的特征反应,选用合适的试剂,一一鉴别它们。
1常用的试剂及某些可鉴别物质种类和实验现象归纳如下:2 •卤代烃中卤素的检验取样,滴入NaOH溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 溶液,观察沉淀的颜色,确定是何种卤素。
3 •烯醛中碳碳双键的检验(1)若是纯净的液态样品,则可向所取试样中加入溴的四氯化碳溶液,若褪色,则证明含有碳碳双键。
(2)若样品为水溶液,则先向样品中加入足量的新制C U(OH)2悬浊液,加热煮沸,充分反应后冷却过滤,向滤液中加入稀硝酸酸化,再加入溴水,若褪色,则证明含有碳碳双键。
★若直接向样品水溶液中滴加溴水,则会有反应:一CHO + Br2 + H20 T —COOH +2HBr 而使溴水褪色。
4. 二糖或多糖水解产物的检验若二糖或多糖是在稀硫酸作用下水解的,则先向冷却后的水解液中加入足量的NaOH 溶液,中和稀硫酸,然后再加入银氨溶液或新制的氢氧化铜悬浊液,(水浴)加热,观察现象,作出判断。
5. 如何检验溶解在苯中的苯酚?取样,向试样中加入NaOH溶液,振荡后静置、分液,向水溶液中加入盐酸酸化,再滴入几滴FeCb溶液(或过量饱和溴水),若溶液呈紫色(或有白色沉淀生成),则说明有苯酚。
★若向样品中直接滴入FeCb溶液,则由于苯酚仍溶解在苯中,不得进入水溶液中与卩63+进行离子反应;若向样品中直接加入饱和溴水,则生成的三溴苯酚会溶解在苯中而看不到白色沉淀。
★若所用溴水太稀,则一方面可能由于生成溶解度相对较大的一溴苯酚或二溴苯酚,另一方面可能生成的三溴苯酚溶解在过量的苯酚之中而看不到沉淀。
6. 如何检验实验室制得的乙烯气体中含有CH2= CH、SO、CO、HO?将气体依次通过无水硫酸铜、品红溶液、饱和Fe2(SO4)3溶液、品红溶液、澄清石灰水、(检验水)(检验SQ)(除去SO)(确认SQ已除尽)(检验CO)溴水或溴的四氯化碳溶液或酸性高锰酸钾溶液(检验CH2= CH)。
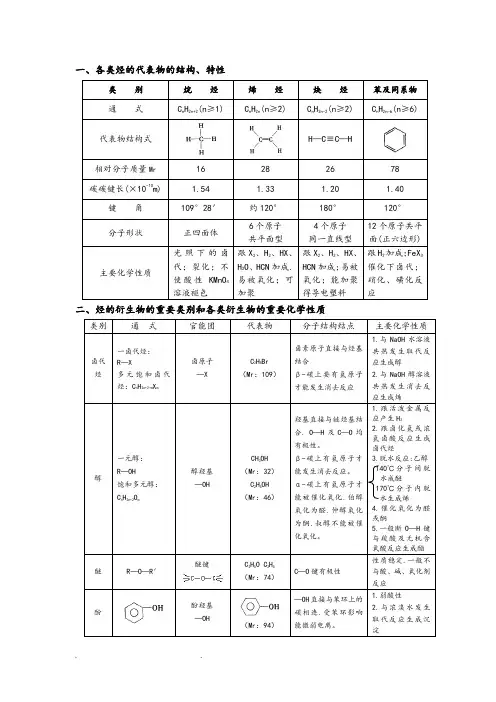
一、各类烃的代表物的结构、特性类别烷烃烯烃炔烃苯及同系物通式C n H2n+2(n≥1) C n H2n(n≥2) C n H2n-2(n≥2) C n H2n-6(n≥6) 代表物结构式H—C≡C—H相对分子质量Mr16 28 26 78 碳碳键长(×10-10m) 1.54 1.33 1.20 1.40 键角109°28′约120°180°120°分子形状正四面体6个原子共平面型4个原子同一直线型12个原子共平面(正六边形)主要化学性质光照下的卤代;裂化;不使酸性KMnO4溶液褪色跟X2、H2、HX、H2O、HCN加成.易被氧化;可加聚跟X2、H2、HX、HCN加成;易被氧化;能加聚得导电塑料跟H2加成;FeX3催化下卤代;硝化、磺化反应二、烃的衍生物的重要类别和各类衍生物的重要化学性质类别通式官能团代表物分子结构结点主要化学性质卤代烃一卤代烃:R—X多元饱和卤代烃:C n H2n+2-m X m卤原子—XC2H5Br(Mr:109)卤素原子直接与烃基结合β-碳上要有氢原子才能发生消去反应1.与NaOH水溶液共热发生取代反应生成醇2.与NaOH醇溶液共热发生消去反应生成烯醇一元醇:R—OH饱和多元醇:C n H2n+2O m醇羟基—OHCH3OH(Mr:32)C2H5OH(Mr:46)羟基直接与链烃基结合. O—H及C—O均有极性。
β-碳上有氢原子才能发生消去反应。
α-碳上有氢原子才能被催化氧化.伯醇氧化为醛.仲醇氧化为酮.叔醇不能被催化氧化。
1.跟活泼金属反应产生H22.跟卤化氢或浓氢卤酸反应生成卤代烃3.脱水反应:乙醇140℃分子间脱水成醚170℃分子内脱水生成烯4.催化氧化为醛或酮5.一般断O—H键与羧酸及无机含氧酸反应生成酯醚R—O—R′醚键C2H5O C2H5(Mr:74)C—O键有极性性质稳定.一般不与酸、碱、氧化剂反应酚酚羟基—OH(Mr:94)—OH直接与苯环上的碳相连.受苯环影响能微弱电离。

新人教版高中化学选修5《有机化学基础》知识点归纳一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、氟代烃、酯(包括乙酸乙酯、油脂等)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]为气态② 衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃),氟里昂(CCl2F2,沸点为-29.8℃)氯乙烯(CH2==CHCl,沸点为-13.9℃),甲醛(HCHO,沸点为-21℃)氯乙烷(CH3CH2Cl,沸点为12.3℃),一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃),甲醚(CH3OCH3,沸点为-23℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3环己烷甲醇CH3OH 甲酸HCOOH溴乙烷C2H5Br 乙醛CH3CHO溴苯C6H5Br 硝基苯C6H5NO2★特殊:植物油等在常温下为液态。
(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡、C16以上的烃、动物油脂★特殊:苯酚(C6H5OH)、苯甲酸(C6H5COOH)、氨基酸等在常温下为固态4.有机物的颜色绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下:☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体;☆部分被空气中氧气所氧化变质的苯酚为粉红色;☆2,4,6—三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂);☆苯酚溶液与Fe3+(aq)作用形成紫色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会变黄色。





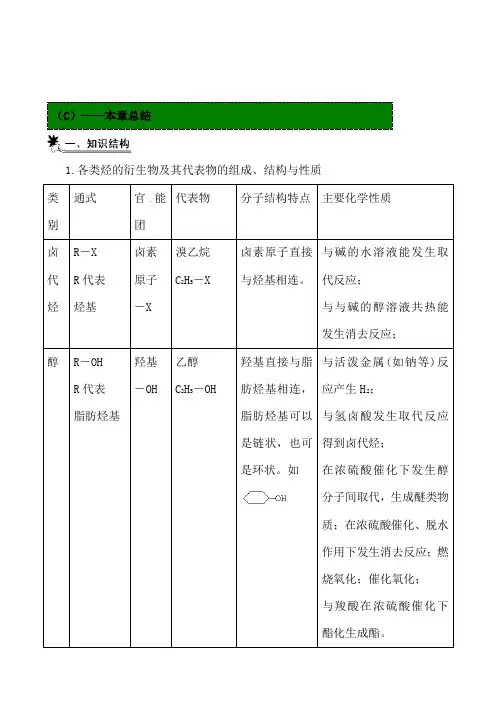
(C)——本章总结1.各类烃的衍生物及其代表物的组成、结构与性质H在浓硫酸催化下发生醇与甲醛发生缩聚有极性,有极性,2.有机物之间的相互转化关系(卤代烃、醇、醛、羧酸、酯的相互转化关系)3.醇、醛、酸、酯转化关系的延伸4.烃的羟基衍生物比较5.烃的羰基衍生物比较6.有机反应主要类型归纳、加氢反应、专题一 有机物的类别与通式有机化合物种类多,要以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油酯、多羟基醛酮、氨基酸等)为例,了解官能团在化合物中的作用。
掌握各主要官能团的性质和主要化学反应,并能结合同系物原理加以应用。
例 1 二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。
二甘醇的结构简式是HO —CH 2CH 2—O —CH 2CH 2—OH 。
下列有关二甘醇的叙述正确的是A.不能发生消去反应B.能发生取代反应C.能溶于水,不溶于乙醇D.符合通式C n H 2n O 3解析:与-OH 相连的碳的邻位碳原子上有氢,所以能发生消去反应,能与羧酸发生酯化反应,是取代反应,所以B 正确。
根据相似相溶原理二甘醇含羟基(-OH ),所以它既能溶于H 2O ,也能溶于乙醇。
它的分子式为C 4H 10O 3。
二甘醇的通式应是C n H 2n+2O 3,不符合D 项中的通式。
答案:B 。
点拨:有机反应的复杂性和有机物种类的多样性,导致了有机反应类型的多样性,各类反应皆有自己的特征,这也与官能团的特征是分不开的。
例2 A 、B 、C 、D 、E 五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。
它们的结构简式如下所示:3 3 CH 2CH=CH 2 CH 2CH=CH 2 CH 2CH=CH 2 CH 2CH=CH 2A B C D E请回答下列问题:⑴这五种化合物中,互为同分异构体的是_______________。
⑵W 氧化反应①−→−−反应②−→−−X反应①采取了适当措施,使分子中烯键不起反应。

选修五部分第一章认识有机化合物第一节有机化合物的分类一、有机物和无机物的区分有机物的含义1、旧义:含碳元素的化合物碳的氧化物、碳酸以及碳酸盐金属碳化物、氰化物除外2、新义:以碳原子为主要骨架的化合物二、有机物的分类1、按碳原子骨架区分1)链状化合物:分子中碳原子连接成链例如:丁烷CH3-CH2-CH2-CH3、乙醇CH3-CH2-OH、乙酸CH3-COOH等2)环状化合物:分子中碳原子连接成环a 、脂环化合物:如环己烷、环戊烷,分子中不含有苯环b、芳香化合物:如苯、苯甲酸分子中只含有一个苯环2、按官能团分类1)官能团:决定化合物特殊性质的原子或原子团2)烃:只含有碳、氢元素的有机化合物,如:烷烃、烯烃、炔烃、芳香烃3)烃的衍生物:烃分子里的氢原子被其他原子或原子团所取代而形成的一系列新的化合物a、卤代烃:烃分子中的氢原子被卤族原子取代而形成的化合物b、烃的含氧衍生物:烃分子中的氢原子被含氧原子的官能团所取代而形成的化合物4)常见的官能团*碳碳双键羟基—OH 酯基碳碳三键醛基醚键卤族原子—Cl 羧基羰基15)官能团和根(离子)、基的区别*a、基与官能团基:有机物分子里含有的原子或原子团。
官能团:决定化合物特殊性质的原子或原子团。
两者的关系:“官能团”属于“基”, 但“基”不一定是“官能团”。
b、基与根类别基根实例羟基氢氧根区别电子式电性电中性带一个单位负电荷存在有机化合物无机化合物电子数9 10 623第二节 有机化合物的结构特点一、有机化合物中碳原子的成键特点1、碳原子有4个价电子,能与其他原子形成4个共价键,碳碳之间的结合方式有单键、双键或三键;多个碳原子之间可以相互形成长短不一的碳链和碳环,碳链和碳环也可以相互结合,所以有机物结构复杂,数量庞大。
2、单键——甲烷的分子结构CH 4分子中1个碳原子与4个氢原子形成4个共价键,构成以碳原子为中心、4个氢原子位于四个顶点的正四面体结构甲烷的电子式 甲烷的结构式 甲烷分子结构示意图在甲烷分子中,4个碳氢键是等同的,碳原子的4个价键之间的夹角(键角)彼此相等,都是109°28′。
有机化合物的结构与性质___________________________________________________________________________ __________________________________________________________________________________ _______1.了解测定有机化合物组成和结构的一般方法。
2.知道有机化合物中碳的成键特征, 了解有机化合物中的常见官能团, 能正确表示简单有机化合物的结构。
3.认识手性碳原子, 了解有机化合物存在异构现象(不包括立体异构体), 能判断并正确书写简单有机化合物的同分异构体的结构简式。
4.了解烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和性质, 认识不同类型化合物之间的转化关系。
一、有机物的结构和性质特点1. 各类烃的代表物的结构、特性烷烃烯烃炔烃苯及同系物代表物结构式H—C≡C—H键角分子形状主要化学性质2. 烃的衍生物的重要类别和各类衍生物的重要化学性质类别通式官能团代表物分子结构结点主要化学性质卤代烃R—X —X C2H5Br卤素原子直接与烃基结合醇R—OH —OH C2H5OH羟基直接与链烃基结合酚—OH —OH直接与苯环上的碳相连醛有极性和不饱和性羧酸受羧基影响, O—H能电离出H+酯分子中RCO—和—OR′之间的C—O键易断裂二、有机物的组成和结构的测定与表示方法1. 有机物的组成和结构的测定: 李比希法核磁共振氢谱质谱红外光谱等2. 有机物组成和结构的表示方法分子式最简式结构式结构简式键线式三、同分异构体的书写及数目判断(一)有机化合物中碳原子的成键特点(以甲烷为例)电子式结构式正四面体结构示意图球棍模型比例模型(二)同分异构体的书写规律1. 烷烃: 烷烃只有碳链异构, 书写时要注意写全而不要写重复, 一般可按下列规则书写: 成直链, 一条线;摘一碳, 挂中间;往边移, 不到端;摘两碳, 成乙基;二甲基, 同邻间;不重复, 要写全。
高中化学选修5有机化学讲义 烷烃 烷烃中最简单的烃——甲烷 一、甲烷的结构 分子式_________ 结构式__________ 结构简式________ 实验式________ 空间构型___________ 电子式___________ 【例题】下列事实中能证明甲烷分子是正四面体结构,而不是平面正方形的是 A.CH3Cl只代表一种物质 B.CH2Cl2只代表一种物质
C.CHCl3只代表一种物质 D.CCl4只代表一种物质
二、甲烷的物理性质 __________________________________________________________________
三、甲烷的化学性质 ______________________________________________________________ 1.氧化反应 2.取代反应(教材科学探究的实验现象) 现象(1)________________________________________ (2)________________________________________ (3)________________________________________ (4)________________________________________ 在光照条件下,甲烷和氯气发生的化学反应方程式为 (1)________________________________________ (2)________________________________________ (3)________________________________________ (4)________________________________________ 取代反应的定义:__________________________________________
【例题】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,下列说法正确的是
A.此反应属于加成反应 B.此反应无光照也可发生 C.试管内壁出现油状液滴 D.此反应得到的产物是纯净物
【变式】某课外兴趣小组利用如下图所示的装置探究甲烷与氯气的反应。根据题意,回答下列问题: (1)反应前量筒内CH4与Cl2的体积比为_______,向100mL量筒中收集充入CH4、Cl2的
方法是________________________。 (2)CH4与Cl2发生反应的条件是_____________;若用日光直射,可能会引起___________ 。
(3)实验中可观察到的现象有:量筒内壁上出现黄绿色油状液滴,饱和食盐水中有少量固体析出、____________、____________等。 (4)实验中生成的油状液滴的化学式为 ,其中______________是工业上重要的有机溶剂。 (5)饱和食盐水中有少量固体析出,其原因是_________________________。 (6)用饱和食盐水而不用水的原因是_________________________________。
【练习】2 mol CH4与Cl2光照下发生充分反应,生成相同物质的量的4种取代物,则消耗
的Cl2的物质的量为__________
一、烷烃的基本概念 ①烷烃的定义: ①烷烃的通式:
【例题1】下列数值都是烃的相对分子质量值,其对应的烃一定为烷烃的是 A.44 B.42 C.54 D.128
【例题2】已知下列两个结构简式:CH3-CH3和-CH3,两式均有短线“-”,这两条短线所
表示的意义是 A.都表示一对共用电子对 B.都表示一个共价单键 C.前者表示一对共用电子对,后者表示一个未成对电子 D.前者表示分子内只有一个共价单键,后者表示该基团内无共价单键
二、烷烃的性质 1.物理性质 (1)熔沸点有规律递变: a.随C原子数增多,熔沸点___________ b.C原子数目相同时,支链越多,熔沸点___________ (2)一般来说,烷烃的密度随C原子数目增多而________,但密度均比水_______ (3)烷烃均不溶于水,液态烷烃和水混合会分层,且均在________ (4)分子里碳原子数等于或小于4的烷烃在常温常压下都是气体,其他烷烃在常温常压下都是液态或固体。注:新戊烷常温常压为气体 2.化学性质 (1)稳定性____________________________________ (2)可燃性(氧化反应) (3)取代反应 反应条件:__________________ 【插曲】烃的定义:______________________________________________
一、烷烃的命名 1.习惯命名法 分子里所有含C原子的数后面加一个“烷”字,就是简单的烷烃的名称: ①C原子数在十以下的,从一至十依次用“甲、乙、丙、丁、戊、己、庚、辛、壬、癸”来表示 ①C原子在十以上,就用数字表示,如十一烷 ①当C原子数目相同,在某烷前加“正”“异”“新”,但仅适用简单烷烃的命名 a.直链烷烃叫正某烷,如CH3CH2CH2CH2CH3正戊烷 b.把在碳链的一末端在有两个甲基的特点结构的烷烃称为异某烷,如戊烷 c.含有季碳原子称为新某烷,如新戊烷
【插曲】与一个碳原子相连的碳原子叫伯碳原子,如CH3CH3中的碳都是伯碳原子;与两个碳原子相连的碳叫仲碳原子,如CH3CH2CH3中中间碳原子为仲碳原子;与三个碳相连的碳原子叫叔碳原子,如CH3CH(CH3)2分子中的中间碳原子为叔碳原子;与四个碳相连的碳原子叫季碳原子如(CH3)2C(CH3)2中间碳原子为季碳原子。
2.系统命名法 ①选主链,称某烷,编碳位,定支链 ①取代基,写在前,注位置,短线连 ①相同基,合并算,不同基,简在前 ——必须满足支链和最小,数字与数字“逗号”连,数字与汉字“短线”连 【演练】(CH3)2CHCH2CH2CH3 (CH3)2CHCH2CH(CH3)2 (CH2CH3)2CHCH2CH(CH3)2
_______________________、_______________________、_______________________
【例题1】现有一种烃可表示为
命名该化合物时,应认定它的主链上的碳原子数目是 A.9 B.10 C.11 D.12
【变式1】有机物的主链上有几个碳原子________,并命名________________________ 【例题2】有机物 的名称是___________________ 【变式2】有机物的正确命名为___________________ 【巩固加深】 1.下列有机物的名称正确的是 A.2,2-甲基戊烷 B.4,5-二甲基-3-乙基己烷 C.2,3-二甲基-4-乙基己烷 D.2,3,3-三甲基丁烷
2.某同学写了8种烷烃的名称: ①3-甲基丁烷 ②2-乙基戊烷 ③2,2-二甲基-2-乙基丙烷 ④2-甲基丁烷 ⑤2,3,3-三甲基丁烷 ⑥2,2,3,3-四甲基戊烷 ⑦3,3-二甲基-4-乙基己烷 ⑧4,5-二甲基-6,8-二乙基壬烷 (1)其中命名正确的是___________ (2)其中命名错误,但有机物存在的是______________ (3)其中命名错误且有机物不存在的是______________
3.对下列烷烃进行系统命名:
(1) ________________ (2) ___________________________
(3) ________________ (4) _____________________
(5)________________________ 二、烷烃的同分异构体 同分异构体定义:
书写方法: 等效氢的判断:
【例题】写出下列烷烃的同分异构体 C4H10
C5H12 C6H14
C7H16
【变式1】分子式为C4H9Cl的同分异构体有_______种
【变式2】下列烷烃进行一氯取代反应后,只能生成三种沸点不同的产物的是 A.CH3CH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CH CH2CH(CH3)2 D.(CH3)3C(CH2)2CH3
【检测】下列有机物命名及一氯代物的数目正确的是 命名 一氯代物的数目 A 2-甲基-2-乙基丙烷 4 B 2-甲基丁烷 3 C 2,2,3-三甲基戊烷 6 D 2,3-二甲基-4-乙基己烷 7
1.分子式为C7H16的烷烃的各同分异构体中,含有三个甲基的同分异构体的数目为____种 2.C6H14的各种同分异构体中,若使其一氯代物数目最少,则结构中所含的甲基数为______ 3.主链含5个碳原子,有甲基、乙基2个支链的烷烃有_______种 三、同系物 同系物定义: