九年级化学化合价
- 格式:pptx
- 大小:1.47 MB
- 文档页数:11


初三化学常用化合价《初三化学常用化合价》同学们,今天咱们来好好唠唠化学式,这化学式啊,和化合价可是关系紧密呢。
首先,咱得知道化合价是个啥。
化合价就像是原子在化学世界里的一种“价值标签”,每个原子都有自己常见的化合价。
比如说氢,它的化合价通常是 +1价,氧呢,一般是 -2价。
这化合价就像是原子在组建分子这个“小家庭”时带的一种“经济实力”,有正有负。
那这化合价和化学式有啥关系呢?咱们就像搭积木一样来构建化学式。
比如说水,化学式是H₂O。
这里面氢是 +1价,氧是 -2价,为了让这个“小家庭”整体的“经济收支”平衡,就得有两个氢原子(2×( +1) =+2)和一个氧原子(1×( -2) = -2)结合,这样整体就不带电了,就像咱们过日子,收入和支出得平衡。
那原子们是怎么结合到一起形成分子的呢?这就涉及到化学键啦。
化学键就像是原子之间的小钩子。
比如说离子键,就像带正电和带负电的原子像超强磁铁般吸在一起。
就好比男生(带正电的原子)和女生(带负电的原子)互相吸引,紧紧地靠在一起,像氯化钠(NaCl),钠原子(Na)失去一个电子带正电,氯原子(Cl)得到一个电子带负电,它们就靠这种离子键结合在一起啦。
还有共价键呢,这就像是原子们共用小钩子连接。
就像两个小伙伴一起拉着一个东西,谁也不放手。
比如说氧气(O₂),两个氧原子就是通过共用小钩子(共价键)结合在一起的。
再来说说分子的极性。
这分子的极性就类似小磁针。
像水是极性分子,氧一端就像磁针南极带负电,氢一端就像北极带正电。
你可以想象水是一个有方向的小磁针,它的正负极分布不均匀。
而二氧化碳(CO₂)呢,是直线对称的,就像一个两边完全一样的哑铃,它就是非极性分子,不存在这种一端正电一端负电的情况。
在化学里还有个很有趣的东西叫配位化合物。
这里面中心离子就像是聚会的主角,周围的配体呢,就像是提供孤对电子共享的小伙伴。
比如说在[Cu(NH₃)₄]²⁺这个配位化合物里,铜离子(Cu²⁺)就是主角,氨分子(NH₃)就是小伙伴,氨分子把自己的孤对电子拿出来和铜离子共享,就像小伙伴们围绕着主角一起玩耍。

初三化学化合价详细讲解化学中的化合价是指元素在化合物中的相对组合能力或原子价。
化合价的大小是表示各种元素在化合物中的组合能力与其他元素组合能力之间的比率关系。
一、元素的化合价元素的化合价即指单质元素化合时在化合物中原子或离子的电荷数量。
格式为化合价=主族型元素电价-非金属型元素电价。
非金属元素的电价一般为固定数值,主族元素的电价多数为同一值。
化合价的值为表示离子价或共价时的最小整数。
例如:氢:化合价为+1;氧:化合价为-2氯:化合价为-1二、离子化合价离子化合价指的是化合物中离子的价。
离子化合价与离子半径成反比,即离子越小,其价数越大。
例如:NaCl:由Na+和Cl-两种离子组成,化合价为+1和-1三、共价化合价共价化合价是指元素形成共价键时所赋予的电荷数量。
共价键的电子数是两个原子中价电子数之和。
共价键成键数目等于原子的剩余电子数。
例如:二氧化碳:CO2碳:电子式:1s2 2s2 2p2,原子序数为6,属于主族14,共价价电子数为4,共价化合价为+4。
氧:电子式:1s2 2s2 2p4,原子序数为8,属于主族16,共价价电子数为6,共价化合价为-2。
四、复式化合价复式化合价指的是含有两种或两种以上元素的化合物中各元素的化合价。
例如:2H2O:氢的化合价为+1,氧的化合价为-2,因此水的化合价为+2×1+2×(-2)=-4五、注意事项1.化合价是指元素形成化合物时系统化合物原子数的相对组合能力。
2.化合价的大小决定了元素有可能与其他元素结合形成的化合物类型。
3.元素化合价一般时定值,但也有一定的例外。
4.中心原子,即核心原子是指在离子、共价化合物中与配位原子构成的八面体、四面体或其他几何结构的核心原子。
中心原子的化合价不一定等于其元素原子的电价,而是受到身边配位原子电性影响。
5.离子化合价受离子半径大小的影响,离子半径越小,离子价越大。
6.复式化合价指含有两种或两种以上元素的化合物中各元素的化合价。

【化学知识点】化合价口诀初中顺口溜谐音背诵化合价是一种元素的一个原子与其他元素的原子构成的化学键的数量。
本文整理了化合价口诀,欢迎阅读。
一价钾钠氟氢银,二价氧钙钡镁锌,三铝四硅五价磷;二三铁,二四碳。
二四六硫都齐全,铜汞二价最常见。
一价氟氯溴碘氢;还有金属钾钠银二价氧钡钙镁锌;铝三硅四都固定氯氮变价要注意;一二铜汞一三金二四碳铅二三铁;二四六硫三五磷氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
(1)钾钠银氢正一价,钙镁钡锌正二价;(2)氟氯溴碘负一价,通常氧是负二价;(3)铜正一二铝正三,铁正二三硅正四;(4)碳有正二和正四,硫有负二正四六;(5)负三正五氮和磷,锰为正二四六七。
(1)钾钠银氢正一价,钙镁钡锌正二价,一二铜,二三铁(2)铝是正三氧负二,氯是负一最常见,硫有负二正四六,正二正三铁可变(3)正四硅,二四碳,单质零价永不变,负一硝酸氢氧根,负二硫酸碳酸根(4)负三记住磷酸根,正一价的是铵根,其他元素有变价,先死后活来计算(5)一价氯氢钾钠银,二价氧钡钙镁锌。
三铝四硅五价磷,二四碳,三五氮(6)二四六硫铁二三,铜汞一二是变价,单质是零不用算(7)正一钾钠银氢氨,正二钙铜镁钡锌,铝三硅四磷正五,氯常负一氧负二(8)铁变二三碳二四,氢氧硝酸根负一,碳酸硫酸根负二,二四六硫均齐全(9)正一氢锂钾钠银,正二钙镁钡锌汞。
正三铝,负二氧(10)氟氯溴碘负一价,可变价(11)正一亚铜,正二铜,正二亚铁,正三铁(12)负一氢氧硝酸根,负二硫酸碳酸根,正一价的是铵根,一价氢氯钠钾银(13)二价氧镁钙钡锌,三价元素铀鎶铝,四价碳酸,五价磷感谢您的阅读,祝您生活愉快。

初中化学化合价知识归纳总结
化合价是指元素在化合物中的价态表现,用来表示元素的电性差异。
化合价的确定有以下几个原则:
1. 单质的化合价通常为零。
例如氢气(H2)中,每个氢原子的化合价为0。
2. 单原子离子的化合价等于其电荷数。
例如,氧气离子(O2-)的化合价
为-2。
3. 羧基(-COOH)的化合价为-1。
羧酸是指含有羧基的有机化合物,
例如乙酸(C2H4O2)中,碳原子和氧原子的化合价分别为0和-2,氢原
子的化合价为+1,因此羧酸中羧基的化合价为-1。
4. 阴离子中,更电负的元素的化合价为其一般价。
例如,在氯化物(Cl-)中,氯原子的化合价为-1。
5. 阳离子中,非金属元素的化合价通常是其一般价。
例如,在氯化钠(NaCl)中,钠原子的化合价为+1。
需要注意的是,在很多化合物中,元素的化合价可以有多个可能的值。
这时,根据实验数据和化学原理确定元素的化合价。
此外,还有一些特殊情况需要注意:
1. 铁(Fe)原子的化合价可以是+2或+3。
在FeCl2中,铁原子的化合价
为+2;在FeCl3中,铁原子的化合价为+3。
2. 氧(O)原子通常的化合价是-2,但在过氧化物中其化合价为-1。
3. 氢(H)原子的化合价可以是+1或-1,具体取决于化合物的性质。
以上是初中化学化合价的知识归纳总结。
通过掌握化合价的确定原则
和特殊情况,可以更好地理解和掌握化学反应和化合物的性质。

中考化学快速记忆化合价以下是一些记忆化合价的方法:
1.口诀记忆法:可以将化合价编成口诀或歌曲,例如“一价钾钠氢氯银,二价氧钙钡
镁锌,三铝四硅五价磷,二三铁、二四碳,一至五价都有氮,铜汞二价最常见”
等,通过反复背诵来记忆。
2.逻辑记忆法:根据元素的性质、位置、电子排布等逻辑关系来记忆化合价。
例如,
金属元素通常显正价,非金属元素通常显负价,氧元素通常显-2价,氢元素通常显+1价等。
3.关联记忆法:将化合价与常见的物质、反应等关联起来,形成记忆链。
例如,硫酸
铜的化学式为CuSO4,其中铜元素显+2价,硫酸根显-2价,根据化合物中正负化合价代数和为零的原则,可以很快记住铜元素的化合价。
4.图表记忆法:将化合价制成图表或表格,按照一定规律排列,方便查看和记忆。
例
如,可以按照元素周期表的顺序排列,将同一族的元素放在同一列,方便比较和记忆。

九年级化学化合价价知识点化学是一门研究物质的性质、组成、结构、转化以及反应规律的科学。
在九年级的化学学习中,一个重要的知识点就是化合价。
化合价是化学元素在化合物中的价值表示。
它是我们理解化学反应、预测生成物以及计算反应物质的量的基础。
化合价的概念最早由法国化学家勒鲁瓦提出,用于表示元素的结合能力。
在化合物中,元素主要通过与其他元素共享或转移电子来与其他元素产生结合。
化合价通过帮助我们了解化合物中元素如何进行化学反应,以及元素与元素之间的相互作用。
化合价的表示方法有两种:原子价和化合价。
原子价是指元素中一个原子在单质状态下的氧化态(正或负)数值。
原子价是参照元素在单质状态下与氧元素结合的原子序数来确定的。
而化合价则是指一个元素在与其他元素形成化合物时所具有的价值。
化合价可以是正的、负的或零。
正的化合价表示一个元素在化合物中失去了电子,负的化合价表示一个元素在化合物中获得了电子,而零的化合价表示一个元素在化合物中既没有失去电子也没有获得电子。
化合价有助于我们预测元素与元素之间的反应性。
根据化合价,我们可以预测元素是否会形成离子或共价键。
元素具有相同化合价的趋势,会在反应中更容易相互结合。
通过了解化合价,我们可以预测元素之间的化学反应以及产生的化合物是离子型还是共价型。
除了预测化学反应的能力外,了解化合价还有助于我们计算反应物质的量。
化合价告诉我们在化合物中元素的相对含量,因此我们可以根据化合价来研究反应中物质的量的变化。
这对于斯托伯黎量、计算反应热以及预测反应出现的副反应等方面都很重要。
然而,要理解化合价并不总是一件容易的事情。
化合价的确定是受到其他因素的影响的,如电负性、原子半径、电子云分布以及电子云的共振等。
不同元素在不同化合物中的化合价可能是不同的,即使它们具有相似的原子价。
因此,需要通过不断学习和实践来理解和应用化合价。
化合价的概念是九年级化学学习的基础,也是后续学习的基石。
深入理解化合价的原理和应用,能够帮助我们更好地解释化学反应和物质的性质。

九年级化学教案化合价9篇化合价 1课题 4 化学式与化合价(总第二十五课时)一课标要求4 知识与技能:了解化学式的涵义,知道一些常见元素和根的化合价,能利用化合价推求化学式,依据化学式表示某些物质组成。
5 过程与方法:应多采用组织讨论、指导阅读、讲练结合等方式进行教学,并使学生逐渐学会根据化学概念应用教学工具来解决化学问题。
6 情感态度与价值观:通过化学式的引入,对学生进行实事求是的科学态度的教育。
二课堂程序2 复习⑴判断下列原子结构示意图是哪种原子的结构示意图。
⑵写出上述元素两两结合,可能形成的化合物的化学式其原子个数比为。
3 新课(一)化合价定义:理解:原子团(根)定义:⑴化合价表示方法 +1 +2 -2 -2例:在化合物中:na、 ca、 s、 so4想一想:化合价与离子的表示方法有何异同?小结区别:联系:+1 +2 -2 -1思考:为什么na而非na,s而非s 呢?⑵化合价的确定及其规律阅读教材p81页后填写a、化合物中:氧为价,氢为价,金属元素一般显价,非金属元素一般显价。
b、两个零⑶化合价及根的化合价的记忆,记忆p80表4-6。
[活动与探究]a、以小组为单位进行化合价记忆比赛,看谁记得多,记得准。
b、试着编写能帮助记忆化合价韵语、歌谣或快板。
化合价记忆歌诀:(二)化合价的计算与应用⑴根据化合价原则书写化学式,看p81页例题例:书写硫酸铝的化学式+3 -2a 正价前,负价后:al so4 +3 -2b 交叉约简定个数:al2(so4)3+3 -2c 写右下,验正误:al2(so4)3 (+3)×2+(-2)×3=0小结写法:练习书写化学式:cloohso4no3co3mg-3+1 -4+1特例:nh3、 ch4⑵根据化学式(或原子团的化合价)推断元素的化合价。
a、讨论:p82:根据化合物中各元素正负化合价的代数和为0的原则,已知氧为-2价,计算二氧化硫里硫的化合价。
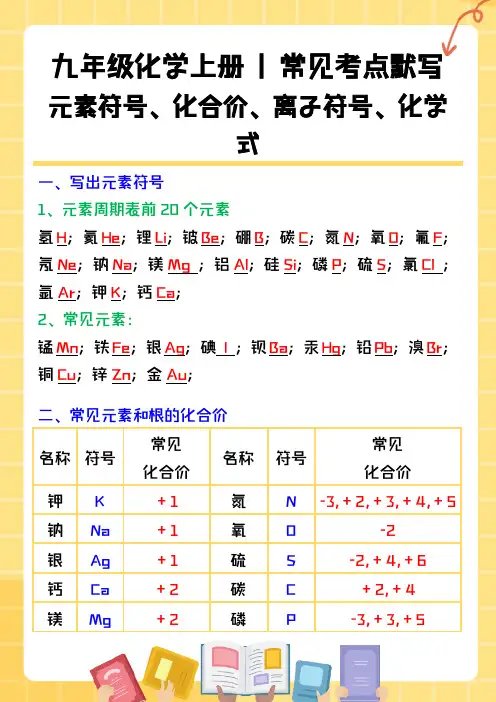
九年级化学上册 | 常见考点默写元素符号、化合价、离子符号、化学式一、写出元素符号1、元素周期表前20个元素氢H;氦He;锂Li;铍Be;硼B;碳C;氮N;氧O;氟F;氖Ne;钠Na;镁Mg;铝Al;硅Si;磷P;硫S;氯Cl;氩Ar;钾K;钙Ca;2、常见元素:锰Mn;铁Fe;银Ag;碘 I ;钡Ba;汞Hg;铅Pb;溴Br;铜Cu;锌Zn;金Au;二、常见元素和根的化合价名称符号常见化合价名称符号常见化合价钾K+1氮N-3,+2,+3,+4,+5 钠Na+1氧O-2银Ag+1硫S-2,+4,+6钙Ca+2碳C+2,+4镁Mg+2磷P-3,+3,+5铜Cu+1,+2锌Zn+2锰Mn +2,+4,+6,+7硅Si+4铝Al+3氢氧根OH--1 氢H+1硫酸根SO42--2氯Cl -1,+1,+5,+7碳酸根CO32--2铁Fe+2,+3铵根NH4++1氟F-1硝酸根NO3--1三、写出下列离子的符号氢离子H-;氧离子O2-;氟离子F-;钠离子Na+;镁离子Mg2+;铝离子Al3+;硫离子S2-;氯离子Cl-;钾离子K+;钙离子Ca2+;铁离子Fe3+;铜离子Cu2+;亚铁离子Fe2+;氢氧根离子OH-;硫酸根离子SO42-;硝酸根离子NO3-;碳酸根离子CO32-;铵根离子NH4+;碳酸氢根离子HCO3-;四、写出下列物质的化学式1、单质三原子:臭氧O3;双原子:氧气O2;氯气Cl2;氢气H2;碘I2;溴Br2;单原子:稀有气体:氦气He;氩气Ar;氖气Ne;金属:铜Cu;银Ag;水银Hg;锌Zn;铁Fe;其他:磷P;金刚石C;硫S;碳C;石墨C;2、化合物氧化物:氧化铝Al2O3;水H2O;干冰CO2;氧化铜CuO;三氧化硫SO3;过氧化氢H2O2;二氧化硫SO2;氧化钾K2O;氧化钙CaO;一氧化碳CO;二氧化锰MnO2;四氧化三铁Fe3O4;五氧化二磷P2O5;氯化物:氯化钠NaCl;氯化铜CuCl2;氯化银AgCl;氯化氢HCl ;氯化镁MgCl2;氯化铁FeCl3;硫化物:硫化氢H2S;硫化钠Na2S;硫化锌ZnS;其他:氯酸钾KClO3;硫酸钾K2SO4;碳酸钙CaCO3;锰酸钾K2MnO4;高锰酸钾KMnO4;硫酸H2SO4;氢氧化钙Ca(OH)2;氢氧化钾KOH;氢氧化铝Al(OH)3;碳酸钠Na2CO3;碳酸铵(NH4)2CO3;。

初中化学常见元素及其化合价在化学中,元素是构成物质的最基本单位。
元素的化学性质主要由其原子的化合价决定。
化合价是指元素原子在形成化合物时,与其他元素原子结合时所表现出的原子的变化价电态。
常见元素及其化合价如下:1.氢(H):氢原子的化合价为+1,因为其原子只有一个电子,它能够失去电子与其他元素原子形成化合物。
例如,氢气(H2)中的两个氢原子共享一个电子形成氢分子。
2.氧(O):氧原子的化合价为-2,因为其原子有6个电子,它能够接受2个电子与其他元素原子形成化合物。
例如,水(H2O)中的氧原子接受两个氢原子失去的电子形成水分子。
3.氮(N):氮原子的化合价为-3或+5,它可以与其他元素原子形成各种化合物。
例如,氨(NH3)中的氮原子与三个氢原子形成了三键,化合价为-3、而在硝酸(HNO3)中,氮原子与三个氧原子形成了三键,化合价为+54.碳(C):碳原子的化合价为-4,它可以与其他元素原子形成各种化合物。
例如,甲烷(CH4)中的碳原子与四个氢原子形成了共价键,化合价为-45.铁(Fe):铁原子的化合价为+2或+3、例如,亚铁离子(Fe2+)的化合价为+2,而三价铁离子(Fe3+)的化合价为+36.铜(Cu):铜原子的化合价为+1或+2、例如,一价铜离子(Cu+)的化合价为+1,而二价铜离子(Cu2+)的化合价为+27.氯(Cl):氯原子的化合价为-1、例如,氯气(Cl2)中的氯原子共享一个电子形成氯分子。
8.氟(F):氟原子的化合价为-1、例如,氟化钠(NaF)中的氟原子接受了钠原子失去的电子形成氟化钠晶体。
这只是一部分常见元素及其化合价的例子。
化学中有许多元素及其多种化合价的存在,因此化学家将它们整理成了元素周期表。
元素周期表可以帮助我们更好地了解元素及其化合价的规律和特点。
值得注意的是,元素的化合价可以根据不同的反应条件和结构而变化。
所以,在具体的化学反应中,我们需要根据具体情况来确定元素的化合价。

1、化合价实质之歌,
化合价实质要记准,金正非负单质零;
氢一氧二应记住,正负总价和为零;
许多元素有变价,条件不同价不同。
注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。
2、化合价之歌
氢氯钾钠一价银,二价氧钡钙镁锌,三铝四硅磷五价,
二四六硫都齐啦。
谈变价,也不难,二三铁,二四碳,
三二四五氮都有,二四六七锰来占,铜汞二价最常见。
氟氯溴碘本负一,特殊情况为正七。
3、书写化学式之歌
先念后写再标价,约分之后相交叉。
第1页共1页。
初中化学“化合价口诀+全部方程式”化合价口诀 (熟记)(正价)氢钠钾银正一价,钙镁钡锌正二价,铝三硅四氮磷五,二四六硫二四碳,铜汞二一,铁二三(负价), 氟氯溴碘负一价,氧硫常显负二价;氮磷均有负三价;单质化合价为零。
• 一价钾钠氯氢银:钾(K )钠(Na )在化合物中通常显 +1 价;氯(Cl )在氯化物中一般显 -1 价(如氯化钠 NaCl );氢(H )在化合物中常为 +1 价;银(Ag )在化合物中通常显 +1 价。
• 二价氧钙钡镁锌:氧(O )在化合物中一般显 -2 价(除过氧化物等特殊情况);钙(Ca )、钡(Ba )、镁(Mg )、锌(Zn )在化合物中常显 +2 价。
• 三铝四硅五价磷:铝(Al )在化合物中通常显 +3 价;硅(Si )常见化合价为 +4 价; 磷(P )有 +5 价等多种化合价,这里主要强调常见的 +5 价。
• 二三铁,二四碳:铁(Fe )有 +2 价(亚铁离子)和 +3 价(铁离子);碳(C )有 +2 价(如一氧化碳 CO )和 +4 价(如二氧化碳 CO₂)。
• 二四六硫都齐全:硫(S )有 -2 价(如硫化氢 H₂S )、+4 价(如二氧化硫 SO₂)和 +6 价(如三氧化硫 SO₃)。
• 铜汞二价最常见:铜(Cu )和汞(Hg )在化合物中通常显 +2 价,但铜也有 +1 价(如氧化亚铜 Cu₂O )。
• 氢一氧二要记清:再次强调氢一般为 +1 价,氧一般为 -2 价。
• 单质元素价为零:任何单质中元素的化合价都为 0 价,比如氧气(O₂)、铁(Fe )等单质中 氧元素和铁元素化合价均为 0 。
常见原子团的化合价负一硝酸NO 3-氢氧根 OH -负二碳酸 CO 32- 硫酸 SO 42-锰酸根 MnO 42-负三只有磷酸根 PO 43-,正一价的是氨根 NH 4+可溶物与不溶物的记忆口诀 口诀一钾钠铵盐均可溶;硝盐入水影无踪 硫酸盐中钡不溶;氯化盐中银不溶 碳酸盐中只溶钾、钠、铵; 碱只溶钾、钠、钙、钡、铵 口诀二钾钠铵盐硝酸盐,完全溶解不困难。