
淋巴细胞提取
一实验目的:小鼠脾淋巴细胞提取
二实验对象:B/C 小鼠
三实验器材:
1.试剂:淋巴细胞分离液、1640培养基
2.器材:无菌培养皿、200目尼龙网(裁成90mm*90mm正方形,灭菌)、10mL玻璃注射器内活塞(灭菌)、不同规格的镊子、剪刀若干(灭菌)、细胞实验常用器材(离心管、移液管、加样枪、离心机)、75%乙醇、烧杯(无菌)、大头针、超净台
四实验步骤:
1、断头处死小鼠,浸入75%的乙醇中浸泡1-2分钟。
2、在超净台中小心剪开小鼠腹部外皮,用大头针固定,再剪开小鼠腹腔,用镊子摘下小鼠脾脏。注意无菌操作。
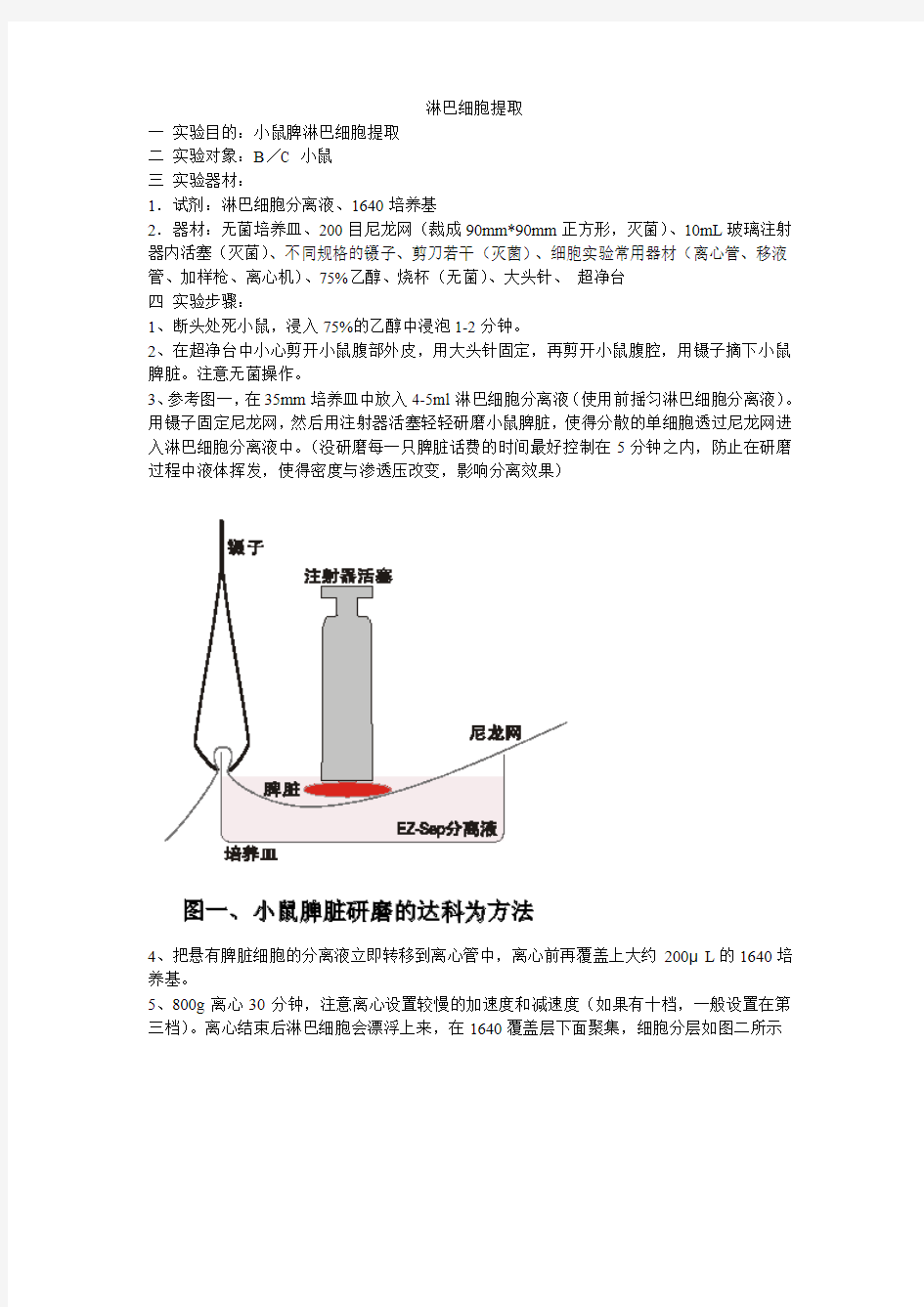
3、参考图一,在35mm培养皿中放入4-5ml淋巴细胞分离液(使用前摇匀淋巴细胞分离液)。用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网进入淋巴细胞分离液中。(没研磨每一只脾脏话费的时间最好控制在5分钟之内,防止在研磨过程中液体挥发,使得密度与渗透压改变,影响分离效果)
4、把悬有脾脏细胞的分离液立即转移到离心管中,离心前再覆盖上大约200μL的1640培养基。
5、800g离心30分钟,注意离心设置较慢的加速度和减速度(如果有十档,一般设置在第三档)。离心结束后淋巴细胞会漂浮上来,在1640覆盖层下面聚集,细胞分层如图二所示
6、析出淋巴细胞层,再加入10mL1640培养基,250g离心10分钟。倾倒上清液,加入3-5mL Lympho-SpotTM无血清培养基重悬,细胞计数。
五、注意事项:
①离心前在细胞悬液上面加盖一层1640培养基,既有利于漂浮上来的淋巴细胞的聚集,又有利于下一步的吸取操作。覆盖层不必太厚,2Μl足矣。
②如果实验者一次实验要处理很多只小鼠,需要注意两点:其一,每研磨一只小鼠,立即把脾细胞悬液从培养皿转入离心管中,注意盖严管盖,切不可敞口放在超净台中。否则,液体挥发,密度与渗透压都会改变,严重影响分离效果。其二,在所有的小鼠脾脏处理完后,统一再加1640覆盖层。如果加早了,两层液体会相互扩散,造成最终离心后的淋巴细胞层下移。
③推荐使用尼龙网替代不锈钢网筛,以为尼龙网更柔软些
④使用注射器活塞代替镊子研磨脾脏,由于镊子夹住脾脏的力度不好控制,易造成细胞死亡。
脾淋巴细胞的制备
将试验小鼠摘除眼球放血后,颈椎脱臼处死后,浸泡于75%酒精中5min;将小鼠固定于解剖板上,无菌打开腹部的皮肤,暴露腹膜,用眼科剪打开腹膜,小心取出脾脏;将脾脏置于已盛有10mL PBS的平皿中,轻轻洗涤并细心剥去周围结缔组织(此步可省略);将脾脏移入200目铜网缝制的小袋中,用4号针头在脾脏表面扎几个针孔,然后用装在1mL注射器上的弯针头轻轻刮取脾脏,使脾细胞从针孔中溢出并透过铜网进入PBS中,再加入少许PBS,并用吸管吹打数次,制成单细胞悬液;取脾淋巴细胞悬液1份,小心沿侧壁加入到2份的淋巴细胞分离液之液面上,以2000rpm离心10~20min;收集界面上的细胞(白色云雾层),放入8~9mL盛有Hank’s溶液的离心管中,混匀后,以1500~2000rpm离心5~10min;吸去上清液,沉淀经反复洗涤2次,即得所需的淋巴细胞;细胞计数,用RPMI-1640完全培养基调节细胞密度至2-5×10*6个/mL;铺板,将细胞悬液加到96孔细胞板中,100μL/孔。
如何从小鼠的脾脏中提取T 淋巴细胞?越详细越好,最好有每一步的具体操作步骤
枸杞多糖对荷瘤小鼠肿瘤微环境T淋巴细胞亚群及树突状细胞的影响
〔摘要〕目的:研究枸杞多糖(Lycium barbarum polysaccharide, LBP)对荷瘤小鼠体内肿瘤微环境中T淋巴细胞亚群和树突状细胞(dendritic cells, DCs)的影响,探讨LBP对荷瘤机体免疫逃逸的干预作用。方法:用LBP给H22荷瘤小鼠灌胃,连续2周后,测定肿瘤重量,采用流式细胞术检查肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)中T 淋巴细胞亚群和DCs的数量,以及协同刺激分子CD80(B71)表达的变化。结果:LBP 可明显抑制肿瘤细胞的生长,增加肿瘤浸润CD4+、CD8+细胞的数量。LBP高剂量组CD4+和CD8+细胞数量的百分比高于模型组(P<0.05)。LBP低剂量和高剂量组肿瘤浸润DCs数量及B71表达均较模型组升高,但差异无统计学意义。结论:LBP的抗肿瘤作用可能与恢复荷瘤小鼠TIL中CD4+、CD8+的细胞数量、解除机体的免疫抑制状态及增强机体的抗肿瘤免疫功能有关。LBP能否恢复荷瘤机体DCs的表型及功能尚待进一步研究。
〔关键词〕枸杞多糖; 免疫抑制; 淋巴细胞亚群; 肿瘤浸润淋巴细胞; 树突状细胞
Effects of Lycium barbarum polysaccharide on tumor microenvironment T lymphocyte subsets and dendritic cells in H22bearing mice
HE Yan Li, YING Yi, XU Yan Li, SU Jun Fang, LUO Hui, WANG Hui Feng
(Department of Pathology, Guangzhou University of Traditional Chinese Medicine, Guangzhou, Guangdong Province 510405, China; Department of Hematology, Guangzhou Municipal First People’s Hospital, Guangzhou, Guangdong Province 510180, China)
ABSTRACT Objective: To study the effects of Lycium barbarum polysaccharide (LBP) on tumor microenvironment T lymphocyte subsets and dendritic cells in H22bearing mice and the mechanisms for intervention of tumor immune escape by LBP. Methods: H22bearing mice were given LBP orally for two weeks. T lymphocyte subsets and the phenotypes of dendritic
cells in tumor infiltrating lymphocytes (TIL) were detected by flow cytometry (FCM). Results: LBP could significantly increase the numbers of CD4+ and CD8+ T cells in TIL as compared with those in model control group (P<0.05). In model control group, the number of dendritic cells in tumor microenvironment decreased markedly, while in LBP treated group, the increased number of dendritic cells and B7 1 expression were observed, but there were no significant differences between these two groups. Conclusion: LBP has anti tumor effect probably by increasing the numbers of CD4+and CD8+ T cells in TIL to relieve the immunosuppression and enhance the anti tumor function of the immune system. But whether LBP can recover the phenocyte and function of dendritic cells in H22bearing mice should be further studied.
KEY WORDS Lycium barbarum polysaccharide; immunosuppression; T lymphocyte subsets; tumor infiltrating lymphocyte; dendritic cells
近年来的研究发现:肿瘤患者体内存在多种免疫逃逸机制,表现为CD4+和CD8+ T淋巴细胞数量减少,CD4+/CD8+比值改变及肿瘤间质中的树突状细胞(dendritic cells, DCs)表型异常,这些都是导致恶性肿瘤细胞逃逸机体免疫监视从而造成肿瘤持续生长并发生转移的原因〔1,2〕。已有研究证实:枸杞多糖(Lycium barbarum polysaccharide, LBP)具有明显的免疫调节和免疫保护功能,可以增强机体的抗肿瘤作用〔3,4〕。但LBP抗肿瘤的作用机制究竟为何?是否与其影响免疫活性细胞的功能有关?如何从免疫逃逸的角度探讨LBP的抗肿瘤作用机制?有关这方面的研究却鲜见报道。本实验以H22肝癌腹水瘤荷瘤小鼠为模型,研究LBP在全身给药情况下,对肿瘤微环境中T淋巴细胞亚群及DCs的影响,从免疫逃逸的角度揭示LBP抗肿瘤作用的机制。
1材料与方法
1.1材料昆明种小鼠,清洁级,6~8周龄,体质量(18±2)g,雌雄各半,广州中医药大学动物中心提供,动物质量合格证号0002769;H22肝癌腹水型细胞株,中山大学医学院动物中心细胞库提供;LBP,由广州中医药大学药物化学研究所自宁夏枸杞子中提取,呈棕黄色粉末,纯度≥35%;Ⅳ型胶原酶和Ⅰ型DNase酶,均为Sigma公司产品;淋巴细胞分离液,广州展晨生物科技有限公司产品;异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的抗小鼠CD4、CD80(B71)单克隆抗体,藻红蛋白(phycoerythrin, PE)标记的抗小鼠CD8a、CD11c单克隆抗体,美国BioLegend公司产品;电子天平,日本岛津公司产品;FACS Vantage流式细胞仪,美国Becton Dickinson公司产品。
1.2实验动物及分组昆明种小鼠60只,随机分成4组:正常组、模型组、LBP低剂量组和LBP高剂量组,每组15只。其中后3个组,第1天右侧腋下接种2×106个H22肿瘤细胞。第3天起,前2个组小鼠予以生理盐水灌胃,0.5 ml/d;后2个组LBP给药剂量根据文献〔5〕结合预试验结果,分别给予LBP 0.625 g·kg1·d1及1.25 g·kg1·d1灌胃(均用生理盐水稀释成0.5 ml/d),连续灌胃14 d。
1.3LBP体内抑瘤率的测定每日观察并记录小鼠生长情况及肿瘤大小,第15天小鼠眼球放血后予以脱颈处死,解剖并观察肿瘤大小及重量,计算肿瘤生长抑制率:局部肿瘤的生长抑制率=(模型组平均瘤重-LBP组平均瘤重)/模型组平均瘤重×100%。所有动物均摘取胸腺称重,计算胸腺指数(胸腺指数=小鼠胸腺质量/体质量)。
1.4肿瘤间质淋巴细胞的分离肿瘤组织称重后,挑选瘤体质量≥2 g者置于含青霉素和链霉素各500 U/ml、甲硝唑5 μg/ml的RPMI1640培养液中浸泡30 min后,将瘤体剪成1 mm3大小,置于含0.05% Ⅳ型胶原酶、0.003% Ⅰ型DNase酶及10%小牛血清的RPMI1640培养液中,4 ℃磁力搅拌过夜消化,200目消毒铜网过滤洗涤后,1 500 r/min离心15 min,分离获得肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL),用D Hanks液洗涤2次,台盼蓝染色检测细胞活力,调整细胞浓度至1×106/ml。
1.5TIL中CD4、CD8a、CD11c、CD80流式细胞仪分析每个样本分3管,每管中加入3×105个细胞,PBS液调整总体积为100 μl,其中第1管中加入不同荧光素标记的抗鼠CD4、CD8a 单克隆抗体0.5 μl(0.25 μg)、1.0 μl(0.2 μg),第2管中加入不同荧光素标记的抗鼠CD11c、CD80单克隆抗体1.0 μl(0.2 μg)、1.0 μl(0.5 μg),第3管为空白对照管,室温避光孵育30 min,PBS液洗涤2次,每次实验取2管细胞分别加入FITC和PE单荧光素标记抗体,用流式细胞仪检测。
1.6统计学方法所有实验数据均采用SPSS 11.5软件进行统计学分析,行单因素方差分析及组间比较最小显著差(least significant difference, LSD)法。
2结果
2.1LBP对H22荷瘤小鼠肿瘤生长及胸腺指数的影响模型组平均瘤体质量(2.48±0.40)g,LBP低剂量组和高剂量组分别为(1.89±0.29)g和(1.46±0.26)g,其中,LBP高剂量组与模型组比较,差异有统计学意义(P<0.05)。LBP低剂量组和高剂量组的肿瘤生长抑制率分别为2
3.79%和41.12%。模型组荷瘤小鼠的胸腺质量较正常组轻,LBP组荷瘤小鼠的胸腺质量及胸腺指数则有所恢复。见表1。
表1 LBP对H22荷瘤小鼠胸腺指数的影响(略)
Tab 1 Effect of LBP on thymus index in H22bearing mice
*P<0.05, vs model control group
2.2LBP对H22荷瘤小鼠TIL中T淋巴细胞亚群的影响模型组肿瘤间质浸润CD4+、CD8+ T淋巴细胞的百分比分别为(12.89±1.05)%和(7.72±0.48)%。LBP组CD4+和CD8+细胞的百分比较模型组均有明显升高,其中LBP低剂量组CD8+与模型组比较差异有统计学意义(P<0.05),LBP高剂量组CD4+、CD8+与模型组比较差异均有统计学意义(P<0.05)。见表2。
2.3LBP对H22荷瘤小鼠TIL中DCs的影响模型组TIL中CD11c+百分比为(2
3.07±2.36)%,CD80+为(15.15±1.47)%,双阳性细胞仅为(11.65±1.73)%;LBP组CD11c+、CD80+及双阳性细胞的百分比较模型组均略有升高,与CD4+、CD8+细胞百分比的升高变化有一定的平行关系,但模型组、LBP低剂量组和LBP高剂量组这三者之间的比较差异无统计学意义。见表2。
表2 LBP对H22荷瘤小鼠TIL中T淋巴细胞亚群及DCs的影响(略)
Tab 2 Effect of LBP on T lymphocyte subsets and phenotypes of dendritic cells in TIL
*P<0.05, vs model control group
3讨论
已有研究证实:LBP具有广泛的免疫调节作用,可以增强机体的抗肿瘤效应〔3,4〕。本实验发现:LBP能明显抑制H22荷瘤小鼠肿瘤的生长,与文献报道一致,LBP高剂量组肿瘤生长抑制率为41.12%,与模型组比较差异有统计学意义(P<0.05);LBP还可提高荷瘤小鼠的胸腺质量及胸腺指数,对胸腺具有一定的保护作用。
机体的抗肿瘤免疫主要依靠T淋巴细胞介导的细胞免疫。成熟的T淋巴细胞分为CD4+和CD8+ T淋巴细胞两个亚群。一般认为:CD4+ T淋巴细胞产生大量的细胞因子,CD8+ T 淋巴细胞在CD4+ T淋巴细胞的辅助及细胞因子的作用下可以杀伤肿瘤细胞,初次的抗肿瘤免疫反应主要依赖CD8+ T淋巴细胞和自然杀伤细胞的参与。肿瘤特异性的CD4+ T淋巴细胞对肿瘤细胞也具有直接的杀伤作用〔6〕。缺乏CD4+和CD8+ T淋巴细胞,以及CD4+/CD8+比值的降低是导致抗肿瘤免疫效应低下的原因之一。一些研究还发现:LBP是一种有效的免疫增强剂,对免疫系统具有正向的调节作用。刘彦平等〔7〕用BALB/c小鼠做体内研究发现:LBP能增加小鼠脾脏总的T淋巴细胞、辅助性T淋巴细胞(helper T cell, Th)及抑制性T淋巴细胞(suppressor T cell, Ts)的数量,使Th和Ts亚群的比例恢复正常。有研究报
道:食管癌组织中的TIL经白细胞介素2、白细胞介素4联合中药黄芪、干地黄水提取物行体外诱导后,CD3+、CD4+细胞比例及CD4+/CD8+的比值均明显上升〔8〕。本实验通过流式细胞术检测发现:模型组TIL中的T淋巴细胞数量明显减少,表明肿瘤微环境中T淋巴细胞的抗肿瘤免疫活力低下,而LBP组的CD4+、CD8+ T淋巴细胞则恢复明显,CD4+在LBP高剂量组,CD8+在LBP低、高剂量组与模型组之间的比较差异均有统计学意义,说明LBP可促进TIL中CD4+、CD8+ T淋巴细胞的增殖与活化,直接杀伤肿瘤细胞,或通过其分泌的细胞因子辅助杀伤肿瘤细胞,一定程度地解除荷瘤机体的免疫抑制状态,从而产生抗肿瘤的效应。
DCs是目前发现的功能最强的抗原提呈细胞,在抗肿瘤免疫应答中起着不可替代的作用,多数证据表明,荷瘤机体免疫机制的失能不是由于缺乏肿瘤抗原,而是由于DCs的功能缺陷导致这些抗原不能被有效地提呈给T淋巴细胞,从而不能诱导细胞毒性T淋巴细胞产生有效而特异性的免疫应答。有多种原因可导致荷瘤机体DCs表型的改变,是引起抗肿瘤免疫功能减弱的直接原因。Chaux等〔9〕研究发现:癌旁组织浸润的炎性细胞中主要组织相容性复合体Ⅱ类抗原分子高表达,而其B71(CD80)和B72(CD86)等共刺激分子则无表达或低表达;丘少鹏等〔10〕对前列腺癌肿瘤微环境中DCs细胞与T淋巴细胞之间免疫关系的研究发现:肿瘤间质中DCs占(20.89±6.06)%,明显低于癌旁组织中的(43.11±6.13)%,且与T淋巴细胞的分布显著相关,故认为癌组织中DCs数量的减少可能与前列腺癌肿瘤微环境T淋巴细胞抗肿瘤的免疫功能低下有关。LBP在体内外可促进多种细胞因子的分泌〔11〕,如白细胞介素2、白细胞介素3、白细胞介素6以及肿瘤坏死因子等,这些因子均能刺激DCs增殖及表型成熟〔12〕。CD11c强烈表达于DCs,通常采用B71、B72分子及主要组织相容性复合体Ⅱ类抗原分子等单克隆抗体检测DCs细胞表型及成熟程度〔13,14〕。本实验发现:模型组肿瘤间质中浸润的单个核细胞CD11c+的百分比为(23.07±2.36)%、CD80+为(15.15±1.47)%,而双阳性细胞只占(11.65±1.73)%,说明成熟、有功能的DCs细胞数量较低;LBP低、高剂量组CD11c+、CD80+及双阳性细胞的百分比均有所上升,与T淋巴细胞亚群的变化有一定的平行关系,但各组间的比较无统计学意义。本实验还发现:LBP可以增加肿瘤间质中CD4+、CD8+ T淋巴细胞的数量,LBP是否可通过使DCs前体细胞增殖并诱导分化为成熟的DCs而使其具有正常的抗原提呈能力,进而激活T淋巴细胞,从而发挥抗肿瘤的作用?上述问题值得进一步研究。
因流式细胞仪的检测有一定的细胞数量要求,细胞数低于105以下时数据的准确性下降,而肿瘤间质中淋巴细胞的分离操作步骤繁琐,又有多次的洗涤过程,因此可能造成较多细胞的损伤与丢失,当肿瘤组织块太小时,更容易导致检测失败,所以只将肿瘤重量≥2 g者纳入检测范围,但这样就造成肿瘤体积明显减少的一部分LBP组的样本未纳入检测范围,从而可能导致结果的偏差。而LBP的抗肿瘤作用是否与其增加DCs的数量及促进其成熟有关,尚待进一步的研究。
T淋巴细胞尼龙毛柱分离法
在研究体内及体外的免疫系统时,分离淋巴细胞群是一个关键步骤。因为现在市场上并没有针对B细胞的特异性抗血清,所以分离淋巴细胞中的T细胞并不是十分方便。T细胞尼龙毛分离法利用了尼龙毛对B细胞的亲和力,从而使T细胞在没有严重损伤的情况下达到的足够的纯度。因为这个方法不像流式和磁珠费用昂贵,而且操作简便,所需要的条件也不高,是一种非常实用的方法。
(在此我向各位解释一下,现在分离T细胞的方法主要是三种,流式,磁珠法,尼龙毛法。与前两种方法相比,尼龙毛法的优势在于无需特定的设备仪器,一般的实验室均有条件操作;价格相对低廉;可以进行大量样本操作。)
首先要指出的是实验中所使用的是分离T细胞专用的尼龙毛(Nylon Fiber),不是化工上的尼龙纤维,曾经有人问过我这种问题,如果你买错了,可是做不出来的!其次,现在市面上的尼龙毛也是良隽不齐,也有同仁反应买到的尼龙毛加入缓冲液以后成了一团糨糊,根本没法使用,这个问题就要靠各位的慧眼了。
现在市面上有尼龙毛填料,也已经有了商品化的尼龙毛柱子,这两者的区别主要是以下两点:1.商品化的柱子的填料量是已经定好的,有一个确定的上样量范围。而自己买填料装柱可以控制填料量,也就是可以控制上样量,这对于样本量非常少,或是样本量非常大的实验需求非常合适。
2.商品化的柱子已经经过了无菌处理(一般是辐射灭菌),而自己装柱当然就要自己灭菌了。
3.商品化的柱子在实验的重复性上有着绝对的优势。自己装的柱子在填料的处理和装柱的松紧等方面不容易控制,差异性的控制就看你的实验技巧了。
操作方法:
1.秤取1.5g尼龙毛装入20-30ml玻璃或一次性注射器内(要可以灭菌的),填料的体积控制在15毫升左右(注射器上有标记,所以还是比较好控制的),因为尼龙毛的松紧关系到T细胞的回收率,所以要特别注意。注射器下端配接5厘米左右长的带有弹簧夹的橡皮管。
2. 加入大量的PBS平衡柱子后,用铝箔包裹,并置于适当的容器内,高压灭菌15分钟。(商品化尼龙毛柱以上步骤可以省略,经过无菌PBS平衡后直接进行下列步骤。)
3. 灭菌的尼龙毛柱垂直固定后放于超净台内,顶部以铝箔覆盖,避免污染。
4. 橡皮管,弹簧夹用无水酒精消毒后接注射器下端,打开弹簧夹调节流速在大约3-4ml/min。
5.首先,加入3-4倍柱体的无血培养基平衡;随后,之后加入相同体积的含有血清的培养基平衡(上述培养基都要预热),最后等培养基页面接近柱填料页面时,关闭弹簧夹。
6. 样本细胞悬浮液浓度控制在5×108cells/ml的,上样量一般是1/3-1/5柱体积(商品化的柱子一般都有推荐上样量)。样品加入之后,再加入少量培养液,然后关闭弹簧夹。
7. 柱上覆盖铝箔,移置于消毒过的容器中,37℃孵育1小时。此过程中柱子必须要保持垂直状态。
8. 从培养箱中拿出柱子,置于超净台内,除去铝箔。接上按照4.中的方法消毒的弹簧夹和橡皮管,加入适当体积经37℃预热的培养基,打开弹簧夹控制流速在3-4 mL/min,流出约5ml之后,流出的培养液基变得不透明,此时其中含有T细胞,收集这一部分培养基。
9. 基本上何时结束收集取决于流出液体中细胞的浓度,实际上,收集的量达到一个柱体积时就可以停止收集,因为即使收集更多的量,回收率几乎不会增加。
10 。参考数据:
样本:小鼠脾脏(T细胞含量在30-40%,B细胞含量在55-60%)
细胞回收率:13-25%
B细胞污染率:小于15%
样本:大鼠脾脏(T细胞含量在30-35%,B细胞含量在55-65%)
细胞回收率:大于25%
B细胞污染率:小于15%
样本:人或兔外周血
细胞回收率: 20-30% (人);25-35% (兔)
B细胞污染率:小于5% (人、兔)
(注)收集粘附于尼龙毛上的细胞时,将T细胞收集完毕后的尼龙毛在无菌操作的状态下取出,转移到适当的容器中,用镊子小心的将尼龙毛松开,粘附的细胞可以洗到培养基中。或者将注射器芯插入注射器内,通过压力使的粘附的细胞随着液体流出。
更多资料
T细胞尼龙毛柱0.5g*10 (推荐用于小鼠脾脏)
T细胞尼龙毛柱L型 1g*10 (推荐用于大鼠脾脏、人或兔子的外周血)
T细胞尼龙毛 2g*5 (可按照自己的需要装柱,控制上样量)
小鼠淋巴细胞分离试剂30mL*5 用于从小鼠脾脏,淋巴结,淋巴结悬浮液中分离淋巴细胞人淋巴细胞分离试剂100ml*6 用于从人血中提取淋巴细胞
铁粉(羰基铁)Iron Powder, from Iron Carbonyl 25g 直径25um,用于清除巨噬细胞
κ-卡拉胶κ-Carrageenan 25g
从小鼠脾脏中分离T/B淋巴细胞,大体步骤如下:无菌取脾——过100目不锈钢筛网——淋巴细胞分离液离心分离——取第二层淋巴细胞液——洗涤——计数
免疫细胞的观察与小鼠脾脏淋巴细胞的提取 一、实验目的 1、明确各免疫器官分布与形态结构,能熟练找到各免疫器官,弄清中枢免疫器官与外周免疫器官的区别与联系。 2、掌握密度梯度离心法分离小鼠脾脏淋巴细胞的方法,熟悉脾脏淋巴细胞的形态与功能。 二、实验原理 脾脏是外周免疫器官之一,是人体最大的淋巴器官。它生在腹腔左上方,质地比较脆,容易外伤。一般来讲,脾脏有三大功能: 首先它是人体的“血库”,当人体休息、安静时,它贮存血液,当处于运动、失血、缺氧等应激状态时,它又将血液排送到血循环中,以增加血容量; 其次,脾脏犹如一台“过滤器”,当血液中出现病菌、抗原、异物、原虫时,脾脏中的巨噬细胞、淋巴细胞就会将其吃掉; 此外,脾脏还可以制造免疫球蛋白、补体等免疫物质,发挥免疫作用。脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。因此,脾功能亢进时可能会引起红细胞及血小板的减少。脾脏还有产生淋巴细胞的功能。 我们利用小鼠来观察脾脏的淋巴细胞。 小鼠淋巴细胞的比重为1.088,利用比重为1.088的淋巴细胞分离液,将脾细胞悬液置于分离液上层,通过梯度离心的方法,在分离液与脾细胞悬液交界液面处分离得到脾脏淋巴细胞。 三、实验器材 KM种小鼠,PBS缓冲液,淋巴细胞分离液,200目不锈钢网,解剖器械 四、实验步骤 1、杀死老鼠,取出小鼠的脾脏,在pbs缓冲液中冲洗干净。 2、将小鼠脾脏至于200目铜网中,铜网绑定在烧杯上面,剪碎、碾磨,边碾磨边加PBS 冲洗,制得脾细胞悬液。 3、将制得的脾细胞悬液转移到10ml的离心管中,1000r/min 5min离心洗涤,倒掉上清,加入5mlPBS再离心洗涤一次。 4、加入5mlPBS将洗涤的脾脏细胞吹散、悬浮,缓慢加入淋巴细胞分离液上层,细胞悬液与分离液体体积比为1:1。 5、2000r/min离心30min。 6、小心吸取中间层细胞,1000r/min 5min离心洗涤两次。 7、将制得的淋巴细胞滴于玻片,镜检。
实验三小鼠脾脏细胞原代培养及观察计数 13生物基地 201300140059 刘洋 2015-04-06 同组者:吕赞洪俊蔡正琦 一、实验目的 1.学习掌握细胞培养的基本原理以及具体方法,并对小鼠脾细胞进行原代培养。 2.掌握无菌操作的具体过程及无菌操作台的使用。 3.学习掌握染色法鉴别细胞的生死状态的原理及方法。 4.学习使用血球计数板对细胞总数及活细胞数进行计数。 二、实验原理 1.细胞培养 细胞培养指的是在无菌条件下,把动植物细胞从组织中取出,在体外模拟体内的生理环境,使离体的细胞在体外生长和繁殖,并且维持其结构和功能的一种培养技术。动物细胞培养可分为原代培养和传代培养。从供体获得组织细胞,在无菌条件下,用胰蛋白酶消化或机械分散等方法,将动物组织分散成单个细胞开始首次培养长出单层细胞的方法称为细胞的原代培养。当培养的动物细胞生长增殖达到一定密度,形成致密的单层细胞时,用胰蛋白酶将细胞消化分散成单细胞,从一个容器中以1:2或其他比例转移到另一个容器中扩大培养的方法,称为细胞的传代培养。传代培养的累计次数就是细胞的培养代数。 高等生物是由多细胞构成的整体,在整体条件下要研究单个细胞或某一群细胞在体内的功能活动是十分困难的。但如果把活细胞拿到体外培养、增殖并进行观察和研究,则要方便和简单得多。被培养的动物细胞是非常好的实验对象和实验研究材料,对体外培养的活细胞进行研究可以帮助人类揭开生、老、病、死的规律,探索优生、抗衰老和防治各种疾病的途径和机制,也可以人为地诱导和改变细胞的遗传性状和特性,使其向有利于人类健康长寿的方向发展。因此动物细胞体外培养技术是研究细胞分子机制非常重要的实验手段,被广泛应用于医学、生物技术、基因工程等研究领域。 细胞培养的意义:具有其他生物技术无可比拟的优点;培养条件易改变和控制,便于单因子分析;便于人们直接对细胞内结构、细胞生长及发育等过程的观察;在生物学的各个领域(如分子生物学、细胞生物学、遗传学、免疫学、肿瘤学及病毒学等)已被广泛应用。 细胞培养的局限性:在脱离机体复杂环境下,细胞培养条件与躯体环境有一定距离;观察到的结果有时难以正确反映机体内的状况;细胞培养得到的产物少。 培养细胞的条件有水的质量、无菌环境,最适温度、渗透压、气体条件、最适PH、营养条件和培养基质等。 2.细胞死活鉴定 细胞生死状态的鉴别方法主要是化学染色法和荧光染色法。 活细胞和死亡细胞在生理机能和性质上主要存以下差异: ①细胞膜通透性的差异:活细胞的细胞膜是一种选择性膜,对细胞起保护和屏障作 用,只允许物质选择性地通过;而细胞死后,细胞膜受损,其通透性增加。基于此,发展出了以台盼蓝、伊红、苯胺黑、赤藓红、甲基蓝以及荧光染料碘化丙啶或溴化乙啶等为染料鉴别细胞生死状态的方法,上述染料能使死亡细胞着色,而活细胞不被着色。此外,应用植物质壁分离的性质也可鉴定植物细胞的生死状态。活细胞的原生质具有选择透过性,死细胞因其原生质的选择透过性已遭破坏,故与高渗透压溶液接触
小鼠肿瘤浸润组织淋巴细胞分离液说明书 【产品规格】200ml/Kit 【产品组成】 为方便广大用户使用,试剂内容如下: 名称 产品编号 规格200ml 200ml 200ml 200ml 1份 A B C D E 小鼠肿瘤浸润组织淋巴细胞分离液样本稀释液(赠品)清洗液(赠品)2010C11192010X1118F2013TBD F 液(赠品)说明书 【实验前准备】A .适用仪器 最大离心力可达1200g 的水平转子离心机B .耗材 产品名称产品货号339650339651339652339653 产地15ml 离心管散装美国NUNC 15ml 离心管架装美国NUNC 美国NUNC 美国NUNC 50ml 离心管散装50ml 离心管架装无菌胶头滴管或塑料滴管【检验方法】 全过程样本、试剂及实验环境均需在20±2℃的条件下进行。1.首先制备组织单细胞悬液,制备方法详见“组织单细胞悬液制备技术”。 2.取一支15ml 离心管,加入与组织单细胞悬液等量的分离液(注:分离液最少不得少于 3ml )。 3.用吸管小心吸取组织单细胞悬液加于分离液液面上,400-500g ,离心20-30min 。(注: 根据组织单细胞悬液量确定离心条件,组织单细胞悬液量越大,离心力越大,离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果)。
4.离心后,此时离心管中由上至下分为四层。第一层为稀释液层。第二层为环状乳白色淋 巴细胞层。第三层为透明分离液层。第四层为红细胞层。 5.用吸管小心吸取第二层环状乳白色淋巴细胞层到另一15ml离心管中,向离心管中加入 10ml清洗液(产品编号:2010X1118),混匀细胞。 6.250g,离心10min。 7.弃上清。 8.用吸管以5ml清洗液(产品编号:2010X1118)重悬所得细胞。 9.250g,离心10min。 10.重复7、8、9,弃上清后以0.5ml后续实验所需相应液体重悬细胞。 【注意事项】 1.全过程样本、试剂及实验环境均需在20±2℃的条件下进行。为获得最佳的实验结果,最 好在取样2h内进行实验,样品存放时间越长,细胞分离效果越差。样品放置超过6h后分离效果更差甚至不能达到分离目的。 2.本实验最好不要使用高聚合材质(如聚苯乙烯)的塑料制品,应使用无静电、低静电离 心管及未经碱处理过后的玻璃制品,因为静电作用将导致细胞贴壁、碱处理的玻璃表面会变成毛面,影响细胞分离效果。 3.吸取过多的淋巴细胞层及分离液层会导致分离液交界处的粒细胞被吸出从而使混杂的粒 细胞数量增加。 4.分离液用量大于组织单细胞悬液样本时,分离效果更佳。 5.如实验后细胞得率或活性过低,请联系上海研谨生物以获得技术支持。 【储存条件及有效期】 18-25℃保存,有效期2年。本品易感染细菌,需无菌条件操作。无菌条件下操作,启封后置常温保存。如4℃保存,本分离液易出现白色结晶,影响分离效果。 【参考值(参考范围)】 本实验淋巴细胞提取率及纯度大于80%。 下表为成年人外周血中各种细胞的数量及比例,用户可适当进行参考。 红细胞白细胞血小板 (4.0-10.0)×109 含量(个/L)(4.0-5.5)×1012(1.0-3.0)×1011 中性粒细胞淋巴细胞单核细胞
小鼠脾脏中分离淋巴细 胞 Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】
从小鼠脾脏中分离淋巴细胞 1小鼠断颈处死,酒精浸泡5分钟,超净台内打开左侧腹部皮肤,小心分离皮下组织和腹部肌肉暴露出脾脏,提起,剪去周围结缔组织,放入有PBS的小瓶中。无菌镊子夹碎,挤压脾脏,将获得的细胞悬液移入无菌试管中。 2另取无菌试管,先加入淋巴细胞分离液,然后将试管倾斜,略放平,吸取刚刚制备的细胞悬液缓慢的加入试管中,一般分离液和细胞悬液的体积比为1:2,要轻要慢,不要冲破了淋巴细胞分离液和细胞悬液的界面。选用适合自己分离目的细胞的离心力和时间进行离心。个人用1500转/分钟,20分钟。 3离心后取出试管,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。吸走上层非细胞层弃之,吸出单个核层在另外无菌试管中,因为淋巴细胞分离液对细胞有毒性作用,加入PBS 离心洗两遍(PBS1000转/分钟,10分钟)。 4,洗好的细胞加入1640培养液和20%的血清中重悬,缓慢加入已经制备好的尼龙毛柱子中,封好,放37度孵育一小时。一小时后取出,超净台内将柱子立起,针头下面放无菌试管(我们的柱子是用大号注射器做的),以HANKS液和血清先后缓慢冲洗,巨噬细胞贴在尼龙毛上不下来,B细胞也相对吸附冲洗下来的不多,所以冲洗来的大多是T细胞,纯度可打到80%到90%,再次冲洗并且用力挤压,这样得到的就是B细胞。得到的细胞可以以1640加血清配制的培养液进一步培
养或做它用。但是淋巴细胞分离液得到的细胞只能算是粗分,如果实验要求高最好选用磁珠或流式分离。
C D和C D T淋巴细胞 检测 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
CD4+ 和CD8+ T淋巴细胞检测?? ? 1? 范围 本章规定了用多平台三级程序法和单平台一步法检测全血中的CD4+ 和 CD8+ T淋巴细胞。 ? 2?? 规范性引用文件 1997 Revised Guidelines for Performing CD4+ T-Cell Determinations in Persons Infected with Human Immunodeficiency Virus (HIV) MMWR 46(RR-2);1-29 Publication date: 01/10/1997。 ? 3? 实验室条件 3.1 人员 进行HIV感染者CD4+ 和CD8+ T淋巴细胞检测的人员须具有艾滋病实验室的上岗资格,并接受过省级以上艾滋病实验室安全及实验操作技术培训。 3.2? 设施和设备 3.2.1? 样品处理区:生物安全柜、离心机、冰箱、水浴箱、旋转振荡器、精确移液器(5μl~50μl、20μl~200μl、200μl~1000μl)。 3.2.2? 流式细胞仪检测区:流式细胞仪 3.3? 功能分区 实验室原则上应分为样品处理区和流式细胞仪检测区,各区的功能是: 3.3.1? 样品处理区应达到生物安全Ⅱ级(BSL-2)实验室要求,用于样品处理、流式检测样品制备。 3.3.2? 流式细胞仪检测区用于制备好的样品上机检测。
? 4? 样品采集、运输和接收 4.1? 样品的采集 4.1.1? 选择合适的抗凝剂,分别用于血液学检测和流式细胞仪的免疫表型检测。 4.1.1.1? 用于血液学检测的抗凝剂 (1) EDTA(1.5±0.15mg/ml血液)。 (2)在血球分析仪生产商允许的时间范围内检测,不超过30h,不检测超出抗凝时间范围的样品。 4.1.1.2? 用于流式细胞仪免疫表型检测的抗凝剂 (1)用K3EDTA抗凝,收集样品应在30h以内,尽早(8h以内)处理。 (2)用ACD或肝素抗凝,收集样品在48h以内,尽早(8h以内)处理。 4.1.2? 静脉采血收集血样,将血液注入一个事先加入适当抗凝剂的试管(用真空试管)。 4.1.2.1? 当收集儿童样品时,采用儿童用注射器、小试管。 4.1.2.2? 采血后立即握住试管两端,颠倒混匀数次,将血液与抗凝剂混匀,以防止凝固。 4.1.3? 准备适当数量的样品管 4.1.3.1? 当同一样品的血球检测和流式细胞仪免疫表型检测在不同实验室内进行时,用2个装有K3EDTA的试管即可。 4.1.3.2? 在所有其它条件下用2个试管(用K3EDTA作血球检测,用K3 EDTA、ACD或肝素作流式细胞仪免疫表型检测)。 4.1.4 ?对所有样品编号,并写明日期和收集时间。 4.2? 样品运输
山东大学实验报告2011年3月30日 姓名张行润系年级 2009级生科4班学号同组者张少华 科目细胞生物学实验题目小鼠脾细胞培养实验仪器编号105 一、实验目的 了解原代细胞培养的基本方法及操作过程。学习细胞计数、营养液的配制等,初步掌握无菌操作方法。 二、实验原理 (一)细胞原代培养 原代细胞培养是指直接从动物体内获取的细胞、组织和器官,经体外培养后,直到第一次传代为止。这种培养,首先用无菌操作的方法,从动物体内取出所需的组织(或器官),经消化,分解成单个游离细胞,在人工培养下,使其不断的生长及繁殖。 细胞培养是一种操作繁琐而又要求十分严谨的实验技术。要使细胞能在体外长期生长,必须满足两个基本要求:一是供给细胞存活所必须的条件,如适量的水、无机盐、氨基酸、维生素、葡萄糖及其有关的生长因子、氧气、适宜的温度,注意外环境酸碱度与渗透压的调节。二是严格控制无菌条件。 (二)细胞死活鉴定 死活细胞的鉴定方法有很多种,常用的有染色法和仪器分析法。染色法是常用的细胞死活鉴定方法,简便,易于操作。不同的死活细胞鉴定方法有各自不同具体的反应机理,但无论采用何种办法,都是利用了死活细胞在生理机能和性质上的差异。 染色法分化学染色法和荧光染色法,根据染色机理的不同,染料或使死细胞着色,或使活细胞着色。死活细胞在生理机能和性质上的差异主要包括: 死活细胞细胞膜通透性的差异:活细胞的细胞膜是一种选择性膜,对细胞起保护和屏障作用,只允许物质选择性的通过;而细胞死亡之后,细胞膜受损,通透性增加。常用的以台盼蓝鉴别细胞死活的方法就是利用了这一性质。台盼蓝,又称锥蓝,是一种阴离子型染料,不能透过完整的细胞膜。所以经台盼蓝染色后只能使死细胞着色,而活细胞不被着色。甲基蓝有类似的染色机理。植物细胞的质壁分离也可鉴定死活。 死活细胞在代谢上的差异:是采用美蓝染料鉴定酵母细胞死活的依据。美蓝是一种无毒染料,氧化型为蓝色,还原型为无色。由于活细胞中新陈代谢的作用,使细胞内具有较强的还原能力,能使美蓝从蓝色的氧化性变为无色的还原型,因此美蓝染色后活的酵母细胞无色;而死细胞或代谢缓慢的老细胞,则因它们的无还原能力或还原能力极弱,使美蓝处于氧化态,从而被染成蓝色或淡蓝色。 除此之外,还有一些细胞器的专有染料。如液泡系的专有染料中性红。中性红是一种低毒性染料,可以使活细胞液泡着红色,而细胞质和细胞核不被着色;死细胞的液泡不被着色或浅染,染料弥散于整个细胞中,细胞核和细胞质被染成红色。有时侯为了增加染色效果可以将两种染料结合使用,如甲基蓝-中性红混合染色法。 三、实验器材
小鼠淋巴细胞分离方法 一、实验用品的准备: 1.采血用品:10ml注射器10个;手套20付;15ml离心管10个;20μl枪头、200μl 枪头、1000μl枪头。摄子、剪刀各2把;加样器;70%酒精;5%碘酒; 2.取脾用品:10ml注射器10个;手术器械10套;手套20付,60mm玻璃培养皿10个; 200 目尼龙网,裁成100mm×100mm正方形10块;10mL 玻璃注射器内活塞10个; 5mL刻度吸管、15mL离心管、1640培养基;鼠淋巴细胞分离液;摄子、剪刀各10 把;70%酒精;5%碘酒;移液器、离心机;刀剪浸泡液(新洁尔灭); 注:红色必须灭菌;蓝色可以不灭菌;绿色需特殊处理;黑色不用灭菌。 二、相关实验: (一)实验名称:分离小鼠脾脏淋巴细胞 实验目的:获得小鼠脾脏淋巴细胞,为ELISPOT实验做准备。 实验动物:BABALB/c小鼠;雌性 实验材料: 1.小鼠淋巴细胞分离液, 2.60mm玻璃培养皿 3.10mL 玻璃注射器内活塞,灭菌 4.气管切开包 5.5mL刻度吸管、15mL离心管、移液器、离心机 6.1640培养基 实验方法 1. 断颈处死小鼠,浸入75%的乙醇中浸泡1-2分钟。 2. 在超净台中小心剪开小鼠的腹部外皮,用大头针固定,再剪开小鼠的腹腔,用镊子取出小鼠脾脏。注意无菌操作。 3. 在培养皿中放入3mL1640基础培养基,将小鼠脾脏放入培养皿中,用1ml注射器吸取小鼠淋巴细胞分离液,注入小鼠脾脏,直至完全分离。 4. 把悬有脾脏细胞的1640培养基缓慢转移到装有6 mL淋巴细胞分离液的15 mL离心管中。 5. 3000转离心15分钟。(病毒室离心机) 6.吸出淋巴细胞层,加入5mL 1640培养基洗涤一次,1500转离心10 分钟。 7.倾倒上清液,加入3-5mL5ml5%FCS1640培养基重悬,细胞计数。 8.对获得的小鼠脾脏淋巴细胞进行ELSPOT 检测。
淋巴细胞提取 一实验目的:小鼠脾淋巴细胞提取 二实验对象:B/C 小鼠 三实验器材: 1.试剂:淋巴细胞分离液、1640培养基 2.器材:无菌培养皿、200目尼龙网(裁成90mm*90mm正方形,灭菌)、10mL玻璃注射器内活塞(灭菌)、不同规格的镊子、剪刀若干(灭菌)、细胞实验常用器材(离心管、移液管、加样枪、离心机)、75%乙醇、烧杯(无菌)、大头针、超净台 四实验步骤: 1、断头处死小鼠,浸入75%的乙醇中浸泡1-2分钟。 2、在超净台中小心剪开小鼠腹部外皮,用大头针固定,再剪开小鼠腹腔,用镊子摘下小鼠脾脏。注意无菌操作。 3、参考图一,在35mm培养皿中放入4-5ml淋巴细胞分离液(使用前摇匀淋巴细胞分离液)。用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网进入淋巴细胞分离液中。(没研磨每一只脾脏话费的时间最好控制在5分钟之内,防止在研磨过程中液体挥发,使得密度与渗透压改变,影响分离效果) 4、把悬有脾脏细胞的分离液立即转移到离心管中,离心前再覆盖上大约200μL的1640培养基。 5、800g离心30分钟,注意离心设置较慢的加速度和减速度(如果有十档,一般设置在第三档)。离心结束后淋巴细胞会漂浮上来,在1640覆盖层下面聚集,细胞分层如图二所示
6、析出淋巴细胞层,再加入10mL1640培养基,250g离心10分钟。倾倒上清液,加入3-5mL Lympho-SpotTM无血清培养基重悬,细胞计数。 五、注意事项: ①离心前在细胞悬液上面加盖一层1640培养基,既有利于漂浮上来的淋巴细胞的聚集,又有利于下一步的吸取操作。覆盖层不必太厚,2Μl足矣。 ②如果实验者一次实验要处理很多只小鼠,需要注意两点:其一,每研磨一只小鼠,立即把脾细胞悬液从培养皿转入离心管中,注意盖严管盖,切不可敞口放在超净台中。否则,液体挥发,密度与渗透压都会改变,严重影响分离效果。其二,在所有的小鼠脾脏处理完后,统一再加1640覆盖层。如果加早了,两层液体会相互扩散,造成最终离心后的淋巴细胞层下移。 ③推荐使用尼龙网替代不锈钢网筛,以为尼龙网更柔软些 ④使用注射器活塞代替镊子研磨脾脏,由于镊子夹住脾脏的力度不好控制,易造成细胞死亡。
流式细胞分析和混合淋巴细胞反应实验中 小鼠脾脏的摘取 最近老婆要提取脾脏细胞做流式,我就做个简单的解说,也顺便传到网上供菜鸟理解,如果有大神看到这篇文章,也欢迎指导。大家一起讨论,把实验做得更好。 无论是做混合淋巴细胞反应或者流式细胞分析都要用到脾脏。小鼠的脾脏摘取颇为简单,但有很多同学是第一次接触,所以在此做一个简单的图文讲解。在此讲解不甚详细,具体步骤请同学参照网上已有各种protocol,本文重点在于图文解说,让大家对照图片和其他protocol更好的理解脾脏的摘取。 一,小鼠处死后泡酒精2-3分钟,泡久了细胞会缩水,泡的时间短了起不到消毒杀菌的作用 二,摆好小鼠体位,取右侧卧位。 三,沿着小鼠左侧肋骨走行方向做切口。准备眼科镊和眼科剪若干(文中笔者使用眼科直镊3把,眼科剪2把)
四,向小鼠左后背方探查,在皮下很浅的地方可见深红色脾脏。脾脏走行向与肋骨方向近似平行 五,用镊子轻轻提起脾脏。脾脏下会连着许多结缔组织,轻轻把它们撕掉。
六,完整摘下脾脏,放于培养皿中【事先在培养皿中放入PBS (混淋)或红裂(流式)和200目的铁丝网】如下右图所示,银色的为本步骤中使用的铁丝网,白色的为后面要用到的过滤膜
七,一把新的眼科剪和一把新的眼科镊(新消毒过的。本文所用的为新高压的),把脾脏在培养皿里剪成小块。然后用2.5ml或5ml注射器柄,把脾脏研磨成细胞。研磨过程要轻柔,否则会损伤脾脏中的细胞。
八,研磨至培养皿中不见整块脾脏,只剩一些不能磨碎的结缔组织为止。
九,再加入4ml红细胞裂解液,冲洗铁丝网,注射器内芯,并用枪头吹打混匀,裂解5min 十,将液体一并转入15ml离心管中,400g,5min,离心 十一,弃去上清,加入5ml含10%FBS的1640 ,重悬, 用装有200目的尼龙滤膜过滤(可过滤两次); 尼龙滤膜就是第六步中右图的白色滤膜。 十二,滤液离心400g,5min,弃上清,加入1ml含10%FBS的1640,重悬混匀,稀释50(20+980)倍计数,; 至此,脾脏细胞就算提取完成了。后面几步没有上图,但做过实验的同学很容易就能理解是怎么回事啦。
小鼠脾细胞的体外培养及形态观察 黄殿玲,李核,何文琴,李霞,杨佩,王纯 摘要:用组织块法和冷消化法对小鼠脾细胞在含血清培养液中进行原代培养,并对正常细胞形态进行观察。结果表明组织块法和消化法培养可获得比较均一、稳定的细胞群,细胞呈典型的成纤维形态。 关键字:脾细胞原代培养形态 多细胞生物的细胞可以分离出来,在适宜的培养液以及培养箱中存活,并在一定的时间内,保持其形态、生理、生化特性,经过一定时间还可以观察到一定量的细胞。直接从身故体内分离的细胞,如小鼠的脾细胞,在体外培养的过程中尚未发生细胞分裂、增殖的细胞即为原代培养细胞;原代培养细胞在一定条件下可以继续增殖,在数量上大量扩增,此时的细胞为继代培养细胞。 在生物体内或体外,正常的细胞只能分裂一定的次数,然后停止分裂,最终死亡。这一过程称为衰老,此为正常的现象。只有细胞被转化后,细胞可以无限增殖,就称为细胞系/株。细胞培养基要满足细胞的生长需要,包括pH、渗透压、营养和生长因子等,已保证细胞的增殖。细胞培养皿是特殊制造的使细胞可以贴壁。这就要为细胞的培养创造适宜的环境,使细胞更容易存活或生长。细胞培养箱常指二氧化碳培养箱。它可以提供合适的温度和二氧化碳浓度。二氧化碳和培养基中的缓冲系统共同作用,保持细胞培养液的酸碱度。 超净台通过将空气进行过滤,为细胞培养的各种操作提供了一个干净的环境,使细胞培养免于细菌和真菌的污染。在细胞原代培养的操作过程中,这个设备是必要的,细胞本来就比较易感染,不易存活,在空气中,以及人体表面存在许多易感染细菌,所以为了提高细胞的存活率,一定要保持操作过程干净,无污染。细胞培养是细胞生物学研究的中心技术。通过细胞培养可以观察研究细胞的某些生理特性,同时在体外进行细胞培养,也打破了以往的细胞只能在生物体内增殖、分裂。其特点包括:大量实验材料;单一、纯粹细胞类型培养基的成分可控,即生长条件可控/全合成、无血清培养基;易于观察;易于操作。 1 材料与方法 1.1 实验材料 取出生一周的小鼠,采用颈椎脱臼的方法牺牲小鼠。取一只小鼠置于解剖盘中,抓住小鼠的尾巴,确保小鼠的前爪在解剖盘中,慢慢的安抚使小鼠安静下来;用剪刀或手术钳紧紧的按住小鼠的颈的后部,用力向后拉小鼠的尾巴;切记不要
小鼠脾脏单个核细胞的分离 一、实验目的 1.熟悉细胞分离的基本原理 2.掌握小鼠脾脏单个核细胞的分离的方法 3.掌握流式细胞术检测细胞表面标志的方法 二、实验原理 1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。通常认为细胞膜完整性丧失,即可认为细胞已经死亡。 2.脾是人和脊椎动物最大的淋巴器官。人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。 三、实验材料 小鼠 手术器械(剪刀、镊子)、酒精喷壶、杀鼠板 平皿,尼龙膜指套、研磨棒、 吸管、试管、EP管、移液器和tips PBS缓冲液、红细胞裂解液(ACK) 细胞计数板 0.2%台盼蓝染液 8.显微镜 四、实验步骤 (一)取小鼠脾脏 1.小鼠颈椎脱位处死——用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。 2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织。 (二)制备单个核细胞悬液: 1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。用针芯轻轻碾磨使 单个核细胞通过尼龙指套悬浮于平皿中; 2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可冲 洗培养皿)至10mL,以1500rpm离心5min。弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。然后加PBS缓冲液至10ml,以1500rpm离心5min; 3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞悬 液。(放置冰上) 4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释) 5.以1500rpm离心5min,根据计数结果稀释到合适的浓度 a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力 (三)计算细胞浓度 1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。 2.混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞总数; 3.细胞计数:细胞浓度(个/mL)=平均每个大方格中细胞数(4个大方格细胞总数/4)
项目十八B淋巴细胞功能检测 一、溶血空斑试验 (Plaque forming cell assay) 【实验原理】 将SRBC免疫动物,隔一定时间取其脾脏制成细胞悬液,当与SRBC混合孵育时,其中抗体形成细胞释放的抗体会与周围SRBC特异性结合,在补体作用下,使这些致敏的SRBC 溶解,从而在琼脂凝胶中的每个抗体形成细胞周围形成一个肉眼可见的溶血空斑。测定与补体结合力强的IgM形成细胞采用直接方法;测定与补体结合力弱的IgG或IgA形成细胞采用间接法,即实验中需加入抗免疫动物Ig的抗体(二抗),才能促进溶血空斑形成。 此处只介绍小鼠琼脂直接溶血空斑技术。 【试剂和器材】 1.小白鼠体重18~22 g。 2.补体豚鼠混合新鲜血清。 3.SRBC悬液用Gey液将SRBC洗3次,分别配成2.5×108个细胞/ml和5×108个细胞/ml浓度的红细胞悬液。 4.Gey液、琼脂糖。 5.注射器、剪刀、镊子、不锈钢网、小平皿、试管、吸管、显微镜、温箱、水浴箱。 【步骤和方法】 1.免疫小鼠取1ml 2.5×108个细胞/ml 浓度的SRBC悬液注入小鼠腹腔,或取0.2 ml SRBC悬液经小鼠尾静脉注入。 2.制备脾细胞悬液将免疫4天后的小鼠处死,取脾脏制备细胞悬液(制备方法见动物组织中免疫细胞收集),用Gey液配成1×107个细胞/ml的细胞悬液(每只小鼠约加6~10ml Gey 液)。 3.制备底层琼脂将14g/L琼脂糖(用Gey液配制)溶化后取2~3ml倾注于水平的小平皿内,凝固后去盖反扣于37℃温箱中预温备用。 4.制备顶层琼脂将5g/L琼脂糖(用Gey液配制)溶化,置48℃水浴中平衡备用。取脾细胞悬液和5×108个细胞/ml SRBC悬液各0.1ml,再加入未稀释补体0.05ml,混匀,置48℃水浴平衡片刻。加入0.8ml已平衡好的琼脂糖,混匀后倒入底层琼脂上,旋转平皿使之均匀平铺,凝固后置37℃温育3h。计数溶血空斑形成细胞(PFC)。 【结果判定】 1.将平皿置低倍显微镜下观察计数。溶血空斑中心有淋巴细胞,周围为透明区。 2.全脾中PFC数计算: 每个平皿PFC数×10×脾细胞悬液体积(ml) 或以每百万脾细胞所含PFC数来表示。 【注意事项】 1.试验选用Gey液为洗涤液和培养液,优于Hanks液、Eagle液和Dullecco液,但工作液需现用现配。 2.最好选用近交系小鼠,且鼠龄和体重应基本一致。 3.制备脾细胞过程所用Gey液应预先4℃预冷,制好的细胞悬液应及时放4℃备用,以保持脾细胞活力。 4.制备顶层琼脂时,温度应控制在45~48℃之间,温度太高细胞会失活,过低会使琼脂凝固,细胞不能分散,无法倒入平皿。各细胞成分要充分混匀,同时避免出现气泡;与琼
小鼠脾脏细胞原代培养及观察计数 崔文强201300140012 2015.4.7 【实验目的】 1.学习掌握细胞培养的基本原理以及具体方法,并对小鼠脾细胞进行原代培养; 2.掌握无菌操作的具体过程及无菌操作台的使用; 3.学习掌握染色法鉴别细胞的生死状态的原理及方法; 4.学习使用血球计数板对细胞总数及活细胞数进行计数; 【实验原理】 1.细胞培养 细胞培养指的是在无菌条件下,把动、植物细胞从组织中取出,在体外模拟体内的生理环境,使离体的细胞在体外生长和繁殖,并且维持其结构和功能的一种培养技术。动物细胞培养可分为原代培养和传代培养。从供体获得组织细胞,在无菌条件下,用胰蛋白酶消化或机械分散等方法,将动物组织分散成单个细胞开始首次培养长出单层细胞的方法称为细胞的原代培养。当培养的动物细胞生长增殖达到一定密度,形成致密的单层细胞时,用胰蛋白酶将细胞消化分散成单细胞,从一个容器中以1:2或其他比例转移到另一个容器中扩大培养的方法,称为细胞的传代培养。传代培养的累计次数就是细胞的培养代数。 高等生物是由多细胞构成的整体,在整体条件下要研究单个细胞或某一群细胞在体内的功能活动是十分困难的。但如果把活细胞拿到体外培养、增殖并进行观察和研究,则要方便和简单得多。被培养的动物胞是非常好的实验对象和实验研究材料,对体外培养的活细胞进行研究可以帮助人类揭开生、老、病、死的规律,探索优生、抗衰老和防治各种疾病的途径和机制,也可以人为地诱导和改变细胞的遗传性状和特性,使其向有利于人类健康长寿的方向发展。因此动物细胞体外培养技术是研究细胞分子机制非常重要的实验手段,被广泛应用于医学、生物技术、基因工程等研究领域。 细胞培养的意义 具有其他生物技术无可比拟的优点;培养条件易改变和控制,便于单因子分析;便于人们直接对细胞内结构、细胞生长及发育等过程的观察;在生物学的各个领域(如分子生物学、细胞生物学、遗传学、免疫学、肿瘤学及病毒学等)已被广泛应用。 细胞培养的局限性:在脱离机体复杂环境下,细胞培养条件与躯体环境有一定距离;观察到的结果有时难以正确反映机体内的状况;细胞培养得到的产物少。培养细胞的条件有水的质量、无菌环境,最适温度、渗透压、气体条件、最适PH、营养条件和培养基质等。 2.细胞死活鉴定 细胞生死状态的鉴别方法主要是化学染色法和荧光染色法。 活细胞和死亡细胞在生理技能和性质上主要存在一下差异: ①细胞膜通透性的差异:活细胞的细胞膜是一种选择性膜,对细胞起保护和屏障作用,只允许物质选择性地通过;而细胞死后,细胞膜受损,其通透性增加。基于此,发展出了以台盼蓝、伊红、苯胺黑、赤藓红、甲基蓝以及荧光染料碘化丙啶或溴化乙啶等为染料鉴别细胞生死状态的方法,上述染料能使死亡细胞着色,而活细胞不被着色。此外,应用植物质壁分离的性质也可鉴定植物细胞的生死状态。活细胞的原生质具有选择透过性,死细胞因其原生质的选择透过性已遭破坏,故与高渗透压溶液接触时不产生质壁分离。 ②代谢上的差异:活细胞中新陈代谢作用强,细胞内的酶具有较强的活性和还原能力。基于此,发展处了以荧光素二乙酸酯(FDA)、荧光素二丙酸酯、荧光素二丁酸酯或荧光素二苯甲酰酯等酯化的荧光素鉴别细胞生死状态的方法,上述酯化的荧光素亲脂性提高,容易被细胞吸收进入,活细胞内的酯酶具有较强的活性,可将酯化的荧光素分解而释放出能发荧光的荧光素,该物质不能自由透过活的细胞膜,积累在细胞内,荧光显微镜下显示有明亮的绿色
小鼠脾脏细胞原代培养及观察计数 陈素君 200900140007 实验目的:了解原代培养的基本方法及操作过程。学习细胞消化、细胞计数、营养液的配制 及酸碱度的调节。初步掌握无菌操作方法。学会分辨死活细胞,掌握细胞计数。 实验原理:细胞培养是用无菌的方法将动物体内的组织(或器官)取出,模拟动物体内的生理条件,在体内进行培养,使其不断生长、繁殖,人们借以观察细胞生长、繁殖、细胞分化以及细胞衰老等过程的生命现象。 细胞培养的突出优点,一是便于研究各种理化因素对细胞生长发育和分化等的影响,二是细胞培养便于人们对细胞内部结构(如细胞骨架等)、细胞生长及发育过程的观察。因而是探索和显示细胞生命活动规律的一种简便易行的实验技术,但是不可忽略它脱离了生物机体的一些变化。细胞培养分为原代培养和传代培养。原代培养是指直接从动物体内获得的细胞组织和器官,经体外培养后,直到第一次传代为止。这种培养,首先用无菌操作的方法,从动物体内取出所需的组织(或器官),经消化,分散成单个游离的细胞,在人工培养的条件下,使其不断地生长及繁殖。 要细胞能在体外长期生长,必须满足基本要求:一是供给细胞存活所必须的条件,如适量的、无机盐、氨基酸、维生素、葡萄糖及其有关的生长因子、氧气、适宜的温度,注意外环境酸碱度与渗透压的调节。二是严格控制无菌条件。 台盘蓝氧化与还原型颜色不同,活细胞由于新陈代谢产生较强还原力,染色后呈无色,死细胞染色后呈蓝色。细胞计数以显微镜计数法进行,即将少量待测样品悬浊液置于特定的具有确定容积的载玻片上(计菌器),于显微镜下直接观察计数。 细胞浓度(个/ml)=4个中等方格内的细胞总数÷4×10000×稀释倍数。 实验用品: 一、器材 解剖剪、解剖镊、眼科剪、眼科镊、培养皿、纱布块、吸管、橡皮头、烧杯、移液枪、注射器、针头、Eppendorf管。上述器具彻底清洗、消毒、烤干、包装好 倒置相差显微镜、酒精灯、酒精棉球、试管架、解剖板 二、试剂 PBS缓冲溶液、培养液、台盘蓝 三、小白鼠 实验方法: 1. 细胞的原代培养 1.1断头法处死小鼠,将血放掉洗净,在酒精中浸泡3min消毒。 1.2在超净工作台无菌操作,将小鼠背朝下放在解剖板上,用镊子提起腹部皮肤,剪开。沿 开口向两侧斜着剪开,翻起皮肤露出腹腔,即可看到白色的胃。提起胃,找到后面条状的脾,用弯头镊子取出脾,将周围的脂肪组织去除。PBS缓冲液清洗1-2次待用。 1.3在无菌培养皿内加入PBS缓冲液30滴,用L型针头吸取PBS0.2mL注入小鼠脾脏,用针 头在脾脏上戳几个小孔,顺脾脏轻轻刮,从小孔挤出分散的细胞。 1.4将培养皿倾斜,使大块组织充分沉淀,吸取分散的细胞悬液2mL,1000r/min离心5min。
小鼠淋巴细胞分离液说明书 Cat#:DKW33-R0100 本品为深圳达科为生物技术有限公司自主研发的新一代密度梯度分离液。主要成份为Iodixanol ,分子量为1550。它是完全化学惰性、无生物毒性的碘化物,不会结合任何已知的生物功能蛋白、不会干扰任何细胞表面膜蛋白、不会抑制酶活性、不会干扰抗原抗体反应。 EZ-Sep?Mouse 1×小鼠淋巴细胞分离液分离的淋巴细胞的纯度高、状态好、得率高。小鼠脾脏淋巴细胞分离方法操作简单、易学,对实验者的经验要求不高。 本实验室的研究表明,小鼠脾脏淋巴细胞暴露在该分离液中长达1小时,离心分离后,淋巴细胞的数量和质量没有明显变化,随后的ELISPOT 检测结果同其它组完全一致。 产品信息: 商品名:EZ-Sep?Mouse 1×(英文) 易得小鼠淋巴细胞分离液(中文) 规格:100mL/瓶 密 度:1.0810±0.0005g/mL (20oC) 渗透压:280±15mOsm 主要成份:Iodixanol ,化学惰性,无生物毒性 内毒素:≤0.5EU/mL 适用范围:分离小鼠/大鼠脾脏淋巴细胞 分离大鼠/兔子血液中的PBMC 保存方法:4oC 避光保存,保持无菌保质期:12个月 使用方法: 自备材料:35mm 培养皿、10mL 玻璃注射器内活塞、200目尼龙网——裁 成90mm×90mm 正方形(以上材料均为无菌要求)、其他常用器材:离心管,移液管,加样枪,离心机等 实验步骤:1.断颈处死小鼠,浸泡于75%的乙醇中。2.在超净台中取出小鼠脾脏。注意无菌操作。 3.在35mm 培养皿中放入4-5mL EZ-Sep?Mouse 1×淋巴细胞分离液(取用前摇匀)。研磨(研磨操作请参考图二)。 4.把悬有脾脏细胞的分离液立即转移到15mL 离心管中,覆盖200-500uL 的1640培养基(保持液面分界明显)。 5.室温,800g 离心30min 。设置较慢的加速度和减速度,如果有十档,设为第三档。离心结束后细胞分层如图一所示。 6.吸出淋巴细胞层,再加入10mL 1640培养基,颠倒洗涤。室温,250g 离心10min 收集细胞。 7. 倾倒上清液,用无血清培养基或其他培养液重悬细胞,细胞计数。 注意 : 若小鼠饲养时间较长,或者小鼠脾脏异常肿大,导致研磨后细胞悬液呈现暗红色时,须将细胞悬液用小鼠
1.掌握T、B淋巴细胞的主要膜表面分子和作用。 T细胞的膜表面分子及其功能T细胞表面具有许多重要的膜分子, 参与识别抗原 和T 细胞的活化、增殖、分化及功能的发挥并且是T细胞亚群的重要标志。 T细胞表面标志: (一)T细胞表面受体 1.T细胞抗原识别受体--TCR及TCR复合体 所有T细胞表面均具有能结合特异性抗原的膜分子,称T细胞抗原受体(TCR)。TCR功能:是识别和结合抗原肽的作用。 CD3分子:由γ、δ、ε、ζ、η五种肽链组成。 CD3分子的功能:稳定TCR的结构,传递T细胞活化信号。 TCR识别抗原后,刺激信号是通过CD3转导的。 2. 细胞因子受体(cytokine receptor,CKR) CK:主要指由细胞经刺激诱导而合成和分泌的具有高活性多功能的小分子蛋白质。. 白细胞介素(interleukin, IL) . 干扰素(Interferon, IFN) . 集落刺激因子(colony stimulating factor, CSF) . 肿瘤坏死因子(Tumor necrosis factor,TNF) . 生长因子(Growth factor, GF) . 趋化因子(chemokine, cK) 静止T细胞——>活化T细胞——>T细胞增殖、分化 3 .病毒受体 CD4分子是HIV的受体,HIV的gp120与CD4分子高亲和性结合。CD4+的T细胞是HIV 攻击的主要靶细胞 4. 丝裂原受体 可致细胞发生有丝分裂,进而增殖得名,可激活某一类淋巴细胞-------非特异性多克隆激活剂 ConA:刀豆素A PHA:植物血凝素 PWM:美洲商陆 丝裂原与受体交联,可直接使静止T细胞活化、增殖、转化为淋巴母细胞 (二)T细胞表面抗原(surface antigen) 1.MHC抗原:MHC-I(所有),活化后表达MHC-Ⅱ(活化标志) 2.分化抗原(CD分子) (1)辅助分子——CD4和CD8分子 (2)协同(辅助)信号分子——CD28、CD152、CD40L、LFA-1、CD2 T细胞表面CD抗原: T细胞的膜辅助受体-CD4/CD8 功能:辅助TCR识别抗原和参与活化信号转导 CD4+/CD8+T能过表面的TCR-CD3复合体分子与APC表面相应抗原肽-MHC分子复合 物结合,CD4/CD8分子可与MHC分子紧密结合,使T细胞与APC的作用加强,并使胞内区的ITAM和蛋白酪氨酸激酶P56LCK活化,从而产生T细胞活化的第一信号,引发一系列激酶级联反应。 一、B细胞的膜表面分子
CD4+ 和CD8+ T淋巴细胞检测 1 范围 本章规定了用多平台三级程序法和单平台一步法检测全血中的CD4+ 和 CD8+ T淋巴细胞。 2 规范性引用文件 1997 Revised Guidelines for Performing CD4+ T-Cell Determinations in Persons Infected with Human Immunodeficiency Virus (HIV) MMWR 46(RR-2);1-29 Publication date: 01/10/1997。 3 实验室条件 3.1 人员 进行HIV感染者CD4+ 和CD8+ T淋巴细胞检测的人员须具有艾滋病实验室的上岗资格,并接受过省级以上艾滋病实验室安全及实验操作技术培训。 3.2 设施和设备 3.2.1 样品处理区:生物安全柜、离心机、冰箱、水浴箱、旋转振荡器、精确移液器(5μl~50μl、20μl~200μl、200μl~1000μl)。 3.2.2 流式细胞仪检测区:流式细胞仪 3.3 功能分区 实验室原则上应分为样品处理区和流式细胞仪检测区,各区的功能是: 3.3.1 样品处理区应达到生物安全Ⅱ级(BSL-2)实验室要求,用于样品处理、流式检测样品制备。 3.3.2 流式细胞仪检测区用于制备好的样品上机检测。 4 样品采集、运输和接收
4.1 样品的采集 4.1.1 选择合适的抗凝剂,分别用于血液学检测和流式细胞仪的免疫表型检测。 4.1.1.1 用于血液学检测的抗凝剂 (1)EDTA(1.5±0.15mg/ml血液)。 (2)在血球分析仪生产商允许的时间范围内检测,不超过30h,不检测超出抗凝时间范围的样品。 4.1.1.2 用于流式细胞仪免疫表型检测的抗凝剂 (1)用K3EDTA抗凝,收集样品应在30h以内,尽早(8h以内)处理。 (2)用ACD或肝素抗凝,收集样品在48h以内,尽早(8h以内)处理。 4.1.2 静脉采血收集血样,将血液注入一个事先加入适当抗凝剂的试管(用真空试管)。 4.1.2.1 当收集儿童样品时,采用儿童用注射器、小试管。 4.1.2.2 采血后立即握住试管两端,颠倒混匀数次,将血液与抗凝剂混匀,以防止凝固。 4.1.3 准备适当数量的样品管 4.1.3.1 当同一样品的血球检测和流式细胞仪免疫表型检测在不同实验室内进行时,用2个装有K3EDTA的试管即可。 4.1.3.2 在所有其它条件下用2个试管(用K3EDTA作血球检测,用K3 EDTA、ACD或肝素作流式细胞仪免疫表型检测)。 4.1.4 对所有样品编号,并写明日期和收集时间。 4.2 样品运输 4.2.1 在室温下(18~23℃)保存和运输样品,避免极端温度(冷冻或过热)。超过37℃的温度会破坏细胞,对血液学和流式细胞仪的检测有影响。天气热时,需要用一个隔热的容器装样品,并且把这个容器放于另一个有冰袋和吸热物质的容器中。这种方法有助样品的保存。 4.2.2 尽可能快地将样品送至免疫表型检测实验室。