2019最新高中化学 第三章 金属及其化合物 3.1.1 金属的化学性质学案 新人教版必修1
- 格式:doc
- 大小:39.50 KB
- 文档页数:4

1 /2 2019-2020年高中化学 第三章 金属及其化合物 第一节 金属的化学性质讲义 新人教版必修1一、钠1、结构:原子易失电子 → 强还原性2、物理性质:银白、质软、密度小、熔点低3、化学性质:⑴ 钠与氧气(或其它非金属)反应 ① 常温: ② 点燃:③ 与氯气: ④ 与硫:⑵ 钠与水反应 ⑶ 钠与酸反应 ⑷ 钠与盐反应① 钠与硫酸铜溶液反应:② 钠与氯化铁溶液反应:二、 铝1、结构:原子易失电子 → 表现还原性 (金属性弱于钠,表现出两性)2、物理性质:银白(铝粉俗称”银粉”)、质软、熔点较高、易导电3、化学性质:⑴ 与非金属单质反应 ⑵ 与酸反应2Na + Cl 2 ===== 2NaCl 点燃2Na + S===== Na 2S (条件也可以研磨)△思考: 物质燃烧出现火焰的条件?4Na + O 2 ===== 2Na 2O (白色固体)2Na + O 2 ===== Na 2O 2 (淡黄色固体;火焰黄色)点燃2Na + 2H 2O ===== 2NaOH+H 2↑ 思考: 浮、游、熔、 响、旋、红?2Na + 2HCl ===== 2NaCl + H 2↑ 反应速率更快,并伴有爆鸣声,按先酸后水反应,因为酸中氢离子浓度更大。
2Na + 2H 2O + CuSO 4 === Cu(OH)2↓+ Na 2SO 4 + H 2↑6Na + 6H 2O + 2FeCl 3=== 2Fe(OH)3↓+ 6NaCl + 3H 2↑ 先与水反应,生成碱后再与盐溶液反应。
前边写的是合成反应。
而在熔融状态下钠与盐直接发生置换反应。
4Al + 3O 2 ===== 2Al 2O 3 (白色固体)2Al + 3Cl 2 ===== 2AlCl 32Al + 3S ===== Al 2S 3 点燃 △△2Al + 6HCl ===== 2AlCl 3 + 3H 2↑ 2Al + 3H 2SO 4 ===== Al 2(SO 4)3 + 3H 2↑2Al + 2NaOH + 2H 2O === 2NaAlO 2 + 3H 2↑ (还原剂) (介质) (氧化剂)反应原理:2Al + 6H 2O ===== 2Al(OH)3 + 3H 2↑ 2Al(OH)3 + 2NaOH ===== 2NaAlO 2 + 4H 2O 2Al + 2OH - + 2H 2O ==== 2AlO 2-+ 3H 2↑2 / 2⑶ 与强碱反应⑷ 与盐反应⑸ 与金属氧化物反应(铝热反应)三、铁1、物理性质:银白[ 还原铁粉:灰黑色;铁粉:深灰色 ]、熔沸点较高、易磁化2、化学性质:⑴ 与非金属单质反应⑵ 与酸反应 ⑶ 与盐反应 ⑷ 与水反应2Al + 3CuSO 4 === Al 2(SO 4)3 + 3Cu 2Al + Fe 2O 3 ==== Al 2O 3 + 3Fe2Al + WO 3 === Al 2O 3 + WKClO 3点燃△Fe + CuSO 4 === FeSO 4 + Cu (古代湿法冶铜原理)3Fe + 2O 2 ===== Fe 3O 4 (黑色)[ 在氧气中剧烈燃烧 ] 4Fe + 3O 2 ===== 2Fe 2O 3(红棕色)[在空气中缓慢氧化 ]2Fe + 3Cl 2 ===== 2FeCl 3(棕黄色液;棕褐色烟)△ 点燃点燃Fe + 2HCl === FeCl 2 + H 2↑ Fe + H 2SO 4 (稀)=== FeSO 4 + H 2↑Fe (不足)+ 4HNO 3(稀) === Fe(NO 3)3 + NO↑ + 2H 2O 3Fe (过量)+ 8HNO 3(稀)=== 3Fe(NO 3)2 + 2NO↑ + 4H 2O 钝化在常温下浓H 2SO 4、浓HNO 3使铁钝化。


课题:3-1-1 金属的化学性质高一年级化学学科导学案主备人班级姓名一次批阅二次批阅【学习目标】1、了解金属共性---物理性质、化学性质;2、认识钠、铝、主要化学性质。
3、了解金属材料在生产、生活中的应用,增强学好化学的信心。
【重点难点】钠与氧气的反应;铝有抗腐蚀性能的原因。
【知识连接】铝和黄金哪种金属更贵重?你在日常生活中见到了哪些金属物品?他们有些什么样的性质?【自主学习】【思考与交流】解答教材P461、2、一、金属与非金属的反应1、钠与氧气的反应【实验探究3-1】阅读教材P47页(1)通过实验了解了钠的哪些物理性质?金属钠呈色,有光泽;可用刀切割,说明钠;钠的密度比水,比煤油;钠的熔点为,沸点为;具有良好的。
(2)由常温下钠在空气中的变化,说明钠的化学性质活泼。
切开的金属钠表面很快,说明钠很容易与发生化学反应,生成了。
常温下钠与氧气反应的化学方程式。
(3)怎样保存金属钠?【实验探究3-2】(1)用坩埚钳夹持坩埚放在三角架的泥三角上,用小刀切下绿豆粒大小的钠块,用滤纸吸干煤油后放入坩埚中。
(2)点燃酒精灯进行加热。
(3)观察现象并记录留下的固体颜色。
实验现象。
结论:钠与氧气在加热的条件下反应生了,化学方程式为。
提示:①切下的钠块不易太大,剩余的钠块放回原试剂瓶。
②钠块开始燃烧时,立即撤掉酒精灯。
【问题讨论】(1)通过钠与氧气的反应,说明钠的金属活泼性怎样?(2)过氧化钠中含有氧化钠,可采用什么方法除去?2、铝与氧气的反应【科学探究】1、用坩埚钳夹住一小块铝箔,在酒精灯上加热并轻轻晃动,观察到的现象是。
2、重新取一块铝箔,用砂纸打磨,除去其表面的氧化膜,加热,观察到的现象是。
【问题讨论】1、未打磨和已打磨的铝箔加热时,现象是否相同?解释其中的原因。
2、金属是否都能形成氧化膜?不同的金属其氧化膜有无差异?3、铝的氧化膜对铝的用途有什么影响?(阅读49页资料卡片)【拓展延伸】钠、铝等金属除了能被氧气氧化外,还能被氯气、硫等具有氧化性的物质氧化,生成相应的氯化物和硫化物,写出反应的化学方程式。
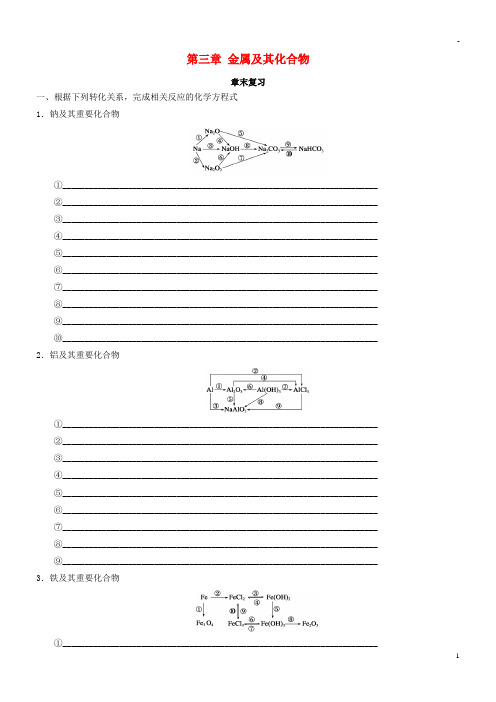
第三章金属及其化合物章末复习一、根据下列转化关系,完成相关反应的化学方程式1.钠及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________⑩________________________________________________________________________ 2.铝及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________ 3.铁及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________⑩________________________________________________________________________ 二、相关物质的鉴别和检验1.Na2CO3和NaHCO3的鉴别(1)固体粉末:________(2)溶液:加入________或________溶液2.Al3+的检验向溶液中滴加过量的________溶液,根据现象鉴别。
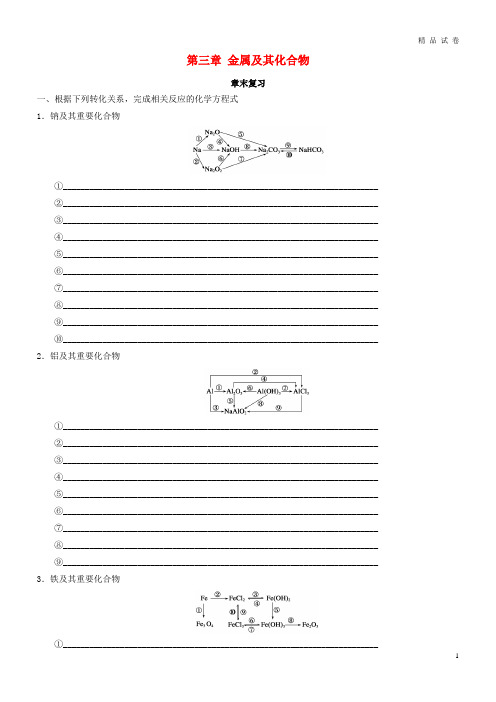
第三章金属及其化合物章末复习一、根据下列转化关系,完成相关反应的化学方程式1.钠及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________⑩________________________________________________________________________ 2.铝及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________ 3.铁及其重要化合物①________________________________________________________________________②________________________________________________________________________③________________________________________________________________________④________________________________________________________________________⑤________________________________________________________________________⑥________________________________________________________________________⑦________________________________________________________________________⑧________________________________________________________________________⑨________________________________________________________________________⑩________________________________________________________________________ 二、相关物质的鉴别和检验1.Na2CO3和NaHCO3的鉴别(1)固体粉末:________(2)溶液:加入________或________溶液2.Al3+的检验向溶液中滴加过量的________溶液,根据现象鉴别。

教学设计第一节金属的化学性质(第一课时)一.教学设计思路1.设计理念本节课紧承上一次课的金属性质,深入分析金属与氧气,水的反应。
这一部分是对学生原有知识的一个提高和深化。
整节课的重点目标是让学生体验探究过程,设计教学时,考虑到让学生的思维层层递进,设计了一些逐步深入的问题,引导学生从问题中逐步理解金属与水的反应,这样有利于培养学生发现问题、分析问题、解决问题的能力,形成良好的科学探究品质。
2.教材分析从内容上看:“金属的化学性质”是人教版高一化学新教材“第三章金属的化学性质”第一节的内容,是学习元素化合物知识的起始节。
元素化合物知识是中学化学重要的基础知识,也是学生今后在工作、生活中经常要接触,需要了解和应用的基本知识。
通过这些知识的学习,既可以为前面两章所学的实验和理论知识补充感性认识的材料;又可以为在化学必修2中学习物质结构、元素周期律、化学反应与能量等理论知识打下重要的基础。
本节作为学习元素化合物知识的起始节,以学生在初中学过的有关金属的性质及金属的活动性顺序为基础,选取典型的金属如钠、铝、铁等进一步学习拓展金属的性质,而在本节学习中所用到的许多方法如观察法、实验法、比较法、归纳法等也是学习元素化合物知识的重要方法,所以学好本节内容可为后继元素化合物知识的学习奠定坚实的方法论基础。
元素化合物知识是中学化学的基础知识,具有承前启后的作用。
本章的知识内容可分为单质、化合物和金属材料三大块。
为了使学生对金属及其化合物有一个整体的了解,在内容的编排上对钠、铝、铁、铜的知识采用横向对比的方法,突出了个别物质的特性反应,帮助学生逐步掌握学习化学的基本方法,如实验法、观察法、科学探究法等。
从知识体系来看:它由金属与非金属的反应、金属与酸和水的反应、铝与氢氧化钠溶液的反应、物质的量在化学方程式中的应用组成。
学生对金属化学性质的掌握主要通过实验、图片、探究、讨论等途径获得,通过对比,钠、铝、铁等金属的性质实验,但可以使学生了解典型金属的性质,而且对学生学习其他化学元素及化合物性质形成正确的观点,掌握正确的学习方法起到重要的作用。
精品试卷3.3 用途广泛的金属材料①课型设置:新授课;学习目标:了解合金的概念以及性质特点,了解常见的合金的主要组成和性能。
初步认识合理使用金属材料的意义,学会正确选用金属材料。
学习重点:合金的概念和性质学习难点:合金的概念和性质学习内容(包括学法指导)一、常见合金的重要应用1、合金的概念:合金是有两种或两种以上的_________(或___________________________)熔合而成的具有__________特性的物质。
不同的合金具有不同的性能,主要表现在机械强度、韧性、强度、可塑性、制腐蚀性等方面。
改变原料的配比或改变生成合金的条件,可以得到不同性能的合金。
2、特性:合金的熔点一般比各成分金属要。
(填“高”或“低”);硬度一般比成分金属要。
3、常见的合金(1)铜合金铜合金主要有___________(主要成分为铜、锡、铅)、____________(含锌及少量锡、铅、铝等)及_____________(含镍、锌及少量锰)。
(2)钢钢是用量_________、用途_________的铁合金。
根据化学成分,钢可以分为两大类:____________和____________。
其中碳素钢可以分成____________、____________、_____________。
二、正确选择金属材料1、在进行金属材料选择时,常常要考虑:用途、外观、物理性质(密度、硬度、强度、导电性)、化学性质(对水的作用、耐腐蚀性)、价格等方面。
2、稀土元素是镧系元素系稀土类元素群的总称。
包括原子序数57-71(从镧到镥,称为镧系元素)的15种元素以及钪和钇,共17种元素。
稀土元素能与其他元素组成品种繁多、功能千变万化,用途各异的新型材料。
如在合金中加入适量稀土金属就会大大改善合金的性能,被称为“冶金工业的__________”;稀土元素可以制造引火合金、永磁材料、超导材料和纳米材料等。
课堂反馈1、利用铝合金制作钥匙是利用铝合金的( )A.熔点低 B.不易腐蚀 C.硬度大 D.密度大2、所谓合金就是不同金属(也包括一些非金属)在融化状态下形成一种融合物,其中不能形成合金的是( )A.Cu与Na B.Fe与Cu C.Cu与Al D.Al与Na3、(1)将Fe、Cu、FeCl3溶液、CuCl2溶液混合并充分反应,可能发生的反应有(离子方程式)___________________________________________________________________________________________________________________________________________;(2)将Fe、Zn、FeCl3溶液混合并充分反应,可能发生的反应有(离子方程式)___________________________________________________________________________________________________________________________________________;4、向Fe2 (SO4) 3溶液中加入ag铜,充分反应后再加入bg铁,充分反应后,得到固体cg(a>c)。
【2019最新】高中化学第三章金属及其化合物第1节金属的化学性质第2课时课时作业新人教版必修1(1)一、选择题1.(2016·枣庄高一检测)在一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来的温度,下列叙述合理的是( B )A.NaOH溶液浓度增大,并放出H2B.溶液中NaOH的质量分数不变,有H2放出C.总溶液的质量增大,有H2放出D.总溶液的质量不变,有H2放出解析:钠投入溶液后,立即与水作用生成NaOH和H2,由于原溶液为饱和溶液,因此NaOH结晶析出后溶液仍然是饱和溶液,质量分数不变,且消耗部分原溶剂水及对应析出部分NaOH晶体,故溶液总质量减小。
2.能正确表示下列反应的离子方程式的是( D )A.钠与氢氧化钠溶液反应:Na+2H2O===Na++2OH-+H2↑B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+C.钠与盐酸反应:Na+2H+===Na++H2↑D.钠与氯化钾溶液反应:2Na+2H2O===2Na++2OH-+H2↑解析:A中钠与氢氧化钠溶液反应的实质是2Na+2H2O===H2↑+2Na++2OH-。
B中钠与CuSO4溶液反应的实质是钠与水反应生成的氢氧化钠再与CuSO4反应,总方程式:2Na+2H2O+CuSO4===Cu(OH)2↓+H2↑+Na2SO4。
C中电荷不守恒。
3.(2016·临沂高一检测)钠作为一种重要金属,为国防工业上有重要用途的金属。
关于钠的说法不正确的是( B )A.银白色金属B.密度比水大C.能与水剧烈反应D.可保存于煤油中4.除去镁粉中的少量铝粉时,可选用的溶液是( D )A.盐酸B.硫酸镁C.稀硫酸D.氢氧化钠溶液5.(2016·广州高一检测)铁与水蒸气反应的实验装置如图,下列说法正确的是( B )A.实验时,试管口应高于试管底B.加热时试管内生成黑色物质,点燃肥皂泡可听到爆鸣声C.反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2D.试管中发生化合反应6.下列有关铁的说法正确的是( C )A.铁与水不反应B.铁与沸水反应C.铁与水蒸气在高温下反应D.铁与盐酸反应生成氯化铁7.下列反应的离子方程式书写正确的是( C )A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO+H2↑C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H2↑D.铁跟稀硫酸反应:Fe+2H+===Fe3++H2↑8.(2016·惠州高一检测)将一定量的金属钠投入下列溶液中,充分反应后,最终不可能有沉淀的是( B )A.硫酸铜溶液B.盐酸C.氯化铁溶液D.氯化铝溶液9.等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( B )A.1﹕1 B.3﹕4C.2﹕3 D.4﹕310.(2016·渭南高一检测)将一定量的镁铝合金样品分成两等份,一份加入足量稀盐酸中,充分反应后,收集到标准状况下气体11.2 L;另一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72 L。
1
金属的化学性质
【学习目标】
1、通过回忆初中学的镁、铝、铁、铜的部分性质,梳理金属单质的物理通性
和化学共性。
2、掌握钠的物理性质和钠、铝与非金属(O2)的反应。
【预习导学】
1、钠与氧气的反应
探究内容 〔实验3-1〕取一小块金属钠,用小刀切去一端的外皮,观察实验现象。 〔实验3-2〕把一小块金属钠放在
坩埚上,加热,有何现象发生?
现象 新切开的钠具有_______色金属光泽,在空气中很快________ 钠先________,然后剧烈燃烧,火焰
呈_______色,生成________固体。
2、铝与氧气的反应
实验步骤 实验现象 现象解释 化学方程式
用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动 _____________ _____________ _____________ _____________ 铝表面的氧化铝保护了铝,即使打磨过的铝箔,在空气中也会很快生成氧化膜。 铝表面生成的氧化膜Al2O3的熔点__________铝的熔点,包在铝的外面,所以熔化的铝并不滴落。
_____________
_____________
再取一小块铝
箔,用砂纸打磨,除
去表面的氧化膜,再
加热至熔化
【知识讲解】
一、金属元素在自然界中的存在
金属元素占总元素的4/5,地壳中含量最多的金属是Al:7.73%第二位Fe:4.75%。
大多数金属以化合态存在。
二、金属的物理性质
一般具有金属光泽,能导电导热, 具有延展性。
三、钠与氧气的反应
实验3-1:取一小块金属钠,用刀切去一端的外皮,观察钠表面的光泽和颜色。
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
结论:
1、钠的物理性质:银白色 金属光泽 固体 质软(硬度小),熔点低
2、钠的化学性质很活泼 ,常温下能与氧气反应.
2
22
4Na+O=2NaO
思考:钠应怎样保存?
保存在煤油或石蜡中,以隔绝空气。
实验3-2:把一小块金属钠放在坩埚上,加热,有何现象发生?
现象:观察到钠先熔化后燃烧,燃烧时火焰呈黄色,生成淡黄色的固体
222
Δ
=2Na+ONaO
四、铝与氧气的反应
科学探究1:加热铝箔
现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
原因: 因为铝表面有一层氧化膜保护了铝。构有膜的氧化铝(Al2O3)的熔点很高,没有
熔化,包在外面使熔化的液态铝不会滴落下来。
科学探究2:用砂纸打磨铝箔,除去氧化膜后,再加热至熔化
现象:铝箔熔化,失去光泽,熔化的铝仍然不滴落
原因:铝很活泼,除去原来的氧化膜后,在空气中很快生有一层新的氧化膜
结论:铝很活泼,常温下能与空气中的氧气反应,生成一层致密的氧化膜,起保护的作
用。
223
4Al+3O=2AlO
思考:为什么铝制品不易生锈?
原因:活泼的金属在空气中易与氧气反应,生有一层氧化物。有的氧化膜疏松,不能保
护内层金属,如铁和钠等。有的氧化物致密,可以保护内层金属不被继续氧化,如铝等。
【例题】
1、下列金属难与氧气反应的是( )
A、Na B、Mg C、Al D、Au
2.下列关于金属的叙述中正确的是( )
A.所有的金属常温下都是固态
B.金属具有导电性、导热性和延展性
C.金属都能与酸反应
D.金属元素在自然界中都是以化合态存在的
3、取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
3
①金属钠先熔化;
②钠燃烧时生成氧化钠;
③燃烧后得白色固体;
④燃烧时火焰为黄色;
⑤燃烧后生成浅黄色固体物质。
A.①② B.①②③ C.①④⑤ D.④⑤
4.关于金属的说法中 正确的是( )
A.钠是银白色的金属,硬度很大
B.将金属钠放在石棉网用酒精灯加热,金属钠燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
5.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反
应的本质不改变的是( )
A.Na和O
2
B.NaOH和CO2
C.Na和Cl2
D.木炭(C)和O2
6.下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是( )
A.NaOH B.Na2O C. Na2O2 D.MgO
7.下列关于铝的叙述中,不正确的是(D)
A.铝属于活泼金属
B.在常温下,铝能与氧气反应
C.铝是地壳中含量最多的金属元素
D.加热铝箔,有液态铝滴落
8.铝在空气中能够稳定存在的原因是( )
A.铝的活泼性差
B.铝的还原性差
C.铝与氧气不反应
D.铝表面有氧化膜
4
参考答案
【预习导学】
1、银白色;变暗;熔化;黄色;淡黄色
2、铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着;
铝箔熔化,失去光泽,熔化的铝仍然不滴落
高于;
223
4Al+3O=2AlO
【例题】
1.D
2.B
3.C
4.B
5.C
6.C
7.D
8.D