第三章第一节金属的化学性质 铁的化合物
- 格式:doc
- 大小:23.50 KB
- 文档页数:2


高中化学必修一(第三章)知识点全归纳第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞是液体外,其他在常温下是固体。
(2)金属的颜色、光泽绝大多数金属都是银白色,具有金属光泽,少数金属是特殊颜色如铜是紫红色,金是金黄色。
(3)良好的导电、导热性。
(4)延展性延性:拉成细丝的性质。
展性:压成薄片的性质。
2.化学通性有哪些?(1)化合态金属元素只有正化合价(2)金属单质易失电子,表现还原性(3)易与氧气反应,得到氧化物(4)活动性排在氢前的金属元素与酸反应得到盐和氢气(5)与盐反应,置换出活动性弱的金属单质3.金属钠的性质有哪些?(1)物理性质有哪些?钠银白色、质软、熔点低、密度比水的小但比煤油的大。
★(2)化学性质有哪些?①很活泼,常温下:4Na + O2=2Na2O★(新切开的钠放在空气中容易变暗)②加热条件下:2Na+O2 Na2O2★(先熔化成小球,后燃烧产生黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
③钠与水的反应与H2O反应2Na+2H2O=2NaOH+H2↑★离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
知识拓展:a:将钠放入硫酸铜溶液中,能否置换出铜单质?不能,2Na + 2H2O = 2NaOH + H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应b:将钠放入盐酸中,钠将先和H2O反应,还是先和HCl反应?2Na+2HCl=2NaCl+H2↑钠与酸反应时,如酸过量则钠只与酸反应,如酸不足量则钠先与酸反应再与水反应。

第三章金属及其化合物第一节金属的化学性质一、钠及其化合物(一)钠Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
2、单质钠的化学性质:①钠与O2反应常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
②钠与H2O反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
③钠与盐溶液反应如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④钠与酸反应:2Na+2HCl=2NaCl+H2↑(反应剧烈)离子方程式:2Na+2H+=2Na++H2↑3、钠的存在:以化合态存在。
4、钠的保存:保存在煤油或石蜡中。
5、工业制钠:电解熔融的NaCl :2NaCl(熔融) 2Na + Cl 2↑6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;② 钠钾合金是快中子反应堆的热交换剂;③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。


《铁和铁的化合物》教案设计湖北省襄阳市第一中学方向东1 本节教材背景本节教材是人教版化学必修1第三章第一节《金属的化学性质》和第二节《几种重要的金属化合物》中铁和铁的化合物的整合,在此之前,我们已经学习了钠、镁、铝等典型的金属元素和物质结构的有关知识。
2 教学对象现状分析(1)学生在学习《碱金属》和《镁铝》时已初步掌握了主族金属元素的性质,但对过渡元素还很陌生,对次外层电子未达饱和的金属元素的性质缺乏了解。
(2)经过两个多月的高中学习,加之是重点中学的学生,素质较高,有学好化学的愿意,愿意动手实验,并能在老师的指导下,在课堂上较好地完成一些实验操作,并具备一案的实验观察能力和实验现象分析能力,但知识迁移能力、发散思维、科学的学习方法方面仍有待于进一步培养和提高。
3 教学目的(1)使学生掌握铁和铁的重要化合物的性质。
(2)通过学习和实验、培养学生动手能力及观察分析问题的能力,同时对学生进行环境保护教育。
(3)培养学生学会由表象分析事物的本质、变化,综合运用已学知识,解决问题的能力。
(4)通过新旧知识联系,培养学习知识迁移、扩展能力,进一步激发学生的兴趣和求知欲望。
4 教学重点、难点Fe的还原性、Fe与稀HNO3、水蒸气的反应。
5 教法设计:实验探究法。
6 教学策略(1)铁具有金属的通性并且是比较活泼的金属,主要是通过分析铁的原子结构、对比钠、镁、铝的原子结构,使学生把主族元素的知识迁移到过渡元素,新旧知识的联系,能够使学生较好地掌握新知识。
(2)对于铁的次外层也有价电子和主族元素的不同,设计并安排有针对性、启发性的实验,引导学生从观察实验现象入手,启发学生分析产生现象的因果关系和本质联系,总结出铁有变价的结论,从而使学生了解学习和研究化学问题的一般方法和思维过程,提高学生的学习能力。
①使学生能够运用从结构决定性质这一思维方式,从理性上探索事物变化的本我要吃肉方面,发现事物变化的规律,强化学生综合分析问题的能力。
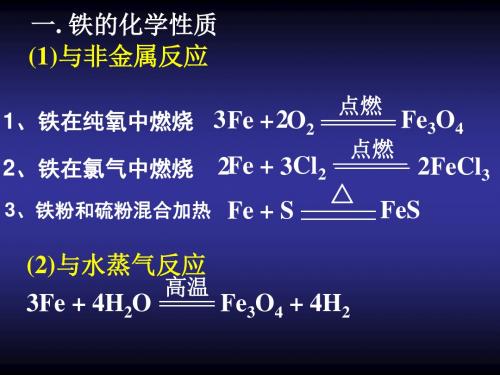
第三章第一节铁及其化合物知识点铁简介:广泛应用的金属元素铁是一种过渡金属,在元素周期表中位于第8组。
其原子序数为26,原子质量约为55.85。
铁在地壳中含量丰富,是仅次于铝的第二大常见金属元素。
铁的物理性质铁是一种具有银白色光泽的金属,质地坚硬且具有延展性。
它的熔点为1538摄氏度,沸点为2862摄氏度。
铁在常温下与空气中的氧气反应,形成一层保护性的氧化物层,称为铁锈。
铁的化学性质铁是一种相对活泼的金属,能与多种非金属反应。
它具有以下重要的化学性质:与酸反应:铁与酸(如盐酸和硫酸)反应,生成铁盐和氢气。
与氧气反应:铁在空气中容易氧化,形成铁锈(三氧化二铁)。
与水反应:铁在潮湿环境中与水缓慢反应,生成氢氧化铁。
与卤素反应:铁能与卤素(如氯气和氟气)反应,生成相应的卤化铁。
铁的化合物:氧化物、氢氧化物和盐铁形成一系列化合物,包括氧化物、氢氧化物和盐。
其中最常见的化合物包括:氧化铁:三氧化二铁(Fe2O3)是一种红褐色粉末,常见于铁锈中;四氧化三铁(Fe3O4)是一种黑色晶体,用于制造磁铁。
氢氧化铁:氢氧化铁(Fe(OH)3)是一种棕色胶状物,在水中不溶。
铁盐:氯化铁(FeCl3)是一种棕色固体,可用于制造染料和净水剂;硫酸铁(FeSO4)是一种绿色晶体,用作还原剂。
铁在工业和生物中的重要性铁是一种用途广泛的金属,在工业和生物系统中至关重要:工业应用:铁用于制造钢铁、汽车、建筑材料、机械和电气设备。
生物作用:铁是血红蛋白和肌红蛋白等血红素蛋白的组成部分,这些蛋白负责血液中氧气和肌肉中的氧气的运输。
铁缺乏症和过量铁缺乏会导致贫血,其症状包括疲劳、苍白和呼吸短促。
铁过量也可能是有害的,称为血色病,其症状包括肝损伤和皮肤变色。
保持健康的铁水平对于整体健康至关重要。
铁的回收利用铁是一种可回收利用的金属,回收利用铁制品可以减少环境污染和保护自然资源。
铁制品可以通过磁性分离和熔炼等方法进行回收利用。
第三章第二节金属的化学性质铁的重要化合物三、铁的重要化合物
(一)铁的氧化物
化学式FeO Fe2O3
俗名无铁红磁性氧化铁色、态黑色固体红棕色固体黑色固体
铁的价态+2 +3 为,为
水溶性不溶不溶不溶
稳定性不稳定,在空气
里加热迅速被氧化
稳定稳定
与非氧化性酸反应FeO+2HCl===FeCl2
+H2O Fe2O3+6HCl===2FeCl3+
3 H2O
Fe3O4 +8HCl === FeCl2
+2 FeCl3 + 4 H2O
与氧化性酸反应
共性高温时,都能被等还原剂还原,铁元素被还原成单质
(二)铁的氢氧化物
Fe(OH)2Fe(OH)3物理性质白色固体,难溶于水红褐色固体,难溶于水物质类别二元弱碱多元弱碱
稳定性稳定性差,分解产物复杂稳定性差,受热易分解
与非氧化性酸反应
与氧化性性酸反应
与反应
制备
(三)Fe3+、Fe2+ 的检验
1、Fe3+的检验方法:
(1)颜色:棕黄色;
(2)滴加NaOH溶液,若产生红褐色沉淀,说明有Fe3+存在;
(3)滴加KSCN溶液,若溶液由棕黄色变为红色,说明有Fe3+存在
2、Fe2+ 的检验
(1)颜色:浅绿色;
(2)滴加NaOH溶液,若有白色沉淀生成一会儿变成灰绿色,最后变成红褐色沉淀,说明有Fe2+存在;
(3)滴加KSCN溶液,若溶液无变化,再加入新制大氯水,溶液立即变为红色,说明有Fe2+存在
(四)铁的其它反应方程式:
Fe3+与Fe2+ 的转化:
第三章第三节用途广泛的金属材料
一、
金属材料包括纯金属和合金
合金:定义:由两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质叫合金。
特点:熔点低(低于成份)
硬度大(高于成份)
二、常见合金:
铁合金生铁白口铁
灰口铁
钢合金钢:在碳素钢中适量地加入一种或几种其他元素而制成大具有特殊性
能的钢。
如锰钢不锈钢(铬镍)
碳素钢:低碳钢
中碳钢
高碳钢
铜合金青铜(铜锡)最早使用
黄铜(铜锌)
白铜(铜镍)。