牛奶中体细胞数及检测
- 格式:ppt
- 大小:9.00 MB
- 文档页数:36


目录一、引言 (2)二、我国生乳标准的变化以及与其他国家的差距 (2)2.1生乳中菌落数指标 (2)2.2生乳中蛋白指标 (3)2.3生乳中体细胞数指标 (4)三、我国奶业标准现状 (4)四、生乳标准变化背后我国奶业标准存在的问题 (5)4.1奶业标准结构不合理 (5)4.2我国奶制品质量标准与国际标准还有较大差距 (5)4.3现行标准重奶制品,轻生产过程 (5)4.4 相当一部分标准陈旧,不能适应现阶段需要 (6)4.5 标准被少数大企业控制 (6)4.6 行业协会组织结构不明确,政府缺少监管 (7)五、标准背后奶业标准利益人的博弈 (7)5.1 企业与企业之间的博弈简述 (7)5.2 政府和企业之间的静态博弈模型 (8)5.2.1 模型假设 (8)5.2.2 模型分析 (9)六、促进我国奶业标准改进的对策建议 (9)6.1政府方面 (9)6.1.1建立国家级奶业质量安全管理机构 (9)6.1.2参照国际标准,制定出我国的奶业质量标准体系 (10)6.1.3加快对奶业生产环节标准的制定与修订,规范企业行为 (10)6.1.4建立和完善奶制品检验检测体系 (10)6.2 企业自身方面——借鉴国外经验 (11)6.3 消费者方面 (12)七、结语 (12)参考文献 (13)附录 (14)从《生乳》标准变化看中国奶业标准摘要:随着国民经济的快速发展,人民对生活质量的要求不断提高,对奶产品的需求越来越大。
然而近年来由于奶业标准混乱所导致的问题比比皆是,进而引发了人们的持续关注。
为此本文主要以生乳标准变化引出对中国奶业标准现状的分析,提出奶业标准存在的问题并运用博弈论模型分析奶业标准涉及的各方利益较量,最后针对奶业标准改进给出意见建议。
关键字:奶业标准、博弈模型、奶业发展一、引言日前,在牛奶行业举办的内部研讨会上,广州市奶业协会理事长王丁棉直斥中国牛奶标准“全球最差”,“是世界乳业之耻”!自三聚氰胺事件之后,奶业标准混乱之弊屡被提及,中国牛奶消费信心至今未愈。

奶牛血清中维生素A和维生素E含量的测定及其与牛乳中体细胞数的相关性董淑慧;王加启;李发弟;彭华;张养东;赵海燕【摘要】利用高效液相色谱法测定奶牛血清中维生素A和维生素E的含量,并探讨其与牛乳中体细胞数的相关性.结果表明:奶牛血清中维生素A的加标回收率为93.8%~106.4%,维生素E的加标回收率为91.5%~105.3%,RSD分别为4.7%和4.4%,该方法简单快速准确可靠,可用于奶牛血清样品中维生素A和维生素E含量的测定.维生素E浓度在泌乳第4~8周与体细胞数呈弱负相关性(R=-0.25,P=0.037),在泌乳第10~14周为中等程度负相关(R=-0.41,P=0.037);维生素A与体细胞数不存在相关性.【期刊名称】《甘肃农业大学学报》【年(卷),期】2013(048)001【总页数】7页(P19-25)【关键词】奶牛;血清;维生素A;维生素E;体细胞数;相关性【作者】董淑慧;王加启;李发弟;彭华;张养东;赵海燕【作者单位】中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193【正文语种】中文【中图分类】S823.9+1维生素A和维生素E是动物机体维持正常代谢和机能的脂溶性维生素.维生素A具有保护上皮组织的完整性,维持细胞及细胞器膜结构的完整及正常的通透性,以形成阻止外源病原微生物入侵的屏障,可以增强和提高机体的免疫力.维生素E是存在于动物细胞膜上的一类抗氧化剂,可以缓解不饱和脂肪酸的氧化[1].监测奶牛血液中维生素A和维生素E的含量可以了解其免疫机能及氧化应激状态.维生素E 可以减少奶牛乳腺炎的发生率[2]、提高繁殖性能[3]和产奶量[4].目前,采用高效液相色谱法(HPLC)测定维生素A和维生素E的方法主要有2种:皂化-HPLC法和萃取-HPLC分流法.前者的前处理较复杂,而且测定结果不能反应维生素形态组分的生物活性;后者的前处理简单,能直接测定维生素的不同形态组分,虽然设备要求较高,但因其快速、准确,已在人类医学检查中广泛应用[5-6].Chew等[7]和Smith等[8]发现奶牛血液中维生素 A和维生素E与乳房炎均存在相关性,但Jukola等[9]发现血中维生素A与乳中体细胞数(SCC)存在相关性,但维生素E与SCC不存在相关性.在泌乳牛日粮中添加维生素A和维生E对乳房炎的影响的研究结果也不一致,一些研究发现在奶牛日粮中添加维生素A或维生素E可以减少乳房炎的发生[2,10],但 Persson等[11]和Whiteman等[12]发现泌乳牛日粮中添加维生素A和维生素E对乳中SCC无影响.本研究拟通过建立奶牛血清中维生素A和维生素E含量的HPLC测定方法,探讨维生素A和E与泌乳初期奶牛乳中SCC的关系,以期为生产中通过日粮中添加维生素A或维生素E控制奶牛乳房炎的发生提供理论依据.1 材料与方法1.1 试验动物在北京奶牛中心良种场选择33头经产荷斯坦奶牛,其产犊日期分布在2010年3月9日至2010年5月3日.试验开始前所有牛在产房饲喂干奶期日粮,产犊后大约14d,转入拴系式牛圈,饲喂泌乳牛日粮.每天投喂3次(7∶00,14∶00和21∶00时)TMR日粮,投料量为期望采食量的110%,并根据前几天的采食量进行调整,每次拴系饲喂2.5~3h.记录投料量和剩料量计算干物质采食量.1.2 样品采集1.2.1 血样采集试验牛于产犊后4、6、8、10、12和14周晨饲后1h从奶牛尾静脉采集血液,装入含有EDTA的采血管中,2 000 g离心20min,吸取上清液即血浆分装至600μL离心管中,-20℃冻存.1.2.2 奶样采集试验牛在采血前1d收集奶样,当天挤奶3次,按早∶中∶晚=4∶3∶3比例采集奶样50mL,加入重铬酸钾进行防腐处理,4℃冷藏保存.1.3 仪器与试剂高效液相色谱仪(Water 600)、高速台式低温离心机、氮吹仪、涡旋振荡器、电子天平、维生素A对照品(Retinol – synthetic,R7632,Sigma)、维生素E 对照品(DL-all-rac-α-Tocopherol、T3251、Sigma);甲醇、无水乙醇和正己烷均为色谱纯,过滤膜(2.2μm).1.4 色谱条件色谱柱为Atlantis C18,粒度5μm,250mm×4.6mm(i.D3);流动相为甲醇;流动相流速为1.0mL/min;柱温为室温进样量为10μL;检测波长为325nm (维生素A)和292nm(维生素E).1.5 溶液的配制1.5.1 维生素A储备液配制精确称取维生素A对照品10mg(纯度95%),加无水乙醇定容至10mL,配成维生素A储备液(1g/L).1.5.2 维生素E储备液的配制精确称取维生素E对照品40mg(纯度96%),加无水乙醇定容至10 mL,配成维生素E储备液(4g/L).1.5.3 维生素A、维生素E混合标准溶液的配制取维生素A储备液250μL,维生素E储备液400μL,用无水乙醇定容到10mL,配制成维生素A浓度为25mg/L,维生素E浓度为160mg/L的混合标准溶液.1.5.4 维生素A、维生素E混合标准应用液的配制精确吸取250μL的维生素A储备液用无水乙醇定容到10mL,稀释成25mg/L的工作液;精确吸取100μL维生素E储备液用无水乙醇稀释成40mg/L的工作液;吸取维生素A工作液250μL、维生素E工作液1mL定容到10mL,稀释为维生素A浓度为0.40mg/L、维生素E浓度为4mg/L的混合标准应用液.1.6 血清样品处理取400μL血浆,放入2mL离心管中,加入400μL无水乙醇,涡旋振荡2min,加入800μL正己烷,涡旋振荡2min,以12 000 g离心10min,取上层正己烷层至另一离心管中,残渣中再加入800μL正己烷,涡旋2min,10 000 g离心10min,用移液枪缓慢吸取上层全部正己烷,合并2次上清液,氮气吹干,加入1 500μL甲醇溶解,涡旋1min,经0.22μm的微孔滤膜过滤后,取10μL进样,整个过程要求避光.1.7 测定方法1.7.1 标准曲线的绘制精确加入维生素A、维生素E的储备液于10mL容量瓶中,用乙醇定容,使得维生素 A 的浓度分别为0、0.2、0.4、0.6、0.8、1.0mg/L,维生素 E 的浓度分别为0、2、4、6、8、10mg/L,将容量瓶中的标准工作液注入液相色谱仪中,得到峰面积,并以峰面积为纵坐标,以维生素A、维生素E标准工作液浓度为横坐标绘制标准曲线.1.7.2 加样回收率及重复性试验方法取同一血清2份各400μL,其中一份添加维生素A、维生素E混合标准溶液10μL,使得添加的维生素A在血清中的浓度为0.40mg/L,维生素E浓度为4mg/L,另一份不添加,操作方法同1.6,进样10μL,进行色谱分析,求得相应的浓度后,计算加标回收率.重复性试验:取同一血清5份,每份400μL,操作方法同1.6,进样10μL,进行色谱分析,求得相应浓度后计算浓度间相对偏差.1.7.3 空白对照取400μL超纯水,操作方法同1.6.1.8 牛奶中体细胞数的测定将奶样送至北京奶牛中心乳品质量监督检验测试中心测定体细胞数(SCC),并将SCC转化为体细胞得分(SCS),SCS=lg102(SCC/100 000)+3[13]. 1.9 数据处理血液维生素A和维生素E含量与牛奶中体细胞数之间的相关性利用SAS软件中Pearson相关系数进行分析.相关系数0.8~1.0为极强相关,0.6~0.8为强相关,0.4~0.6为中等程度相关,0.2~0.4为弱相关,0.0~0.2为极弱相关或无相关.高体细胞数及低体细胞数奶牛血液中的维生素E含量用SAS 9.0软件包中的GLM程序进行方差分析.2 结果与分析2.1 维生素A和维生素E的标准曲线以浓度(x)对样品的峰面积(y)进行回归,求得回归方程.维生素A标准曲线为y=32 743x+66.238,线性范围:0~1.0mg/L,R2=0.999 7(图1);维生素E标准曲线y=1 743.7x-135.14,线性范围:0~10.0mg/L,R2=0.999 4(图2).图1 维生素A标准曲线Fig.1 Standard curve of vitamin A图2 维生素E标准曲线Fig.2 Standard curve of vitamin E2.2 维生素A和维生素E的色谱图由图3~5可以看出,在本试验色谱条件下,维生素A和维生素E的保留时间分别为8.2min和4.5min,表明该试验所建立的样品处理方法和HPLC分析色谱条件能快速准确的测定荷斯坦奶牛血液中维生素A、维生素E的含量.此外,在本试验样本处理及色谱条件下,维生素A、维生素E和杂质能较好的分离,杂质对结果的测定干扰较小.图3 维生素A和维生素E的标准色谱图Fig.3 Chomatogram map of vitamin A and vitamin E in standard samples图4 血液样品中维生素A和维生素E的色谱图Fig.4 Chomatogram map of vitamin A and vitamin E in blood samples图5 样品的加标色谱图Fig.5 Chomatogram map of samples added standard sample of vitamin A and vitamin E2.3 加标回收率以维生素加标样品的色谱峰响应值减去维生素样品的响应值的差值与对应同浓度的维生素A、维生素E对照品溶液的响应值的比值计算提取回收率.维生素A加标回收率为93.8%~106.4%,维生素E加标回收率91.5%~105.3%;维生素A、维生素E平均回收率为102.44%、100.14%,RSD 分别为4.7%和4.4%,RSD<5%,试验结果表明用维生素A、维生素E标准品作外标定量,结果准确可靠. 2.4 重复性和精密度试验结果取同一血清5份,萃取维生素A、E,RSD分别为0.5%和1.2%,试验结果表明,该方法具有较好的重复性.取同一血清,萃取维生素 A、维生素E,以1mg/L和4mg/L维生素A、维生素E混合标准溶液,重复进样5次,相对标准偏差为1.8%(<2%),试验结果表明,该方法具有较好精密度,即重现性良好.2.5 奶牛血清中维生素A、维生素E的测定结果在所测得的142份血清中,维生素A的浓度为0.11~1.65mg/L,平均为0.49mg/L;维生素E的浓度为0.75~11.4mg/L,平均为3.70mg/L.试验结果表明,不同个体间或牛在不同泌乳周期血液中的维生素含量变化较大.2.6 奶牛血液中维生素A、维生素E浓度与牛乳中体细胞数的相关性牛奶中体细胞数低的奶牛其血清中维生素E浓度与高体细胞数奶牛血清中维生素E 浓度差异不显著,但体细胞数低的奶牛其血清中维生素E平均浓度与高体细胞数奶牛血清中维生素E平均浓度相比有升高的趋势,但泌乳第12周有相反的结果(表1).在不同的泌乳周期血液中的维生素E含量也存在差异,在泌乳第8周和第12周血液中的维生素E含量显著高于泌乳第10周和第14周(P=0.028).由表2可以看出,奶牛血液中维生素E浓度在泌乳第4~8周与体细胞数呈弱负相关性(r=-0.25,P=0.025);在泌乳第10~14周为中等程度负相关(r=-0.41,P=0.037),且在第10~18周体细胞数高时与维生素E浓度相关性更强;奶牛血液中维生素A浓度与体细胞数不存在相关性,但是在泌乳第10~18周高体细胞数奶牛其血清维生素A与体细胞数呈弱负相关(r=-0.36).3 讨论不同的样品前处理方法和分析色谱条件都会影响测定结果的准确度[14].而本试验所建立的样品处理方法和HPLC分析色谱条件取得了较好的加标回收率,样品中维生素A、维生素E保留时间分别为8.2min和4.5min,且重复性、精密度良好,表明该方法快速、准确,具有重现性好和回收率高的特点.表1 不同泌乳周期奶牛血样维生素E含量Tab.1 Serum vitamin E concentrations of cows of different lactation periodSCS值≥4界定为高体细胞数,SCS值<4界定为低体细胞数;同列数据肩标不同小写字母表示差异显著(P<0.05).?表2 不同泌乳周期维生素A、维生素E浓度与体细胞数间相关系数Tab.2 Correlation coefficient of serum vitamin A,vitamin E concentration and SCCof different lactation dairy cows?生育酚主要有8种,按甲基位置分为α、β、γ和δ-生育酚,其中α-生育酚是奶牛体内最主要的生物活性形式,存在于血液和牛奶中,其中以α-生育酚的活性最强,且动物血液中90%以上都是α-生育酚,它也是饲料中维生素E的最主要存在形式[15].本试验通过高效液相色谱测定的是α-生育酚(标准品为α-tocopherol).很多学者通过不同方法研究泌乳奶牛血清中维生素E浓度范围,Smith等[16]用4.0μg/mL来界定血清中维生素E浓度是否处于合适水平,Weiss等[17]认为3.0~3.5μg/mL是正常奶牛血清中维生素 E 浓度的最低水平,Radostits等[18]将2.0 μg/mL定义为血清维生素E浓度临界水平,低于此将会出现缺乏症,血清维生素E浓度低于1.0~1.5μg/mL时对奶牛健康有害[15].在本试验中,血清维生素E浓度超过3μg/mL的试验牛仅为55.0%,低于2.0μg/mL的试验牛为20.0%.反刍动物体内不能合成α-生育酚,必须依赖于饲料中补给,不同牧场奶牛血液中维生素E浓度差异与其所采食的饲粮类型有关,维生素E浓度随日粮中青贮料所占比例的变化而变化[19],新鲜的青草其维生素E含量丰富,但会随着储藏时间的延长而显著降低[11].奶牛需要额外补充的维生素E根据需求量的不同而不同,但也与牛场的管理系统、产奶量和传染病有关[20].关于提高血液中维生素E浓度可以抵抗乳腺炎和提高奶牛的生殖功能是有争议的[18],一些研究者得出提高血液中的维生素E浓度可减少乳腺炎的发生频率[8,21-22],且维生素 E 的摄入量与临床型乳房炎的发生速率呈负相关的结论,LeBlanc等[23]研究得出奶牛日粮中补充维生素E能降低临床型乳房炎的发病率,并缩短临床症状持续时间.但是也有一些研究者并未得出维生素E与乳腺炎间的关系[24-26].Atroshi等[27]在对 20头健康奶牛和 21头患有乳腺炎的奶牛进行对比研究后发现,患有乳腺炎的奶牛其SCC显著升高(P<0.01),血清中维生素E浓度比健康奶牛低(P<0.05).当奶牛SCC高于283 000个/mL则表明患有乳腺炎[28-29],奶牛临床乳房炎阀值为600 000个/mL[30],Weiss等[17]研究得出奶牛血清中维生素E浓度与SCC间不存在相关性,而本试验得出血液中的维生素E浓度与牛奶中体细胞数呈负相关,也就表明血液中维生素浓度越低,患乳腺炎的几率也就越大.Braun等[21]发现高SCC奶牛血液中维生素E浓度与低SCC奶牛血液中维生素E浓度间没有差异,而本试验虽然得出低体细胞数奶牛血液中维生素E浓度高于高体细胞数奶牛,但是差异不显著.在分娩前后,维生素A有抵御乳腺炎等疾病的功能.摄入足够量的维生素A可以保证上皮细胞的正常功能,因此可以提高乳腺对疾病的抵御能力[7].LeBlanc等[22]研究得出分娩前后1周,奶牛血清中维生素A增加100ng/mL,则奶牛在泌乳早期患乳腺炎的几率就会减少60%.Jukola等[31]研究发现维生素A与SCC弱相关(r=0.22),本试验得出维生素A与体细胞数不存在相关性(r<0.2),与Erskine等[32],Oldham 等[4]的结论一致.参考文献[1]Bendich A.Antioxidant,immune response,and animal function [J].J Dairy Sci,1993,76:2789-2794[2]Chew B P,Johnston L A.Effects of supplemental vitamin A andβ-carotene on mastitis in dairy cows[J].J Dairy Sci,1985,68(Suppl 1):191[3]Lotthammer K.Importance ofβ-carotene for the fertility of dairy cattle[J].Feedstuffs,1979,51:34-36[4]Oldham E R,Eberhart R J,Muller L D.Effects of supplemental vitamin A orβ-carotene during the dry period and early lactation on udder health[J].J Dairy Sci,1991,74(11):3775-3781[5]李静娜,朱其明,肖永华,等.反相高效液相色谱法测定人血清中维生素E含量[J].中国卫生检验杂志,2008,18(2):259-260[6]刁娟娟,田兰,孙炜,等.高效液相色谱法测定人血清中维生素 A、E、C含量[J].化学通报,2010(9):826-831[7]Chew B P,Hollen L L,Hillers J K,et al.Relationship between vitamin A andβ-carotene in blood plasma and milk and mastitis in Holsteins [J].J Dairy Sci,1981,65(11):2111-2118[8]Smith K L,Harrison J H,Hancock D D,et al.Effect of vitamin E and selenium supplementation on incidence of clinical mastitis and duration of clinical symptoms[J].J Dairy Sci,1984,67(6):1293-1300[9]Jukola E,Hakkarainen J,Saloniemi H,et al.Blood selenium,vitamin E,vitamin A,and beta-carotene concentrations and udder health,fertility treatments,and fertility[J].J Dairy Sci,1996,79(5):838-845[10]Weiss W P,Hogan J S,Todhunter D A,et al.Effect of vitamin E supplementation in diets with a low concentration of selenium on mammary gland health of dairy cows[J].J Dairy Sci,1997,80(8):1728-1737[11]Persson W K,Hallen S C,Emanuelson U,et al.Supplementation of RRR-alpha-tocopheryl acetate to periparturient dairy cows in commercial herds with high mastitis incidence[J].J Dairy Sci,2007,90(8):3640-3646[12]Whiteman D H,Tomkins N W,Young R J,et al.Mastitis in beef cows and the effects of supplemental-carotene on milk parameters [J].Anim Prod Sci,2010,50(6):503-507[13]Shook G E.Approaches to summarizing somatic cell count which improve interpretability[C].Proceedings 21st Annual Meeting of the National Mastitis Council,Arlington VA,USA,1982:150-166[14]常海军,王强,周文斌,等.高效液相色谱法测定白牦牛乳B族维生素的方法研究[J].甘肃农业大学学报,2011,46(2):119-123[15]Pehrson B,Hakkarainen J.Vitamin E status of healthy Swedish cattle [J].Acta Vet Scand,1986,27(3):351-360[16]Smith K L,Hogan J S,Conrad H R,et al.Selenium in dairy cattle:its role in disease resistance[J].Vet Med,1988,83(1):72-78 [17]Weiss W P,Hogan J S,Smith K L,et al.Relationship among selenium,vitamin E and mammary gland health in commercial dairy herds [J].J Dairy Sci,1990,73(2):381-390[18]Radostits O M,Gay C C,Blood D C,et al.Veterinary Medicine [M].9th ed.London:W B Saunders,2000,1515-1533[19]Sivertsen G,vernes O,steras O,et al.Plasma vitamin E and blood selenium concentrations in Norwegian dairy cows:regional differences and relations to feeding and health[J].Acta Vet Scand,2005,46(4):177-191[20]Allison R D,Laven R A.Effect of vitamin E supplementation on the health and fertility of dairy cows:A review[J].Vet Rec,2000,147:703-708[21]Braun U R,Forrer W F,Lutz H.Selenium and vitamin E in blood sera of cows from farms with increased incidence of disease[J].Vet Rec,1991,128:543-547[22]Malbe M,Klaassen M,Fang W,et parisons of selenite and selenium yeast feed supplements on Seincorporation,mastitis and leukocyte function in Sedeficient dairy cows[J].J Vet Med,1995,42,111-121[23]LeBlanc S J,Herdt T H,Seymour W M,et al.Factors associatedwith peripartum serum concentrations of vitamin E,retinol,andβ-carotene in Holstein dairy cattle,and their associations with disease[J].J Dairy Sci,2004,87(3):609-619[24]Ropstad E,Φvernes G,Refsdal A,et al.Selenium levels in Norwegian dairy herds related to reproductive and health performance [J].Acta Agric Scand,1987,37:397-405[25]Ndiweni N,Field T R,Williams M R,et al.Studies on the incidence of clinical mastitis and blood levels of vitamin E and selenium in dairy herds in England[J].Vet Rec,1991,129:86-88[26]Batra T R,Hidiroglou M,Smith M W,et al.Effect of vitamin E on incidence of mastitis in dairy cattle[J].Canad J Anim Sci,1992,72(2):287-297[27]Atroshi F,Tyopponen J,Sankari S,et al.Possible roles of vitamin E and glutathione metabolism in bovine mastitis[J].Int J Vitamin Nutr Res,1987,57(1):37-43[28]Guidry A J.Mastitis and the immune system of the mammary gland [M].The Iowa State University Press,Ames,IA.1985:229-262[29]Reneau J K.Effective use of dairy herd improvement somatic cell counts in mastitis control[J].J Dairy Sci,1986,69(6):1708-1720[30]Dohoo I R,Meek A H.Somatic cell counts in bovine milk[J].Can Vet J,1982,23(4):119-125[31]Jukola E,Hakkarainen J,Saloniemi H,et al.Blood selenium,vitamin E,vitamin A,andβ-carotene concentrations and udder health,fertility treatments,and fertility[J].J Dairy Sci,1996,79(5):838-845[32]Erskine R J,Eberhart R J,Grasso P J,et al.Induction of Eschericia coli mastitis in cows fed selenium-deficient or selenium-supplemented diets[J].J Dairy Sci,1989,50(12):2093-2100。


目录一、引言 (2)二、我国生乳标准的变化以及与其他国家的差距 (2)2.1生乳中菌落数指标 (2)2.2生乳中蛋白指标 (3)2.3生乳中体细胞数指标 (4)三、我国奶业标准现状 (4)四、生乳标准变化背后我国奶业标准存在的问题 (5)4.1奶业标准结构不合理 (5)4.2我国奶制品质量标准与国际标准还有较大差距 (5)4.3现行标准重奶制品,轻生产过程 (5)4.4 相当一部分标准陈旧,不能适应现阶段需要 (6)4.5 标准被少数大企业控制 (6)4.6 行业协会组织结构不明确,政府缺少监管 (7)五、标准背后奶业标准利益人的博弈 (7)5.1 企业与企业之间的博弈简述 (7)5.2 政府和企业之间的静态博弈模型 (8)5.2.1 模型假设 (8)5.2.2 模型分析 (9)六、促进我国奶业标准改进的对策建议 (9)6.1政府方面 (9)6.1.1建立国家级奶业质量安全管理机构 (9)6.1.2参照国际标准,制定出我国的奶业质量标准体系 (10)6.1.3加快对奶业生产环节标准的制定与修订,规范企业行为 (10)6.1.4建立和完善奶制品检验检测体系 (10)6.2 企业自身方面——借鉴国外经验 (11)6.3 消费者方面 (12)七、结语 (12)参考文献 (13)附录 (14)从《生乳》标准变化看中国奶业标准摘要:随着国民经济的快速发展,人民对生活质量的要求不断提高,对奶产品的需求越来越大。
然而近年来由于奶业标准混乱所导致的问题比比皆是,进而引发了人们的持续关注。
为此本文主要以生乳标准变化引出对中国奶业标准现状的分析,提出奶业标准存在的问题并运用博弈论模型分析奶业标准涉及的各方利益较量,最后针对奶业标准改进给出意见建议。
关键字:奶业标准、博弈模型、奶业发展一、引言日前,在牛奶行业举办的内部研讨会上,广州市奶业协会理事长王丁棉直斥中国牛奶标准“全球最差”,“是世界乳业之耻”!自三聚氰胺事件之后,奶业标准混乱之弊屡被提及,中国牛奶消费信心至今未愈。

奶牛的乳腺炎和牛奶中体细胞数的关系
乳腺炎和隐性乳腺炎对患牛的奶产量和质量有极大影响。
可引发乳腺炎的病原菌有百余种,但90%~95%由金黄色葡萄球菌、无乳链球菌、停乳链球菌和大肠杆菌等感染引起。
隐性乳腺炎对牛奶成分的影响为:乳糖比原成分降低5%~20%,酪蛋白降低6%~18%,乳脂和总固体分别降低5%~12%和3%~12%,钙、磷、钾含量也降低,奶中乳清蛋白增加约占总蛋白量的 1.4%,免疫球蛋白、脂酶等含量有所增高,牛奶的热稳定性下降。
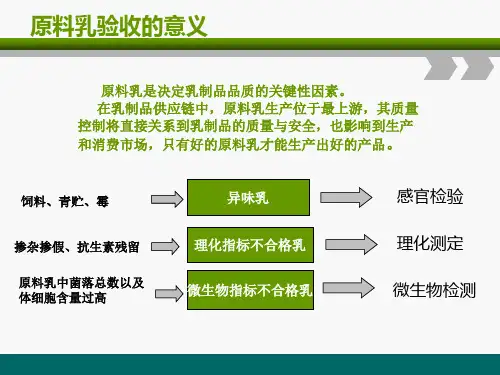
牛奶中的体细胞主要来自血液的白细胞(旧称白血球),小部分为乳腺组织的脱落上皮细胞,后者约占总细胞数的0~7%(也有人报道可多达25%)。
当乳腺组织受细菌感染时,通过机体的免疫系统,白细胞在此处积聚,该乳区分泌的乳汁中,体细胞数随即增多,奶中的体细胞可用专门的体细胞荧光显微自动测定仪迅速测定,目前公认该技术正确性甚高,已被广泛应用。
我们可以根据牛奶中的体细胞数(Somatic Cell Count,简写SCC)来判断乳腺被细菌感染的程度,它可直接反映牛群乳房的健康度,亦可反映损失多少奶量及牛奶质量的好坏。
当今美国的牛奶质量以总乳样体细胞数(大贮缸奶体细胞数bulktandsomaticcellcount,简写BTSCC)为衡量指标,近年来美国、法国、德国、瑞典、荷兰和英国等国在此领域内展开了许多研究。

朱仙玉(山西,太原,华诚睿光(中国)生物科技有限公司)乳房炎是病原性细菌穿过乳头,侵害乳腺引起的炎症。
乳房炎可分为临床性乳房炎和隐性房炎,临床性乳房炎致使乳房红肿、疼痛发热、奶量聚减,挤出絮状奶,牛也会出现发烧、拒食等症状;隐性乳房炎没有临床症状,但奶量降低,它对牛群的危害甚至超过临床性乳房炎,因为它不易引起人们的注意而暗中为害,多数奶牛饲养者天天与它打交道,但仍没有完全认识到其重要性。
据统计,97%的乳房炎属于隐性乳房炎,并能在一定条件下转发为临床性乳房炎。
1. 乳房炎控制目标1.1 奶缸体细胞数≤20万/ml,一胎母牛(产犊时)小于10万/ml,全部母牛85%以上小于20万/ml,全部母牛95%以上小于50万/ml。
1.2 临床乳房炎发病率≤3%;隐形乳房乳房炎感染率≤17%;每年因乳房炎死淘率≤3%。
2 .乳房炎常规检测方法2.1 如果牧场里没有完善的乳房炎记录,也不进行乳房炎检测,就没有可靠的数据来分析牛群的乳房炎感染程度,也就不能解决好乳房炎问题。
2.2 乳房炎的检测方法:2.2.1 挤奶前头3把奶检查2.2.2 牛奶体细胞计数(SCC法)2.2.3 加利福尼亚乳房炎测定法(CMT)2.2.4 实验室细菌培养。
(略)3 .挤奶前头3把奶检查3. 1 把每个乳区的牛奶挤到奶样杯内或挤到挤奶厅地面上检查。
3. 2这种方法只是检查临床乳房炎。
临床乳房炎奶特点是:牛奶颜色不正常,有可见的凝块或絮片,乳房出现红肿热疼。
3. 3发现临床乳房炎立即隔离处理。
注意卫生问题。
4 牛奶体细胞计数4.1 检测体细胞的作用:用于检测牛群隐形乳房炎的感染率和估计每头奶牛感染的严重程度和经济损失4.2 体细胞计数与产奶量的关系4.2.1 每毫升体细胞超过5万时,线性评分每增加一个单位每日产奶量就损失0.68千克。
或每个分值使体细胞计数增加一倍。
例如,体细胞计数每毫升从20万增加到40万,产奶量每头日损失就从1.36千克增加到2.04千克。


浅谈如何降低牛奶中的体细胞数2011-06-01 访问量:1873田焕章宁夏银川合欣奶牛场场长[ 字号:大中小]宁夏银川合欣奶牛场场长养牛感悟我们对待奶牛应该要像对待自己的女朋友一样温柔、体贴,呵护她们,她们也会全身心地为我们付出。
属相兔籍贯山东牛龄7年业余爱好旅游最大心愿牛健康,我快乐。
工作中最有成就感的事情高产在牛场最喜欢做的事情给员工上课、培训牛场基本情况存栏量450头泌乳牛180头平均单产9.5吨乳脂肪率3.9% 牛场技术伙伴乳蛋白率3.3% 挤奶机利拉伐体细胞数<10万/ml 冻精美国ABS CRI 蒙牛塞科星奶牛乳房炎是世界公认的难题,对奶牛业造成巨大的经济损失,防治乳房炎受到各国的普遍重视,目前,乳房炎的防治很多都是在体细胞数上作文章,鲜奶收购标准也将体细胞数列入,很多乳品企业将它作为鲜奶定价的指标之一,目前多数地方均将合格鲜奶体细胞数定为50万/ml以下。
本文主要分析体细胞数在临床的影响,并制定应对措施,以提醒奶牛养殖者引起重视。
一、体细胞定义及影响因素体细胞是指吞噬细胞、淋巴细胞、脱落上皮细胞、中性白细胞等细胞总称。
导致奶牛体细胞数(SCC)升高的因素包括:细菌感染、环境卫生、应激、气候、遗传、胎次等,其中主要是细菌感染。
二、牛奶中高体细胞数引起的损失1.据统计,奶样里所含体细胞数与奶量损失成正相关,如果牛群中牛奶体细胞数超过40万的牛只占总数的70%以上,则可推算出全群泌乳牛平均每头损失奶量在500千克以上。
2.降低鲜奶质量。
由于奶中含有大量的体细胞,可使鲜奶受到一定程度的污染,从而影响乳品的质量和风味。
3.增加牛群更替成本。
由于乳房炎引起产奶量降低,饲养变得不合算而不得不淘汰(因为产奶量越高的牛越容易感染乳房炎),还有其他损失,如废弃牛奶、药费、额外的劳动力、遗传潜力的丢失等等。
三、奶牛体细胞检测的优点1. 监测奶牛的亚临床乳腺炎。
2. 评估牧场亚临床乳腺炎状况。
3. 报告管理信息(如淘汰)。
生产性能测定流程主要包括牧场的初期工作和实验室分析以及数据处理三部分。
(一)样本采集1、测定牛群要求参加生产性能测定的牛场,应具有一定生产规模,最好采用机械挤奶,并配有流量计或带搅拌和计量功能的采样装置。
生产性能测定采样前必须搅拌,因为乳脂比重较小,一般分布在牛奶的上层,不经过搅拌采集的奶样会导致测出的乳成分偏高或偏低,最终导致生产性能测定报告不准确。
2、测定奶牛条件测定奶牛应是产后一周以后的泌乳牛。
牛场、小区或农户应具备完好的牛只标识(牛籍图和耳号)、系谱和繁殖记录,并保存有牛只的出生日期、父号、母号、外祖父号、外祖母号、近期分娩日期和留犊情况(若留养的还需填写犊牛号,性别,初生重)等信息,在测定前需随样品同时送达测定中心。
牛只编号规则详见附录1。
3、采样对每头泌乳牛一年测定10次,测试奶牛为产后一周这一阶段的泌乳牛,因为奶牛基本上一年一胎,连续泌乳10个月,最后两个月是干奶期。
每头牛每个泌乳月测定一次,两次测定间隔一般为26-33天。
每次测定需对所有泌乳牛逐头取奶样,每头牛的采样量为50mL,一天三次挤奶一般按4:3:3(早:中:晚)比例取样,两次挤奶按早、晚按6:4的比例取样。
测试中心配有专用取样瓶,瓶上有三次取样刻度标记,具体采样操作规范见附录2。
4、样品保存与运输为防止奶样腐败变质,在每份样品中需加入重酪酸钾0.03g,在15℃的条件下可保持4天,在2℃~7℃冷藏条件下可保持一周。
采样结束后,样品应尽快安全送达测定实验室,运输途中需尽量保持低温,不能过度摇晃。
(二)样本测定1、测定设备实验室应配备乳成分测试仪、体细胞计数仪、恒温水浴箱、保鲜柜、采样瓶、样品架等仪器设备。
2、测定原理实验室依据红外原理作乳成份分析(乳脂率、乳蛋白率),体细胞数是将奶样细胞核染色后,通过电子自动计数器测定得到结果。
生产性能测定实验室在接收样品时,应检查采样记录表和各类资料表格是否齐全、样品有无损坏、采样记录表编号与样品箱(筐)是否一致。
奶⽜体细胞⽜奶中的体细胞有两个来源。
⼀是来⾃乳腺分泌组织中的上⽪细胞(也称腺细胞);⼆是来⾃与炎症进⾏搏⽃时⽽死亡的⽩⾎细胞。
腺细胞是正常的体细胞,是乳腺进⾏新陈代谢过程的产物,在奶中的含量相对恒定。
⽽⽩细胞是⼀种防卫细胞,可以杀灭感染乳腺的病菌,还可以修复损伤的组织。
因此⽩细胞在⽜奶中的数量随奶⽜的⽣理状态和健康⽔平有很⼤变化。
⼀、⽜奶中体细胞上升的原因1 、由于乳腺被细菌感染出现乳房炎⽽使体细胞数量上升。
⽜奶中正常的体细胞为 20 万 /ml (标准)。
但初产母⽜和管理良好的⽜群可能低于 10 万 /ml 。
如果体细胞数超过 25 ~ 30 万个 /ml ,就接近不正常,说明有细菌传染,引起乳房炎。
引起乳房炎的细菌有两⼤类:传染性的细菌和环境中的细菌。
2 、⽜的年龄及泌乳状态体细胞数随着⽜的胎次(年龄)及泌乳阶段⽽上升。
这是母⽜⾃然免疫系统在分娩之前所表现出的⼀种免疫反应,其⽬的是为了提⾼乳腺的防御机能。
到了分娩以后,如果乳腺未遭病菌感染,则⽜奶中的体细胞数量会很快下降。
3 、应激和季节⾼温和⾼湿条件下所引起的热应激,⼀般多出现在 7 、 8 ⽉份,也可能引起⽜奶中的体细胞数的上升。
母⽜表现发情症状时也有伴随体细胞上升的趋势,但报道不太⼀致。
4 、乳房创伤在没有传染源的情况下,乳房内部创伤(如挤奶机负压过⼤,空吸时间过长或乳房被压伤等)也可以导致⽜奶中体细胞数量增加。
但当创伤愈合后,体细胞⼜可恢复正常。
5 、其它原因包括挤奶设备的完好及⼯作状况,如脉动频率、真空负压⼤⼩及稳定性、集乳器的通透性,橡⽪奶衬的完好及柔软性等都可以影响⽜奶体细胞的数量。
此外,挤奶过程的卫⽣状况,乳头的护理及乳头的封闭影响着细菌进⼊乳头的机会,同时也影响着⽜奶中体细胞的数量。
⼆、体细胞数制约着⽜奶的产量及质量1 、对⽜奶产量的影响当⽜奶中的体细胞数量超过 30 万 /ml 时,⽇产奶量开始下降。
上升幅度越⼤,产量下降幅度也越⼤。
利用DHI报告提高兽医工作效率奶牛生产性能测定(DHI)的指标,主要有日产奶量、乳脂率、乳蛋白率、乳糖率、全乳固体和体细胞数。
这些指标的变化可实时监控奶牛个体生产性能表现,所以利用DHI 报告可以及早发现奶牛病变,大大提高兽医工作效率。
一、据日产奶量发现病变1、高峰日延后奶牛机体任何部分发生病变或生理不适或应激,都会首先以减少产奶量的形式表现出来。
高峰日是指产后高峰奶量出现的那一天。
若每月测定一次,其峰值应出现在第二个测定日,即应低于平均值70天;若高峰日延后,预示干奶牛管理或泌乳前期管理有问题,或预示着奶牛将或正感染疾病。
若大于70天,要检查下列情况:产犊时膘情、干奶牛日粮、产犊管理、干奶牛日粮向产奶牛日粮过渡的时间、泌乳早期日粮是否合理等。
针对高峰日特别延后的牛只,要详细排查原因,看是否有病变。
2、头胎牛高峰奶量与成年牛高峰奶量的比值过小平均头胎牛高峰奶量的比值应处于0.75-0.79之间。
若比值小于0.75,表明头胎泌乳牛前期营养不良,潜力没有得到充分发挥。
针对比值过小的牛只,要详细排查原因,看是否营养不良或有病变。
3、高峰期过后,每月下降过快高峰期过后,泌乳牛平均正常逐日降低0.07kg/天(每月下降小于2.1kg为正常)。
如果月度下降超过5kg以上,请详细排查原因,看是否有病变。
4、高峰奶过后,持续力低持续力=本次奶量/前次奶量×100%(简易公式)头胎牛的持续力要好于经产牛。
泌乳持续力低,表明目前日粮营养可能没有满足奶牛产奶需要,或者乳房受感染、挤奶程序、挤奶设备等其他方面存在问题。
二、据体细胞数发现病变奶牛群体混合奶的体细胞(SCC)是反应传染性病原菌(如无乳链球菌、金黄色葡萄球菌)感染的一个间接判定指标。
对于奶牛场来讲,测定个体牛奶体细胞数,是判断乳房炎轻重的重要手段。
奶牛乳房炎的平均发病率高达40%-65%,其中临床型乳房炎的平均发病率为2%-3%,隐性乳房炎的平均发病率为38%-62%,在有的牛场甚至可达到80%以上。