第七章 过渡金属碳环配体配合物
- 格式:ppt
- 大小:436.50 KB
- 文档页数:21




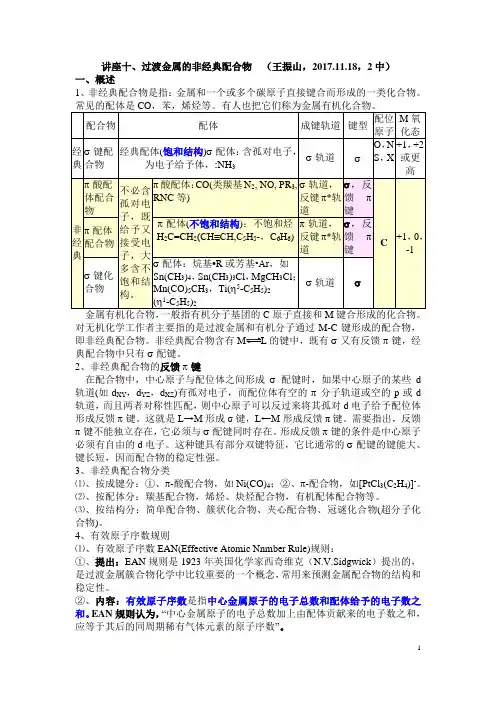
讲座十、过渡金属的非经典配合物(王振山,2017.11.18,2中)一、概述1、非经典配合物是指:金属和一个或多个碳原子直接键合而形成的一类化合物。
常见的配体是CO,苯,烯烃等。
有人也把它们称为金属有机化合物。
学工作者主要指的是过渡金属和有机分子通过M-C键形成的配合物,即非经典配合物。
非经典配合物含有L的键中,既有σ又有反馈π键,经典配合物中只有σ配键。
2、非经典配合物的反馈π键在配合物中,中心原子与配位体之间形成σ配键时,如果中心原子的某些d轨道(如d XY,d YZ,d XZ)有孤对电子,而配位体有空的π分子轨道或空的p或d轨道,而且两者对称性匹配,则中心原子可以反过来将其孤对d电子给予配位体形成反馈π键。
这就是L→M形成σ键,L←M形成反馈π键。
需要指出,反馈π键不能独立存在,它必须与σ配键同时存在。
形成反馈π键的条件是中心原子必须有自由的d电子。
这种键具有部分双键特征,它比通常的σ配键的键能大、键长短,因而配合物的稳定性强。
3、非经典配合物分类⑴、按成键分:①、π-酸配合物,如Ni(CO)4;②、π-配合物,如[PtCl3(C2H4)]-。
⑵、按配体分:羰基配合物,烯烃、炔烃配合物,有机配体配合物等。
⑶、按结构分:简单配合物、簇状化合物、夹心配合物、冠谜化合物(超分子化合物)。
4、有效原子序数规则⑴、有效原子序数EAN(Effective Atomic Nnmber Rule)规则:①、提出:EAN规则是1923年英国化学家西奇维克(N.V.Sidgwick)提出的,是过渡金属簇合物化学中比较重要的一个概念,常用来预测金属配合物的结构和稳定性。
②、内容:有效原子序数是指中心金属原子的电子总数和配体给予的电子数之和。
EAN规则认为,“中心金属原子的电子总数加上由配体贡献来的电子数之和,应等于其后的同周期稀有气体元素的原子序数”。
EAN规则的另一种说法是18电子规则18-electron rule,“每个中心金属原子的价电子数加上由配体贡献来的电子数之和应等于18”,所以EAN规则又称18电子规则。

第七章 配位化合物第一节 配合物的组成及命名一、配合物的组成 1、配合物配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。
如:[]+23)(NH Ag 、[]+243)(NH Cu 、[]-36)(CN Fe 、[]-46)(CN Fe配合物:含配离子的化合物。
如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。
2、配合物的组成配合物结构较复杂,但一般都有一个成分作为配合物的核心,其它部分围绕这一核心有规则地排列。
(1)中心离子(配合物的形成体):位于配合物中心的离子或原子。
多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。
少数为高氧化数非金属原子,如:[]-26SiF 、[]-6PF 。
个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。
(2)配位体★含义:与中心原子结合的分子或离子。
多为含孤对电子的分子或离子。
如3NH 、O H 2、-Cl 、-CN 、-SCN 等。
★分类:根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配体。
单齿配体:一个配位体只含一个配位原子。
多齿配体:一个配位体只含两个或两个以上的配位原子。
(3)配位原子:配位体中直接与中心离子结合的原子。
配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、C 、S 、x 等。
(4)配位数:★含义:直接与中心原子结合的配位原子数。
单齿配体:配位数=配位体数。
多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。
如:[]+22)(en Pt★影响因素中心离子正电荷:电荷数↑,配位数↑半径:中心离子半径↑,配位数↑配体半径↑,配位数↓外界因素:浓度,配体浓度高有利于形成高配位数。
温度,温度低有利于形成高配位数。
★经验:中心离子 +1 +2 +3 +4 配位数 2 4(6) 6(4) 6(8) (5)内界:即配离子,用“[ ]”括起。


化学反应中的过渡金属配位机制过渡金属配位化学是现代化学中一个重要且广泛的领域。
过渡金属元素能够形成稳定的配合物,这是由于它们具有未填满的d轨道,这些电子可以与配体中的原子轨道相重叠形成配位键。
通过深入研究过渡金属配位机制,我们可以更好地理解和设计化学反应以及新型配合物的合成。
一、配位键的形成机制过渡金属配位化合物的形成涉及配体和过渡金属离子之间的配位键的形成。
配体是指可以提供一个或多个电子对给过渡金属离子的化合物或离子。
配位键的形成机制包括配体提供电子对,通过共价键形成以及配体和金属之间的电荷转移。
在形成配位键时,配体中的原子轨道与过渡金属离子中的未填满的d轨道重叠,产生一个共价键。
这种配位键的形成可以通过Donor-Acceptor模型来解释,即配体作为电子给体,提供电子给金属离子作为受体。
二、配位数与配位键的影响过渡金属离子的配位数是指围绕中心金属离子所形成的配位键数目。
配位数取决于过渡金属元素的电子结构以及配体的性质。
常见的配位数有4、5、6等。
配位数的变化会影响到配位化合物的性质和化学行为。
不同配位数的配合物在稳定性、溶解度、光谱性质等方面表现出不同的特点。
此外,配位数的变化还会影响到反应的速度和机理。
三、配位发生的动力学概念了解配位发生的动力学概念对于理解过渡金属配位机制至关重要。
配位发生包括两个方面:配合物的形成和解离。
配合物的形成速率取决于配体和过渡金属离子之间的反应速率以及配体的浓度。
配体的取代反应可以通过互变反应速率常数来评估,而配体的电子效应和空间位阻则会影响反应速率。
配合物的解离取决于配合物中配体与金属之间的键强度、水解能力以及其它配体促进解离的因素。
理解配合物的解离机理可以帮助我们设计更稳定的配位化合物或者利用溶剂效应来控制反应速率。
四、配位理论的应用过渡金属配位机制的研究在很多领域中都有着广泛的应用。
例如,配位化合物在催化反应、药物设计、材料科学等方面起着重要的作用。
通过深入研究过渡金属配位机制,可以开发新的催化剂,设计具有特殊功能的材料,并提供新的药物研究方向。


过渡金属与配位化学过渡金属元素是化学中的重要组成部分,也是许多生物和工业过程中的关键因素。
配位化学是一门研究配位化合物的合成、结构和反应的学科,其中包括过渡金属与配体之间的相互作用和配位共价键的形成。
一、过渡金属的性质和应用过渡金属元素具有特殊的性质,比如高的熔点、良好的导电性、高催化活性等,这些特性使得它们在许多领域有重要的应用。
过渡金属催化剂被广泛应用于有机合成、环境保护和能源转化等领域。
例如,铂催化剂常被用于汽车尾气处理,而铁催化剂可用于氧气还原反应。
二、配位化合物的结构与性质过渡金属与配体结合形成配位化合物,这些化合物通常具有复杂的结构和多样的性质。
配位化合物的结构由金属中心、配体以及它们之间的配位键构成。
金属中心通常位于化合物的中心,而配体则通过配体原子与金属中心形成配位键。
配位键可以是共价键或离子键,取决于配体的性质。
配位化合物的性质由金属中心和配体的性质决定。
金属中心的电子结构决定了配合物的稳定性和反应性,而配体的选择可以调节配位化合物的溶解度、磁性和光学性质。
例如,铁配合物可以具有不同的自旋态,从而呈现出不同的磁性行为。
三、配位化学反应配位化合物可以通过一系列反应进行合成和转化。
常见的反应包括配体置换、氧化还原反应和配位聚合等。
配体置换反应是最常见的反应之一,通过更换配体来改变配位化合物的性质。
氧化还原反应则涉及到配位化合物的电子转移过程,通常需要使用氧化剂或还原剂。
配位聚合是通过配位化合物之间的键的形成而构建高分子化合物,常见的例子是配位聚合物和金属有机框架材料。
四、生物中的过渡金属在生物体中起着关键作用,例如参与催化酶的催化反应和参与氧气运输的血红蛋白。
这些生物配位化合物通常含有特殊的配体和金属中心,形成稳定的配位键。
生物配位化合物的结构和功能的研究有助于我们理解生物体的化学过程和开发新的生物医学应用。
总结:过渡金属与配位化学是一门重要的学科,涉及到过渡金属元素的性质和配位化合物的合成、结构以及反应。

医药化工化 工 设 计 通 讯Pharmaceutical and ChemicalChemical Engineering Design Communications·197·第47卷第5期2021年5月1 概述作为当前的重要疾病之一,恶性肿瘤是人类健康的严重威胁,其治疗和预防受到广大关注。
随着20世纪40年代生物烷化剂的代表氮芥抗癌物质的发现,研究者们在此基础上合成了更多不同结构的药物。
吡啶钴配合物在化学、生物学、医学等许多领域都有潜在的应用。
经过国内外无数科研者们的研究已经发现钴元素对于刺激红细胞的再生过程上发挥着非凡的作用。
钴作为非常重要的微量元素,在人体内具有普遍的主要生理性能。
如抗氧化功能、促成免疫功能、调理基因表达、促成基础代谢、减轻微量元素的毒性等。
因而,钴配合物在人类健康中起着重要作用并逐步开始被人们所注重。
DNA 作为生命遗传信息的载体和传递者,是许多抗癌药物的主要靶点。
研究遗传物质DNA 和药物分子之间是如何相互作用的,对探讨抗癌药物的致癌原因、抑癌药物的药理作用及毒性研究和对设计合成新型具有专一性和选择性的抗癌药物具备重要的指导意义。
由于含氮杂环类配体种类繁多,结构多样,在金属配位化合物研究中应用最多,根据文献报道,在所有使用的含氮杂环类配体中,刚性双齿桥联配体4,4′-联吡啶是使用最多的桥联配体。
在合成的立体结构中,包含一维到三维的多种骨架结构。
通过已经报道的关于吡唑金属配合物的抗肿瘤机理,吡唑配体主要通过非共价键与DNA 相互作用。
因为配合物的配体中含有苯环,可以得出该配合物可能插入DNA 中,这可能是其具有抗肿瘤活性的理由。
新型金属配合物药物在疾病中的治疗上起着重要的作用,过渡金属钴的配合物在药物学、配位化学和生物无机化学学科具有重要的作用。
现如今,随着科研人员们的研究发现,钴配合物在医疗领域,比如抗肿瘤、杀菌、抗氧化等方面具有潜在应用前景[3]。