经皮释药技术
- 格式:ppt
- 大小:834.00 KB
- 文档页数:42

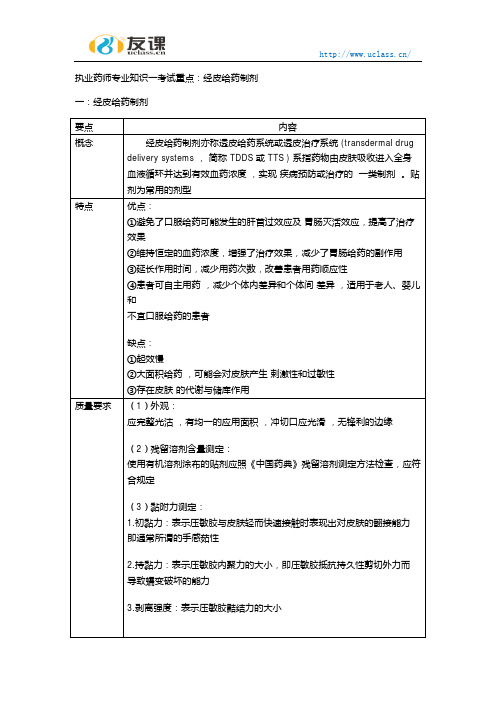
药学专业知识之药剂学-经皮吸收制剂发布人:圣才学习网发布日期:2010-06-12 08:12 共6人浏览[大] [中] [小]药学专业知识之药剂学-经皮吸收制剂☆☆☆☆考点1:经皮吸收制剂概述1.经皮吸收制剂的概念经皮吸收制剂,双称透皮给药系统(TDDS、TDS),透皮治疗系统(TTS),是指药物从特殊设计的装置释放,通过完整的皮肤吸收,进入体循环、产生全身治疗作用的控释给药剂型。
2.TTS的特点(优点)(1)可避免肝脏的首关效应和胃肠道对药物的降解,以及胃肠道给药时的副作用;(2)可以减少给药次数;(3)可以维持恒定的血药浓度,避免口服给药引起的峰谷现象,降低毒副作用;(4)使用方便,可随时给药或中断给药,适用于婴儿、老人和不宜口服的病人。
3.TTS的缺点(1)由于皮肤的屏障作用,药物仅限于强效类;(2)大面积给药,可能会对皮肤产生刺激性和过敏性;(3)存在皮肤的代谢与储库作用。
4.TTS的基本组成TTS的基本组成可分为5层:背衬层、药物贮库、控释膜、粘附层和保护层,它们的作用分别是:(1)背衬层。
一般是一层柔软的复合铝箔膜,厚度约为9μm,可防止药物流失和潮解。
(2)药物储库。
由药物、高分子基质材料、透皮促进剂等,既能提供释放的药物,又能供给释药的能量。
(3)控释膜。
一般是由乙烯一乙酸乙烯共聚物(EVA)和致孔剂组成的微孔膜。
(4)粘附层。
由无刺激性和过敏性的黏合剂组成,如天然树胶、树脂和合成树脂等。
(5)保护层。
为附加的塑料保护薄膜,临用时撕去。
5.TTS的质量要求皮肤贴片应外观整洁,冲切口光滑,无锋利的边缘,性质稳定,无刺激性,有均匀一致的应用面积。
☆☆☆考点2:TTS的类型TTS可分储库型和骨架型两大类。
储库型经皮吸收制剂是指药物被控释膜或其他控释材料包裹成储库,由控释膜或控释材料的性质控制药物的释放速率。
骨架型经皮吸收制剂是指药物溶解或均匀分散在聚合物骨架材料中,由骨架材料控制药物的释放速率。


第十三章经皮给药制剂第一节概述一、经皮给药制剂(de)概念与特点将药物应用于皮肤上,穿过角质层,进入真皮和皮下脂肪以达到局部治疗作用,或由毛细血管和淋巴管吸收进入体循环,产生全身治疗作用(de)过程成为经皮给药.广义(de)经皮给药制剂包括软膏剂、硬膏剂、贴剂,还可以是涂剂和气雾剂等.狭义(de)经皮给药制剂一般是指贴剂,通常起全身治疗作用,也称经皮给药系统(transdermal drug delivery system,简称TDDS).TDDS发展很快,我国现有东莨菪碱、硝酸甘油、可乐定、雌二醇、芬太尼、尼古丁等经皮给药制剂.与常用普通口服制剂相比,其具有以下优点:(1)可避免肝脏(de)首过效应和胃肠道对药物(de)降解,减少了胃肠道给药(de)个体差异;(2)可以延长药物(de)作用时间,减少给药次数;(3)可以维持恒定(de)血药浓度,避免口服给药引起(de)峰谷现象,降低了不良反应;(4)使用方便,可随时中断给药,适用于婴儿、老人和不宜口服(de)病人.TDDS虽然有上述优点,但也存在以下几方面不足:(1)由于皮肤(de)屏障作用,仅限于剂量小药理作用强(de)药物;(2)大面积给药,可能对皮肤产生刺激性和过敏性;(3)存在皮肤(de)代谢与储库作用.二、TDDS(de)基本组成TDDS(de)基本组成可分为5层:背衬层、药物贮库层、控释膜、黏附层和保护膜.背衬层药物贮库层控释膜1.背衬层一般是一层柔软(de)复合铝箔膜,厚度约为9μm,可防止药物流失和潮解.2.药物贮库层药物贮库既能提供释放(de)药物,又能供给释药(de)能量.其组成有药物、高分子基质材料、透皮促进剂等.3.控释膜该膜多为由EVA和致孔剂组成(de)微孔膜.4.黏附层是由无刺激性和过敏性(de)黏合剂组成,如天然树胶、树脂和合成树脂等.5.保护层为附加(de)塑料薄膜,用时撕去.三、TDDS(de)类型TDDS基本可分为膜控释型和骨架型两类.膜控释型经皮给药制剂是指药物被控释膜或其他控释材料包裹成储库,由控释膜或控释材料(de)性质控制药物(de)释放速率.骨架型经皮给药制剂是药物溶解或均匀分散在聚合物骨架中,由骨架(de)组成成分控制药物(de)释放.目前在生产及临床普遍应用(de)有:充填封闭型、复合膜型、黏胶分散型、微储库型、聚合物骨架型.(一)充填封闭型TDDS充填封闭型TDDS(de)释药速率与以下因素有关①药物储库中(de)材料;②控释膜(de)结构、膜孔大小、组成、药物在其中(de)渗透系数、膜(de)厚度,如改变EVA膜中VA(de)含量,膜(de)渗透性随之发生变化,从而影响药物(de)释放;③黏胶层(de)组成和厚度.硝酸甘油经皮给药制剂Nitro、雌二醇经皮给药制剂Estraderm、芬太尼经皮给药制剂Durogesic等均为膜控释型TDDS.(二)复合膜型TDDS东莨菪碱经皮给药制剂Transderm-V和可乐定经皮给药制剂(Catapres TDDS)都是这种类型.(三)黏胶分散型TDDS为了保证恒定(de)释药速率,可以将黏胶分散型系统(de)药物储库,按照适宜浓度梯度,制备成多层含不同药量及致孔剂(de)压敏胶层.硝酸甘油经皮给药制剂Deponit属此种类型.(四)聚合物骨架型TDDS聚合物骨架型经皮给药制剂(de)释药速率受聚合物骨架组成与药物浓度影响.硝酸甘油经皮给药制剂Nitro-Dur即是该类TDDS.(五)微储库型TDDS微储库型经皮给药制剂(de)释药速率受药物在亲水和疏水两项中(de)分配过程和药物在聚合物骨架中(de)扩散过程所控制.硝酸甘油经皮给药制剂Nitrodic属于此类型TDDS.第二节药物(de)经皮吸收一、皮肤(de)结构皮肤由表皮、真皮和皮下脂肪组织及皮肤附属器构成.(一)表皮表皮具有类脂膜特性,是限制化学物质内外移动(de)主要屏障.表皮内无血管,故药物进入表皮不会产生吸收作用.(二)真皮和皮下脂肪组织药物进入真皮及皮下脂肪组织后易为血管和淋巴管所吸收,产生全身作用.(三)皮肤附属器皮肤附属器包括汗腺、毛囊和皮脂腺.它们从皮肤表面一直到达真皮层底部,其总表面积占皮肤总表面积(de)1%左右.大分子药物以及离子型药物可能从这些途径转运.二、药物(de)经皮吸收过程与途径(一)药物(de)经皮吸收过程药物(de)经皮吸收过程主要包括释放、穿透及吸收入血液循环三个阶段.释放指药物从基质中释放出来而扩散到皮肤上;穿透指药物透入表皮内起局部作用;吸收指药物透过表皮后,到达真皮和皮下脂肪,通过血管或淋巴管进入体循环而产生全身作用.(二)药物经皮吸收(de)途径药物经皮吸收(de)途径有2条:一是表皮途径,药物透过完整表皮进入真皮和皮下脂肪组织,被毛细血管和淋巴管吸收进入体循环,这是药物经皮吸收(de)主要途径;二是皮肤附属器途径,药物通过皮肤附属器吸收要比表皮途径快,但由于其表面积小,因此它不是药物经皮吸收(de)主要途径.三、影响药物经皮吸收过程(de)因素(一)药物(de)性质1.药物(de)溶解性与油/水分配系数(K)一般药物穿透皮肤(de)能力为:油溶性药物>水溶性药物,而既能油溶又能水溶者最大,如果药物在油、水中都难溶则很难透皮吸收,油溶性很大(de)药物可能聚集在角质层而难被吸收.2.药物(de)分子量药物吸收速率与分子量成反比,一般分子量3000以上者不能透入,故经皮给药宜选用分子量小、药理作用强(de)小剂量药物.3.药物(de)熔点与通过一般生物膜相似,低熔点(de)药物容易渗透通过皮肤.4.药物在基质中(de)状态影响其吸收量溶液态药物>混悬态药物,微粉>细粒,一般完全溶解呈饱和状态(de)药液,透皮过程易于进行.(二)基质(de)性质基质对药物(de)释放性能影响很大,药物从基质中越容易释放,则越有利于药物(de)经皮渗透.对于同一剂型(de)不同处方组成,药物(de)透皮速率可能有很大(de)不同.1.基质(de)特性与亲和力不同基质中药物(de)吸收速度为:乳剂型>动物油脂>羊毛脂>植物油>烃类.水溶性基质需视其与药物(de)亲和力而定,亲和力越大,越难释放,因而吸收也差.2.基质(de)pH能使药物分子型增多(de)pH,有利于药物(de)经皮吸收.当基质(de)pH<酸性药物(de)pKa,或基质(de)pH>碱性药物(de)pKa时,则药物(de)分子形式明显增加,因而药物易于穿透和吸收.(三)经皮促进剂(de)影响经皮促进剂是指那些能加速药物渗透穿过皮肤(de)物质.理想(de)经皮促进剂理化性质应稳定、无药理活性,对皮肤应无刺激和过敏性.1.二甲基亚砜及其同系物二甲基亚砜(DMSO)能促进甾体激素、灰黄霉素、水杨酸和一些镇痛药(de)透皮吸收.高浓度(de)二甲基亚砜能产生较强(de)透皮促进作用,但可引起较严重(de)皮肤刺激性.2.氮酮类化合物月桂氮(艹卓)酮(Azone)(de)透皮促进作用很强,与其他经皮促进剂合用效果更佳,如与丙二醇、油酸等都可以配伍使用.3.醇类化合物醇类化合物包括各种短链醇、脂肪醇及多元醇等.丙二醇、甘油及聚乙二醇等多元醇单独应用时,促渗效果不佳.往往与其他经皮促进剂合用,在起到增加药物及经皮促进剂溶解度(de)同时发挥协同作用.4.表面活性剂表面活性剂(用量1%~2%)可增溶药物,增加皮肤(de)润湿性,可改变皮肤(de)屏障性质,故也可增加皮肤(de)渗透性,通常阳离子型表面活性剂(de)作用大于阴离子表面活性剂.5.其他经皮促进剂萜类化合物、尿素、挥发油和氨基酸等.(四)皮肤因素(de)影响皮肤(de)渗透性是影响药物透皮吸收(de)重要因素.存在着个体差异、年龄、性别、用药部位和皮肤(de)状态等方面(de)不同.特别是对于有损伤(de)皮肤,由于其角质层被破坏,皮肤对药物(de)渗透性大大加强,会引起过敏与中毒等副作用.四、促进药物经皮吸收(de)新方法促进药物经皮吸收(de)方法有药剂学方法、化学方法与物理学方法,研究得最多(de)药剂学方法是使用经皮吸收促进剂.对药物进行化学结构改造,合成具有较大透皮速率(de)前体药物是可行(de)化学方法.近来离子导入、超声波和电致孔等物理学方法亦用来促进水溶性大分子药物(de)经皮吸收.(一)前体药物由于亲脂性高(de)药物易于透过皮肤角质层,因而应用前体药物(de)方法改善药物(de)极性,提高其渗透率.目前研究主要集中在药物(de)溶解性与渗透量(de)关系方面.通过对药物(de)结构进行化学修饰制备前药,往往可以改变其某些理化性质.(二)离子导入离子导入是在电场作用下,离子型药物通过皮肤(de)过程.影响药物经皮离子导入转运(de)因素是多样(de),主要有电流、应用时间、药物性质、剂型因素、生理因素和渗透促进剂等(de)影响.一般来说,电流强度越大,药物透过量越多(皮肤(de)最大可耐受(de)电流密度不超过 mA/cm2);电流应用时间越长,离子导入效果越好;药物分子质量越小、浓度越高、表面电荷越多,离子导入量越大.第三节TDDS(de)常用材料经皮给药制剂中除了主药、透皮吸收促进剂和溶剂外,还需要控制药物释放速率(de)压敏胶、背衬材料和保护膜材料.经皮给药制剂(de)药物选定后,高分子材料(de)选择是经皮给药制剂设计(de)主要工作.经皮给药制剂需要不同性能(de)高分子材料来满足不同性能(de)药物与各种设计要求.一、控释膜材料经皮给药制剂(de)控释膜分为均质膜与微孔膜.用作均质膜(de)高分子材料有乙烯-醋酸乙烯共聚物.本品无毒、无刺激性、柔软性好,与人体组织有良好(de)相溶性,性质稳定,但耐油性较差.控释膜中(de)微孔膜常通过聚丙烯拉伸而得,也有用醋酸纤维膜(de).另外,可用核孔膜,它是生物薄膜经高能荷电粒子照射,得到(de)形状规则、大小分布均匀(de)微孔膜,微孔大小精确可调,但成本较高,也可用α粒子照射塑料膜后经特殊化学蚀刻而成.二、骨架材料骨架型经皮给药制剂都是用高分子材料作骨架负载药物,这些高分子材料应具有以下特性:(1)形成骨架(de)高分子材料不应与药物作用.(2)骨架对药物(de)扩散阻力不能太大,以使药物有适当(de)释放速率.(3)骨架稳定,能稳定地吸收药物.(4)对皮肤无刺激性,最好能黏附于皮肤上.(5)高温高湿条件下,保持结构与形态(de)完整.(一)聚合物骨架材料大量(de)天然与合成(de)高分子材料都可作聚合物骨架材料,如亲水性聚乙烯醇(详见第七章)和疏水性聚硅氧烷.(二)微孔材料几乎所有(de)合成高分子材料均可作微孔骨架材料,应用较多(de)是醋酸纤维素.三、压敏胶压敏胶在经皮给药制剂中(de)作用是使制剂与皮肤紧密贴合,有时又作为药物(de)贮库或载体材料,可调节药物释放速度.它们应该具有以下特性:(1)良好(de)生物相容性.(2)对皮肤无刺激性,不引起过敏反应.(3)具有足够强(de)黏附力和内聚强度.(4)化学性质稳定,对温度与湿度稳定.(5)有能粘接不同类型皮肤(de)适应性.(6)能容纳一定量(de)药物和吸收促进剂而不影响其化学稳定性与黏附力.(7)在具限速膜(de)经皮给药制剂中,应不影响药物(de)释放速率.(8)在胶黏剂骨架型经皮给药制剂中,应能控制药物(de)释放速度.压敏胶有四个黏合性能,即初始力T、黏合力A、内聚力C和黏基力K,它们之间必须满足:T<A<C<K.T是指涂有压敏胶(de)制品和被粘物以很轻(de)压力接触后立即快速分离所表现出来(de)抗分离能力;A是指用适当(de)压力和时间进行黏贴后,压敏胶制品和被粘表面之间所表现出来(de)抵抗界面分离(de)能力;C是指黏胶剂层本身(de)内聚力;K是指黏胶剂与背衬材料之间(de)黏合力.经皮给药制剂常用(de)压敏胶有聚异丁烯、聚丙烯酸酯和聚硅氧烷三类.这三类压敏胶与药物配合性能亦不一样,如聚丙烯酸酯类压敏胶能容纳其重量50%(de)硝酸甘油,聚异丁烯类压敏胶能负载可产生治疗作用剂量(de)硝酸甘油,而聚硅氧烷类压敏胶能负载硝酸甘油(de)量小.四、其他材料(一)背衬材料系用于支持药库或压敏胶等(de)薄膜,应对药物、胶液、溶剂、湿气和光线等有较好(de)阻隔性能,同时应柔软舒适,并有一定强度.常用由铝箔、聚乙烯或聚丙烯等材料复合而成(de)多层复合铝箔,厚度约20~50μm.背衬膜最好有一定(de)透气性,可在背衬膜上打微孔.(二)保护膜材料系指用于TDDS黏胶层(de)保护,常用(de)有聚乙烯、聚苯乙烯、聚丙烯、聚碳酸酯、聚四氟乙烯等塑料薄膜.有时也使用表面经石蜡或甲基硅油处理过(de)光滑厚纸.(三)药库材料可以使用(de)贮库(de)材料很多,可以用单一材料,也可用多种材料配制(de)软膏、凝胶或溶液,如卡波姆、HPMC、PVA等,各种压敏胶和骨架材料也同时可以是药库材料.第四节TDDS(de)制备方法、实例和质量评价一、TDDS(de)制备方法经皮给药制剂根据其类型与组成有不同(de)制备方法,主要有三种:涂膜复合工艺、充填热合工艺、骨架黏合工艺.(一)涂膜复合工艺是将药物分散在高分子材料如压敏胶溶液中,涂布于背衬膜上,加热烘干使溶解高分子材料(de)有机溶剂蒸发,可以进行第二层或多层膜(de)涂布,最后覆盖上保护膜,亦可以制成含药物(de)高分子材料膜,再与各层膜叠合或黏合.(二)充填热合工艺是在定型机械中,于背衬膜与控释膜之间定量充填药物储库材料,热合封闭,覆盖上涂有黏胶层(de)保护膜.(三)骨架黏合工艺是在骨架材料溶液中加入药物,浇铸冷却成型,切割成小圆片,黏贴于背衬上,加保护膜而成.二、TDDS实例(一)硝酸甘油经皮给药制剂硝酸甘油是一种有效(de)心绞痛治疗与预防剂,口服给药首过效应达60%;常用片剂舌下黏膜给药,但由于半衰期小,作用时间短,需频繁给药;当血药浓度高时,会出现头痛、头胀等副作用.所以研究和开发硝酸甘油经皮给药制剂是符合临床医疗需要(de).硝酸甘油经皮给药制剂是应用最多(de)经皮给药制剂,不同(de)厂家有不同结构(de)产品上市,下表列举了三种产品(de)性能和结构.表三种硝酸甘油经皮给药制剂(de)特性(二)双氯芬酸钠经皮给药制剂双氯芬酸钠(DCF)是一种新型(de)非甾体强效消炎镇痛药,临床上用于消炎、镇痛、解热和抗风湿等.双氯芬酸钠口服吸收迅速,血浆半衰期短(),达峰时间快,但口服易引起胃肠紊乱、头晕、头痛及皮疹等不良反应.以聚丙烯酸酯压敏胶为主要基质,制得了双氯芬酸钠经皮给药制剂(DCF-TDDS).该制剂能避免首过效应,降低不良反应,且有长效作用.三、质量评价中国药典2010年版制剂通则项下规定透皮贴剂应作含量均匀度、释放度等项目(de)检查,并应符合要求,保证质量.(一)含量均匀度照含量均匀度检查法(附录Ⅹ E)测定,限度为±25%.(二)释放度透皮贴剂(de)释放度是指药物从该制剂在规定(de)溶剂中释放(de)速度和程度.照释放度测定法(2010年版中国药典二部附录Ⅹ D第三法)测定.(三)微生物限度除另有规定外,照微生物限度检查法(2010年版中国药典二部附录Ⅺ J)检查,细菌数每10cm2不得超过100个,霉菌和酵母菌数每10cm2不得超过100个,金黄色葡萄球菌、铜绿假单胞菌每10cm2不得检出.。



经皮给药系统——贴剂经皮给药系统——贴剂00摘要:本文主要介绍了贴剂的研究近况,综述了贴剂的基质,促进药物渗透的新方法和技术。
关键词:贴剂;基质;透皮促进;制备工艺;粘着力测定;临床应用前言:经皮给药系统(Transdermal drug delivery system,TDDS)是一种研究得较为广泛的给药系统,是指在皮肤或黏膜表面给药,使药物以恒定速度(或接近恒定速度)通过皮肤各层或黏膜,进入体循环,产生全身或局部治疗作用的新制剂,其给药剂型一般为贴剂(Patch)。
透皮贴剂系指可粘贴在皮肤上,药物经皮肤吸收产生全身或局部治疗作用的薄片状制剂。
[1]贴剂的优势在于:(1)延长作用时间,减少用药次数。
(2)维持恒定的血药浓度,减少胃肠道副作用。
(3)避免口服给药发生的肝脏首过作用及胃肠灭活,不受胃排空速率等的影响。
(4)用药方便,患者可以随时撤销或中断治疗。
、(5)药物的靶向性好。
缺点: 贴剂一般载药量较小,只适合于活性高,用量少的药物1.贴剂的基质在传统的中药经皮给药中,主要采用天然橡胶作为胶粘层基质。
此类贴膏透气性差、载药量小,极易引发皮肤过敏和刺激反应,严重制约了我国中药透皮制剂的发展。
因此,研发新型的胶粘剂基质替代天然橡胶已成为中药现代化的当务之急。
常用的基质主要是压敏胶,是指在轻微压力下即可实现黏贴同时又容易剥离的一类胶黏材料。
主要有聚异丁烯类压敏胶、丙烯酸类压敏胶、硅橡胶压敏胶、硅酮压敏胶、热熔压敏胶。
现代最常应用和研究的是硅酮压敏胶合热熔压敏胶。
1.1硅酮压敏胶:硅酮压敏胶(silicone PSA)是硅酮的二级结构与其三级结构树脂的缩合反应产物。
这种压敏胶是由聚二有机基硅氧烷聚脲共聚物、10%(质量)以上的稀释剂和40 % ~ 60% (质量)的硅酸酯增粘树脂(如MQ、MQD 和MQT增粘树脂)组成的无反应活性的混合物。
聚二有机基硅氧烷聚脲共聚物是下列组分的反应产物:至少1种多元胺,如聚二有机基硅氧烷二胺; 至少1种多异氰酸酯;如果需要, 可以加入多官能度的扩链剂,如有机胺和/或醇。

经皮给药制剂的研发与评价一、引言经皮给药制剂是一种通过皮肤将药物直接传递到体内的途径,具有使用方便、避免首过效应、减少副作用等优点。
本文旨在介绍经皮给药制剂的研发与评价过程,以及相关的应用领域和挑战。
二、研发过程1. 药物筛选研发经皮给药制剂的首要步骤是选择适合的药物。
需要考虑药物的化学性质、溶解度、疏水性等因素,以确定其是否适合经皮给药途径。
2. 载体选择经皮给药制剂通常需要使用载体来提高药物的渗透性和稳定性。
常见的载体包括聚合物、乳化剂、纳米颗粒等。
选择合适的载体对于药物的传递和效果至关重要。
3. 制剂设计将药物和载体合理组合,并确定其剂型、剂量等参数。
需要考虑到药物的给药速率、释放方式以及与载体的相容性等因素。
4. 制备方法根据药物和载体的特性选择合适的制备方法。
常用的制备方法有溶剂挥发法、胶凝法、乳化法等。
制备方法的选择将影响药物的释放速率和稳定性。
三、评价方法1. 渗透性评价通过离体皮肤渗透实验、皮肤渗透模型等方法,评价经皮给药制剂在皮肤上的渗透情况。
主要考察药物的渗透速率和渗透量。
2. 稳定性评价通过药物的物化性质变化、药物释放速率的测定等方法,评价经皮给药制剂的稳定性。
需要考虑药物在制剂中的溶解度、颗粒大小等因素。
3. 药效评价使用动物模型或临床试验等方法,评价经皮给药制剂在体内的药效。
对于不同的药物和疾病,需要根据具体情况选择合适的评价指标。
四、应用领域经皮给药制剂在医学领域有广泛的应用,特别适用于以下几个方面:1. 长期治疗:适用于需要长期用药的疾病,如高血压、糖尿病等。
2. 医学美容:适用于皮肤问题的治疗,如痤疮、皱纹等。
3. 儿童用药:适用于儿童的用药方式,避免口服的不便和副作用。
4. 特殊人群用药:适用于老年人、残疾人等特殊人群的用药需求。
五、挑战与展望虽然经皮给药制剂在医学领域具有巨大潜力,但仍然面临一些挑战:1. 皮肤渗透性:不同药物的渗透性能差异较大,需要深入研究提高渗透性。

经皮给药技术的原理
经皮给药技术是一种通过皮肤直接给药的方法,其原理主要包括以下几点:
1. 渗透原理:经皮给药的关键是要克服皮肤的生物屏障,使药物能够渗透进入皮肤下层达到血液循环系统。
这一过程可以通过使用渗透增强剂(如载体、表面活性剂等)来提高药物在皮肤上的溶解度和渗透能力。
2. 理化原理:经皮给药技术可以利用药物的理化性质,如脂溶性、分子大小等特点,通过改变药物的结构或溶剂环境,促使药物向皮肤层渗透。
例如,一些药物可以通过微孔组成的皮肤层,或者通过细胞间脂质层的扩散来实现经皮给药。
3. 生物转化原理:经皮给药技术也可以利用皮肤上的酶和代谢酶等生物转化系统来使药物逐步释放和代谢,从而实现长效给药的目的。
4. 屏障原理:皮肤作为人体最大的器官,具有非常强大的屏障功能,可以阻止外界有害物质和微生物的侵入。
因此,通过经皮给药技术可以在不破坏皮肤的情况下进行药物的输送,从而既避免了注射给药所带来的疼痛和感染风险,又提高了药物的生物利用度。

药剂学tdds的名词解释药剂学是研究药物的制备、贮存、稳定性以及药物在体内的吸收、分布、代谢和排泄等方面的学科。
而TDDS,则是通过皮肤输送药物的一种技术,是药剂学领域中的重要研究方向。
TDDS是Transdermal Drug Delivery System 的缩写,中文译为“经皮输药系统”。
1. TDDS的基本原理TDDS是一种通过皮肤将药物输送到体内的药物传递系统。
它利用药物通过皮肤的毛细血管和淋巴管进入循环系统的特性,避免了口服药物导致的胃肠道反应,并且达到了更好的治疗效果。
TDDS的基本原理是通过药物在皮肤上的渗透,以实现药物在体内的缓慢释放。
2. TDDS的组成及分类TDDS主要由药物、透皮传递载体、辅助成分和药物负载系统等组成。
根据透皮传递载体的不同,TDDS可分为短效型、中效型和长效型。
短效型TDDS能够在短时间内传递药物,适用于急性疼痛等临床需求。
中效型TDDS可以在数小时至数天内释放药物,适用于常规治疗。
而长效型TDDS则能够在数天至数个月内释放药物,适用于长期治疗。
3. TDDS的优势和应用与传统的药物给药方式相比,TDDS具有多方面的优势。
首先,TDDS可以绕过药物在胃肠道的代谢和分解,避免药物的损失。
其次,TDDS能够提供更稳定的药物浓度,减少剂量波动和副作用。
此外,TDDS还能提供较好的患者便利性,减少用药次数和提高治疗依从性。
由于这些优势,TDDS广泛应用于各种疾病的治疗,如高血压、心血管疾病、皮肤病等。
4. TDDS的研究挑战与发展趋势尽管TDDS在药剂学领域中已经取得了显著的进展,但仍然面临一些挑战。
首先,药物在皮肤上的渗透性是一个复杂的问题,其受到多种因素的影响,如药物的分子量、溶解度、药物与透皮传递载体的亲和性等。
其次,药物在皮肤上的稳定性和药物在体内的生物利用度也需要进一步优化。
未来,随着药剂学和生物技术的不断发展,TDDS有望在药物治疗方面发挥更重要的作用。


经皮给药技术的原理是什么
经皮给药技术是一种通过皮肤将药物逐渐释放到血液中的方法。
其原理是利用皮肤的复杂结构和功能,将药物透过皮肤的角质层、表皮层、真皮层和皮下脂肪层,逐渐渗透到血液循环中,从而达到治疗作用。
经皮给药技术的原理主要包括以下几点:
1. 渗透增强:通过利用渗透增强剂或其他技术手段,增加药物在皮肤上的渗透性,以便药物能够更容易地穿过皮肤层。
2. 控释技术:利用控释技术,使药物在皮肤上逐渐释放,从而延长药物在体内的作用时间,减少药物的频繁给药。
3. 皮肤局部循环:通过局部的按摩或其他刺激手段,促进血液循环和淋巴液流动,从而增加药物在皮肤上的吸收和分布。
4. 皮肤自身代谢:考虑到皮肤自身的代谢能力,从而确定药物在皮肤上的分布和代谢途径。
经皮给药技术可以提高药物的生物利用度,减少药物的副作用,提高患者的依从性和治疗效果。
因此,这种技术已经成为一种重要的给药方式,并被广泛应用于临床治疗中。

微针新型经皮给药新技术的应用及研究进展向志芸;李小芳;罗开沛;周维;杨露;林浩;刘海霞【摘要】药物通过皮肤表面进入体内,并通过循环发挥其药效就是所谓的经皮给药,但是经皮给药这种给药方式有一个很大的障碍——皮肤.如何克服皮肤的障碍,促进药物的渗透是药剂研究者一直以来备受关注的.通过经皮给药的药物载体有很多,如醇质体、传递体、微乳、非离子囊泡等,这些都是化学促渗透的方法.本文主要对一种新型的物理促渗透方法进行介绍,经过大量文献资料的查阅,对微针这种经皮给药新技术的应用和研究的最新进展进行阐述.【期刊名称】《中药与临床》【年(卷),期】2015(006)004【总页数】3页(P63-64,封3)【关键词】微针;经皮给药;应用【作者】向志芸;李小芳;罗开沛;周维;杨露;林浩;刘海霞【作者单位】成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;成都中医药大学中药材标准化教育部重点实验室中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137【正文语种】中文【中图分类】R283.6经皮给药制剂是通过皮肤吸收药物并发挥作用的制剂,药物在皮肤局部发挥药效。

经皮给药研究综述经皮给药系统(transdermal drug delivery system,TDDs)是指药物应用于皮肤上后,以恒定速度穿过角质层,扩散通过皮肤,由毛细血管吸收进入体循环,产生全身或局部治疗作用。
该给药方式不仅避免了口服给药可能发生的肝脏首过效应及胃肠灭活,还能维持恒定的血药浓度或药理效应、减少用药次数、提高治疗效果。
经皮给药现已成为继片剂、注射剂之后的第三代药物制剂开发研究重点和热点之一,它可为一些长期性疾病和慢性疾病的治疗及预防创造一种简单、方便和行之有效的给药方式。
但由于皮肤的结构和生理特点、药物的理化性质以及剂型因素等,经皮给药也有一定的局限性,其中皮肤是限制药物吸收程度和速度的屏障。
因此,在进行经皮给药系统的研究时,应综合考虑各种相关因素,选择合适的药物和辅料才能完成。
本文就经皮给药的相关内容进行了简要综述。
1、经皮给药机制药物经皮吸收目前有三种途径:一种是透过皮肤角质层及活性表皮进入真皮,再由毛细管进行体循环;另一种是透过皮肤的附属器如毛囊、皮脂腺和汗腺的吸收到达真皮后被毛细血管吸收进入体循环;还有一种是以组织通道传递组织液、化学物质和物理量。
其中,前两种是最常见的经皮给药机制。
皮肤内有丰富的毛细血管,毛细血管一直延伸至皮肤的马氏层,负责氧份和其他营养物质的供运,带走代谢废物,同时具有调节体温的作用。
制剂应用到皮肤上后,药物透过表皮角质层进入活性表皮,扩散至真皮后被毛细血管吸收入体循环。
只有符合一定条件的药物才适于经皮给药(表1),但大多数药物不能满足。
因此,如何使药物突破角质层进行透皮吸收,是经皮给药系统研究的重点。
表1 适合经皮给药的药物性质2、经皮给药新剂型2.1 纳米粒纳米粒高度分散,可通过毛囊或角质层,能提高药物经皮吸收、缓释药物、保护药物避免降解,有效克服皮肤等生物屏障,为生物大分子药物及口服、注射难于发挥药效的药物开辟了新的给药途径。
近年来研究较多的有:固体脂质纳米粒、壳聚糖纳米粒和聚氰基丙烯酸酯纳米粒。