第十章电解与极化作用jg
- 格式:ppt
- 大小:1.74 MB
- 文档页数:102



第十章电解与极化作用教学目的: 通过本章学习使学生理解电极极化的原因及应用, 并能计算一些简单的电解 分离问题。
教学要求: 了解分解电压的意义。
了解产生极化作用的原因。
了解超电势在电解中的作用。
能计算一些简单的 电解分离问题。
了解金属腐蚀的原因和各种防腐的方法。
了解化学电源的类型及应用。
教学重点和难点 电极极化的原因,实际析出电势的求算和电解分离。
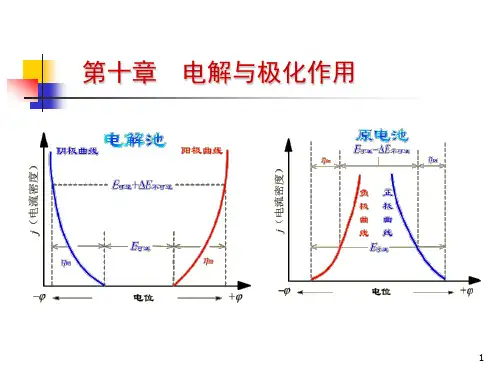
教学内容: §10.1 分解电压使电能转变成化学能的装置称为电解池。
当直流电通过电解质溶液,正离子 向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得 还原产物和氧化产物。
若外加一电压在一个电池上,逐渐增加电压直至使电池中 的化学反应发生逆转,这就是电解。
实验表明,对任一电解槽进行电解时,随着外加电压的改变,通过该电解槽 的电流亦随之变化。
例如,使用两个铂电极电解 HCl 溶液时,改变可变电阻,记录电压表和电 流表的读数,则可测量电解槽两端电位差与电流强度的关系曲线。
开始时,当外 加电压很小时,几乎没有电流通过电解槽;电压增加,电流略有增加;当电流增 加到某一点后,电流随电压增大而急剧上升,同时电极上有连续的气泡逸出。
在两电极上的反应可表示如下: 阴极 2H+(aH+)+2e→H2(g, p) 阳极 2Cl- (aCl-)→Cl2(g, p)+2e当电极上有气泡逸出时,H2和Cl2的压力等于大气压力。
电解过程分析:当开始加外电压时,还没有H2和Cl2生成,它们的压力几乎为 零,稍稍增大外压,电极表面上产生了少量的H2和Cl2,压力虽小,但却构成了 一个原电池(自发地进行如下反应) (-) H2(p)→2H+(aH+)+2e(+) Cl2(g)+2e-→2Cl-(aCl-)此时,电极上进行反应的方向正好与电解所进行的反应的方向相反。
它产生 了一个与外加电压方向相反的反电动势Eb。
由于电极上的产物扩散到溶液中了, 需要通过极微小的电流使电极产物得到补充。



第十章 电解与极化作用【复习题】【1】什么叫分解电压?它在数值上与理论分解电压(即原电池的可逆电动势)有何不 同?实际操作时用的分解电压要克服哪几种阻力?【答】 分解电压就是能使某电解质溶液连续不断地发生发生明显电解时所必须的最小 外加电压。
实际上,分解电压要大于原电池的可逆电动势E 可逆 。
E (实际分解) =E (理论分解) +η(阳) +η(阴) +IR 。
所以在实际操作时不仅要克服理论分解电压,还要克服极化 和电阻引起的电势降等阻力,其中主要是由于电极的极化作用所致。
【 2】产生极化作用的原因主要有哪几种?原电池和电解池的极化现象有何不同? 答】极化作用的类型有很多,主要有浓差极化和化学极化等。
由于极化作用, 负极的电极电势比可逆电势越来越 两条曲线有相互靠近的趋势, 原电池的电动势逐由于极化作用, 阴极的电极电势比可逆电势越来越 两条曲线有相互远离的趋势, 电解池的外加电压 逐渐增大。
3】什么叫超电势?它是怎么产生的?如何降低超电势的数值?【答】 在有电流通过电极时,电极电势偏离于平衡值的现象称为电极的极化,为了明 确地表示出电极极化的状况,常把某一电流密度下的电势ψ不可逆与ψ 平之间的差值称为超电势,它的产生有浓差极化、 化学极化和电阻极化 (电解过程中在电极表面上生成一层氧化物 的薄膜或其他物质) 。
在外加电压不太大的情况下,将溶液剧烈搅动可以将低浓差极化,设法降低溶液内阻可 以将低电阻极化,还可以加入去极化剂可以将低化学极化。
【 4】析出电势与电极的平衡电势有何不同?由于超电势的存在,使电解池阴、阳极的 析出电势如何变化?使原电池正、 负极的电极电势如何变化?超电势的存在有何不利和有利 之处?【答】 由于超电势的存在, 在实际电解时要使正离子在阴极析出, 外加于阴极的电势要 比平衡电势更负一些; 要使负离子在阳极析出, 外加于阳极的电势必须比可逆电极的电势更 正一些,即:阳,析出 阳,可逆 阳 阴,析出阴,可逆 阴对于电解池,由于超电势的存在,阴极的析出电势会更负,阳极的析出电势会更正,外 加电压要更大,所消耗的能量就越多。

第十章 电解与极化作用本章要求:1.了解分解电压的意义,要使电解池不断工作必须克服哪几种阻力?2.了解什么是极化现象,什么是超电势?极化作业有哪几种?如何降低极化作用?3.了解电解的一般过程及应用,特别是有关电解分离提纯方面的应用。
4.了解金属腐蚀的类型以防止金属腐蚀的常用方法。
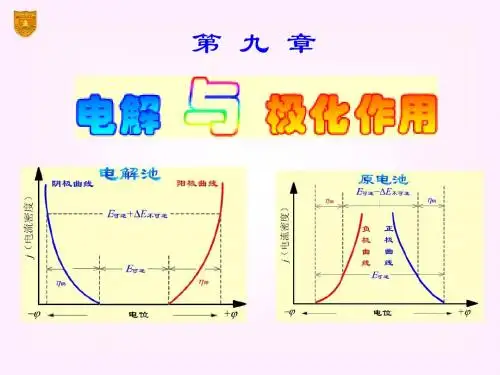
电解池:使电能转变成化学能的装置当一个电池与外接电源反向对接时,只要外加电压大于该电池的电动势E ,电池中的反应逆向发生,原电池就要变成电解池,要使电解池继续正常工作,外加电压要比电池电动势E 大很多,这些额外的电能一部分用来克服电阻,一部分用来克服电极的极化作用极化作用:当电流通过电极时,电极电势偏离其平衡的现象,且该过程是步可逆过程。
§10.1 分解电压在电池上外加一个直流电源,并逐渐增加电压,使电池中的物质在电极上发生化学反应,称为电解。
如电解HCl 水溶液阴极: ).(()p g aH e H H 222→+-++阳极:).(p g Cl e Cl 222→--- 总反应: )()()(p P aq Cl H HCl 222+−−→−电解 分解装置P118图10.1,并绘制电流─电压曲线。
由P118图10. 电流─电压曲线可看出:① 当开始加外电压时,还没有)()(g g Cl H 22和生成,P=0 电路中几乎没有电流通过。
② 当稍增大外电压,电极表面有少量)()(g g Cl H 22和产生,其压力虽小,却构成了一个原电池,产生了与外加电压方向相反的反电动b E 由于压力很小,低于大气压力,产生气体不能离开电极自由逸出,而是扩散到溶液中消失,此时此时就需要通入极微小的电流使电极产物得到补充,相当于图1─2段。
③ 继续增大外电压,电极时上)()(g g Cl H 22和继续产生,当22cL H P P 和等于外界大气压力时,电极上开始有气泡逸出,此时反电动势b E 达到了最大值MAX b E 而不在继续增加,若此时继续增大外电压,则电流急曾,如图曲线2─3段直线部分。

第十章电解与极化作用电解与极化作用一、简答题1.什么叫极化作用?什么叫超电势?极化作用主要有几种?阴、阳极上由于超电势的存在其不可逆电极电势的变化有何规律?2.在电解过程中,阴、阳离子分别在阴、阳极析出的先后次序有何规律?3.电化腐蚀主要有哪些类型?在盛水的铁锅中,为什么在水周围比在水下的部分先生锈?4.以Pt 为电极电解Na 2SO 4水溶液,在两级的溶液中各加数滴石蕊试液,在电解的过程中两极区溶液的颜色有何变化?5.当电流通过下列电解池时,判断有哪些物质生成或消失,并写出反应式。
(1)碳为阳极,铁为阴极,溶液为氯化钠;(2)银为阳极,镀有氯化银的银为阴极,溶液为氯化钠;(3)两铂电极之间盛以硫酸钾溶液。
6.电解ZnCl 2水溶液,两极均用铂电极,电解反应如何?若均改用锌电极,结果又如何?两者的分解电压有何差异?二、计算题1.用金作阳极,镍作阴极,电解1.0 mol·dm -3H 2SO 4溶液,求:分解电压为多少伏?(O 2在Ni 上的超电势η(H 2)=0.4V ,O 2在金上的超电势η(O 2)=0.53V ,在298K 时φ? [O 2/H 2O ,H +]=1.229V)。
[答案:V (分解)=φ(阳)-φ(阴)=1.899 V ]2.用Pt 电极电解CuCl 2溶液,通过的电流为20A ,经过20min 后,问:(1).在阴极上能析出多少质量的Cu ?(2).在阳极上能析出多少体积的298K ,100kPa 下的Cl 2(g)?[答案:(1)m=0.2009kg ;(2).V(Cl 2)=0.0031m 3]3.298K 时电解含两种金属离子的盐溶液)1,01.0(12=?=±-γkgmol b FeCl 和)1,02.0(12=?=±-γkg mol b CuCl 。
若电解过程中不断搅拌溶液,超电势忽略不计。
试问:①何种金属首先析出?②当第二种金属析出时,第一种金属离子在溶液中的浓度为多少?[答案:① Cu 先析出;②2910214.42-?=+Cu a ]4. 在411CuSO kg mol -?及42102.0SO H kg mol -?的混合液中,使铜镀到Pt 电极上。
