第十章电解与极化作用
- 格式:doc
- 大小:997.50 KB
- 文档页数:16






电解与极化作用一、简答题1.什么叫极化作用?什么叫超电势?极化作用主要有几种?阴、阳极上由于超电势的存在其不可逆电极电势的变化有何规律?2.在电解过程中,阴、阳离子分别在阴、阳极析出的先后次序有何规律?3.电化腐蚀主要有哪些类型?在盛水的铁锅中,为什么在水周围比在水下的部分先生锈?4.以Pt 为电极电解Na 2SO 4水溶液,在两级的溶液中各加数滴石蕊试液,在电解的过程中两极区溶液的颜色有何变化?5.当电流通过下列电解池时,判断有哪些物质生成或消失,并写出反应式。
(1)碳为阳极,铁为阴极,溶液为氯化钠;(2)银为阳极,镀有氯化银的银为阴极,溶液为氯化钠;(3)两铂电极之间盛以硫酸钾溶液。
6.电解ZnCl 2水溶液,两极均用铂电极,电解反应如何?若均改用锌电极,结果又如何?两者的分解电压有何差异?二、计算题1.用金作阳极,镍作阴极,电解 1.0 mol·dm -3H 2SO 4溶液,求:分解电压为多少伏?(O 2在Ni 上的超电势η(H 2)=0.4V ,O 2在金上的超电势η(O 2)=0.53V ,在298K 时φø [O 2/H 2O ,H +]=1.229V)。
[答案:V (分解)=φ(阳)-φ(阴)=1.899 V ]2.用Pt 电极电解CuCl 2溶液,通过的电流为20A ,经过20min 后,问:(1).在阴极上能析出多少质量的Cu ?(2).在阳极上能析出多少体积的298K ,100kPa 下的Cl 2(g)?[答案:(1)m=0.2009kg ;(2).V(Cl 2)=0.0031m 3]3.298K 时电解含两种金属离子的盐溶液)1,01.0(12=⋅=±-γkg mol b FeCl 和)1,02.0(12=⋅=±-γkg mol b CuCl 。
若电解过程中不断搅拌溶液,超电势忽略不计。
试问:①何种金属首先析出?②当第二种金属析出时,第一种金属离子在溶液中的浓度为多少?[答案:① Cu 先析出;②2910214.42-⨯=+Cu a ]4. 在411CuSO kg mol -⋅及42102.0SO H kg mol -⋅的混合液中,使铜镀到Pt 电极上。

第十章电解与极化作用一、本章主要内容§10.1 分解电压§10.2 极化作用§10.3 电解时电极上的反应§10.4 金属的电化学腐蚀与防腐§10.5 化学电源二、本章重点与难点1、分解电压的概念。
2、极化作用。
3、电解时电极上的反应。
4、金属的电化学腐蚀与防腐。
5、化学电源。
三、教学目的1、掌握电化动力学的一般原理;2、掌握电化学的基本理论和技能,为后续专业课的学习奠定坚实的理论基础。
四、教学要求1、了解分解电压的意义。
2、了解产生极化的原因,了解氢超电势在电解中的作用。
3、能计算一些简单的电解分离问题。
4、了解金属腐蚀的原因和各种防腐的方法。
5、了解化学电源的类型及应用。
五、授课时数8学时用Nernst 方程式处理电化学体系时,都有一个前提,即该体系需处于热力学平衡态。
所以用Nernst方程研究的问题具有很大的局限性。
一切实际的电化学过程都是不可逆过程。
对不可逆电极过程进行的研究,无论是在理论上或实际应用中,都有非常重要的意义。
因为要使电化学反应以一定的速度进行,无论是原电池的放电或是电解过程,在体系中总是有显著的电流通过。
因此,这些过程总是在远离平衡的状态下进行的。
研究不可逆电极反应及其规律对电化学工业有着十分重要的意义。
因为它直接涉及工艺流程、能量消耗、原料消耗等因素。
本章我们将讨论电解过程中在电极上进行的不可逆反应,从中得出不可逆电极过程的一些规律,将它们应用于电镀、电化学腐蚀、化学电源等方面。
§10.1 分解电压一、理论分解电压使某电解质溶液能连续不断发生电解反应时所必须外加的最小电压称为理论分解电压。
理论分解电压在数值上等于该电解池作为可逆电池时的可逆电动势:E (理论分解电压)=E (可逆)二、分解电压的测定若外加一电压在一个电池上,逐渐增加电压,使电池中的化学反应发生逆转,这就是电解。
当直流电通过电解质溶液时,正离子向阴极迁移,负离子向阳极迁移,并分别在电极上起还原和氧化反应,从而获得还原产物和氧化产物。

第十章电解与极化作用电解与极化作用一、简答题1.什么叫极化作用?什么叫超电势?极化作用主要有几种?阴、阳极上由于超电势的存在其不可逆电极电势的变化有何规律?2.在电解过程中,阴、阳离子分别在阴、阳极析出的先后次序有何规律?3.电化腐蚀主要有哪些类型?在盛水的铁锅中,为什么在水周围比在水下的部分先生锈?4.以Pt 为电极电解Na 2SO 4水溶液,在两级的溶液中各加数滴石蕊试液,在电解的过程中两极区溶液的颜色有何变化?5.当电流通过下列电解池时,判断有哪些物质生成或消失,并写出反应式。
(1)碳为阳极,铁为阴极,溶液为氯化钠;(2)银为阳极,镀有氯化银的银为阴极,溶液为氯化钠;(3)两铂电极之间盛以硫酸钾溶液。
6.电解ZnCl 2水溶液,两极均用铂电极,电解反应如何?若均改用锌电极,结果又如何?两者的分解电压有何差异?二、计算题1.用金作阳极,镍作阴极,电解1.0 mol·dm -3H 2SO 4溶液,求:分解电压为多少伏?(O 2在Ni 上的超电势η(H 2)=0.4V ,O 2在金上的超电势η(O 2)=0.53V ,在298K 时φ? [O 2/H 2O ,H +]=1.229V)。
[答案:V (分解)=φ(阳)-φ(阴)=1.899 V ]2.用Pt 电极电解CuCl 2溶液,通过的电流为20A ,经过20min 后,问:(1).在阴极上能析出多少质量的Cu ?(2).在阳极上能析出多少体积的298K ,100kPa 下的Cl 2(g)?[答案:(1)m=0.2009kg ;(2).V(Cl 2)=0.0031m 3]3.298K 时电解含两种金属离子的盐溶液)1,01.0(12=?=±-γkgmol b FeCl 和)1,02.0(12=?=±-γkg mol b CuCl 。
若电解过程中不断搅拌溶液,超电势忽略不计。
试问:①何种金属首先析出?②当第二种金属析出时,第一种金属离子在溶液中的浓度为多少?[答案:① Cu 先析出;②2910214.42-?=+Cu a ]4. 在411CuSO kg mol -?及42102.0SO H kg mol -?的混合液中,使铜镀到Pt 电极上。

第十章电解与极化作用教学目的与要求:使学生了解和掌握在非可逆的条件下的一些电化学的基本概念, 电解池的电流和电势之间的关系, 电极电势和电池的电动势, 非可逆条件下的电极反应,电极电位和电池的电动势,以及金属的电化学腐蚀与金属的腐蚀的防护等内容。
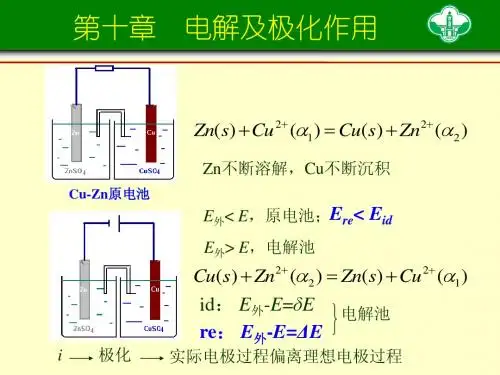
在理论上,当一个电池和一个电源反向对接时,只要外加电压比对电池的可逆电动势大一个无穷小,原电池就变成电解池。
但在实际的电解工作中,外加的电压要比电池的可逆电动势大得多,这一方面是由于电极的极化,另一方面是由于电解池的内阻对电压的消耗。
研究不可逆的电极过程对电化学工业具有重要的应用意义,本章讨论电解在工业中的应用以及金属的腐蚀与防护,以及化学电源等。
重点与难点:电解池的电流和电势之间的关系, 电极电势和电池的电动势, 非可逆条件下的电极反应,以及金属的电化学腐蚀与金属的腐蚀的防护。
§10.1分解电压以电极电解溶液的装置(如右图所示)来说明,在电解时的电极反应是阴极:阳极:在电解时外加电压E和电流之间的关系(右图所示),电解时需要明确的几个问题:1.在电解时,在阳极上会产生氯气,在阴极会产生氢气,电解池实际上构成了一个电池。
2.当外加电压很小时,通过的电流很小。
在阴阳两极不会产生和气泡,产生的和以扩散的形式进入溶液。
3.当外加电压增大到一定数值的时候,产生的和的压力和大气压力相等,此时和会在电极上产生气泡,并且不断逸出,通过的电流也相应增大。
4.继续增大电压,电流也相应增大。
5.在曲线上的直线部分外推到时的电压值称为该电解质溶液的分解电压分解,这个数值具有实际的应用价值,但不具有理论的意义,和对应的电池的可逆电动势也无什么严格的联系。
但对电解过程来说,分解可以看作欲使某一溶液顺利电解所需要的施加的电压。
§10. 2极化作用当电解池通过一定的电流时,所加的外加电压要大于由电解池构成的电池的可逆电动势,这是由于:1.在电解池中内阻的存在引起的电压降,2.不可逆的情况下,电池的电动势偏离该电池的可逆电动势()。
第十章 电解与极化作用【复习题】【1】什么叫分解电压?它在数值上与理论分解电压(即原电池的可逆电动势)有何不同?实际操作时用的分解电压要克服哪几种阻力?【答】 分解电压就是能使某电解质溶液连续不断地发生发生明显电解时所必须的最小外加电压。
实际上,分解电压要大于原电池的可逆电动势E 可逆。
E (实际分解)=E (理论分解)+η(阳)+η(阴)+IR 。
所以在实际操作时不仅要克服理论分解电压,还要克服极化和电阻引起的电势降等阻力,其中主要是由于电极的极化作用所致。
【2】产生极化作用的原因主要有哪几种?原电池和电解池的极化现象有何不同? 【答】极化作用的类型有很多,主要有浓差极化和化学极化等。
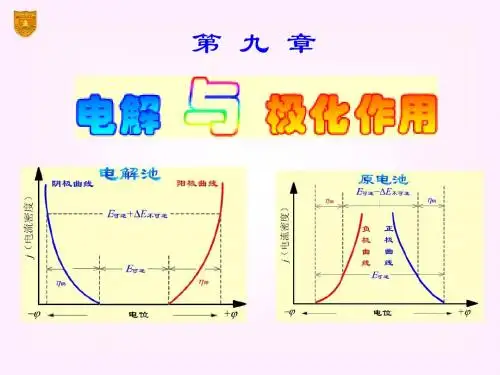
对于原电池,随着电流密度的增大,由于极化作用,负极的电极电势比可逆电势越来越大,正极的电极电势比可逆电势越来越小,两条曲线有相互靠近的趋势,原电池的电动势逐渐减小。
对于电解池,随着电流密度的增大,由于极化作用,阴极的电极电势比可逆电势越来越负,阳极的电极电势比可逆电势越来越正,两条曲线有相互远离的趋势,电解池的外加电压逐渐增大。
【3】什么叫超电势?它是怎么产生的?如何降低超电势的数值?【答】 在有电流通过电极时,电极电势偏离于平衡值的现象称为电极的极化,为了明确地表示出电极极化的状况,常把某一电流密度下的电势ψ不可逆与ψ平之间的差值称为超电势,它的产生有浓差极化、化学极化和电阻极化(电解过程中在电极表面上生成一层氧化物的薄膜或其他物质)。
在外加电压不太大的情况下,将溶液剧烈搅动可以将低浓差极化,设法降低溶液内阻可以将低电阻极化,还可以加入去极化剂可以将低化学极化。
【4】析出电势与电极的平衡电势有何不同?由于超电势的存在,使电解池阴、阳极的析出电势如何变化?使原电池正、负极的电极电势如何变化?超电势的存在有何不利和有利之处?【答】由于超电势的存在,在实际电解时要使正离子在阴极析出,外加于阴极的电势要比平衡电势更负一些;要使负离子在阳极析出,外加于阳极的电势必须比可逆电极的电势更正一些,即:ϕϕηϕϕη=+=-阳阳,析出阳,可逆阴阴,析出阴,可逆对于电解池,由于超电势的存在,阴极的析出电势会更负,阳极的析出电势会更正,外加电压要更大,所消耗的能量就越多。
对于原电池,由于超电势的存在,阴极的析出电势会更大,阳极的析出电势会更小,外加电压要更小,所提供的能量就越少。
由上分析知,不管是电解池还是原电池,由于超电势的存在,从能量的角度看都是不利的,但人们也利用极化,例如极谱分析就是利用滴汞电极上所形成的浓差极化来进行分析的一种方法。
【5】什么叫氢超电势?氢超电势与哪些因素有关?如何计算氢超电势? 氢超电势的存在对电解过程有何利弊?【答】早在1905年,Tafel 提出一个经验公式,表明氢超电势与电流密度的定量关系ln a b j η=+影响超电势的因素很多,如电极材料、电极表面状态、电流密度、温度、电解质的性质、浓度及溶液中的杂质等。
氢超电势的存在本来是不利的(因为电解时需要多消耗能量),但从另一个角度看,正因为超电势的存在,才使本来在氢之后的阳离子在阴极上还原反应,也能顺利地先在阴极上进行。
【6】在电解时,阴、阳离子分别在阳、阴极上放电,其放电先后次序有何规律?欲使不同的金属离子用电解方法分离,需控制什么条件?【答】在阴极上,还原电势越大的,其氧化态越先还原而析出; 在阳极上,还原电势越小的,其还原态越先氧化而析出。
如果溶液中有各种不同的金属离子,它们分别有不同的析出电势,可以控制外加电压的大小使金属离子分步析出而得以分离。
【7】金属电化学腐蚀的机理是什么?为什么铁的耗氧腐蚀比析氢腐蚀要严重得多?为什么粗锌(杂质主要是Cu,Fe 等)比纯锌在稀H 2SO 4溶液中反应得更快? 【答】(1)当两种金属或两种不同的金属制成的物体相接触,同时又与其他介质(如潮湿空气、其他潮湿气体、水货电解质溶液等)相接触时,就形成了一个原电池,进行原电池电化学作用。
(2)析氢腐蚀:酸性介质中在阴极上还原成氢气析出。
电极反应为2H ++2 e-→H 2; 析出电极电势为 2ln 2H H a RTF a ϕϕηη+=-=--析出平衡 耗氧腐蚀:如果既有酸性介质,又有氧气存在,在阴极上发生消耗氧的还原反应,电极反应为O 2+4H ++4e-H 2O 析出电极电势为22ln 1.229ln 44O O HH p p RT RT a a F p F p θθθϕϕηϕηη++=-=+⋅-=+⋅-析出平衡 由于在空气中221O p p θ≈,可算得25℃时酸性溶液中上述二电极反应的电极电势一般是耗氧腐蚀的析出电极电势大于析氢腐蚀析出电极电势,说明有氧存在时,腐蚀更为严重。
(3)因为粗锌除了化学腐蚀外,还有电化学腐蚀。
【8】在铁锅里放一点水,哪一个部位最先出现铁锈?为什么?为什么海轮要比江轮采取更有效的防腐措施?【答】 在水的边缘和空气接触的地方最先出现铁锈,因为在这些部位发生的吸氧腐蚀,在海水中存在大量NaCl 等电解质,海轮底部形成了大量的微小的原电池发生腐蚀,而江是淡水,因此海轮要比江轮采取更有效的防腐措施。
【9】比较镀锌铁与镀锡铁的防腐效果?一旦镀层有损坏,两种镀层对铁的防腐效果有何不同?【答】两者都是金属保护,不同的是镀锌铁是阳极保护,而镀锡铁是阴极保护,一旦镀层损坏,前者牺牲阳极锌,保护铁,而后者铁成了阳极,使腐蚀更严重。
【10】金属防腐主要有哪些方法?这些防腐方法的原理有何不同?【答】主要的方法有:非金属保护法、金属保护法、电化保护法、加缓冲腐蚀剂法等。
非金属保护法:是将耐腐蚀的物质如油漆、喷漆、搪瓷、陶瓷、玻璃沥青、高分子等涂在要保护的金属表面使其与腐蚀介质隔开。
金属保护法:是用耐腐蚀的金属或合金覆盖在被保护金属的表面,腐蚀外层金属。
电化保护法:应用牺牲阳极或增大阴极电势的原理来保护金属。
加缓冲腐蚀剂法:是减慢阳极腐蚀过程的速度活覆盖电极表面防止腐蚀。
【11】化学电源主要有哪几类?常用的蓄电池有哪几种?各有何优缺点?氢氧燃料电池有何优缺点?【答】学电源按其使用特点分为:(1)燃料电池;(2)蓄电池;(3)一次电池。
蓄电池有以下几类:(1)酸式铅蓄电池;(2)碱式Fe-Ni 电池或Cd-Ni 蓄电池;(3)Ag-Zn 蓄电池。
铅蓄电池历史最早,较成熟价廉,但重量大,保养要求较严,易于损坏;Fe-Ni 蓄电池能经受剧烈震动,比较经得起放电保养维护要求不高,本身重量轻,低温性能好,但结构复杂,制造费用高。
Ag-Zn 蓄电池单位质量、单位容积所蓄电能高,能大电流放电,能经受机械振动,但使用寿命还较短。
【12】试述电解方法在工业上有哪些应用,并举例说明之。
【答】 (1)金属离子的分离;(2)电解制备;(3)塑料电镀;(4)铝及其合金的电化学氧化和表面着色;(5)污水处理。
【习 题】【1】要在一面积为100cm 2的薄铁片两面都镀上厚度为0.05mm 的均匀镍层,计算所需要的时间。
已知所用电流为 2.0A ,电流效率为96%, ρ(Ni,s)=8.9g/cm 3,M Ni =58.7g/mol 。
【解】 电极反应为: 22()Nie Ni s +-+=21000.058.920.15258.7Ni Ni sh n mol M ρ⨯⨯⨯===140.152296500 2.910Q nzF mol C mol C -==⨯⨯=⨯g而 496%20.96 2.910Q It t C ==⨯=⨯ 41.510t s =⨯【2】在298K 和标准压力下,试写出下列电解池在两电极上所发生的反应,并计算其理论分解电压:(1))(|)68.0,0.1(|)(1s Pt kg mol NaOH s Pt =⋅±-γ (2))(|)860.0,05.0(|)(1s Pt kg mol HBr s Pt =⋅±-γ (3)1313()|(0.50,0.526)||(0.01,0.902)()Ag s AgNO mol kg AgNO mol kg Ag s γγ-±-±⋅=⋅=【解】(1)在阴极发生的反应为 22()2()HH a e H p θ++-+→在阳极发生的反应为 2212()2()()2OHOH ae H O l O p θ----→+2222ln ln 22H O OH OH H H H RT RT E a a F F θθϕϕϕϕ--++⎛⎫⎛⎫=-=--+ ⎪ ⎪⎝⎭⎝⎭阳阴可逆,,22222ln ln 2W H O OH H HOH H H O OH RT RT a a K F Fθθθϕϕϕ-+-+-=--=-,,, 140.4ln10RTF-=-1.228V =(2)阴极反应 22()2()H H a e H p θ++-+→阳极反应 22()2()Br Br a e Br l ----→E ϕϕ=-阳阴分解22ln 2Br BrBr RT a F θϕ--⎛⎫=-- ⎪⎝⎭,22ln 2H H H RT a F θϕ++⎛⎫+ ⎪⎝⎭,()22,ln Br Br H HBr H RT a a Fθθϕϕ-+-+=-,22ln Br Br RT m F m θθϕγ-±⎛⎫=- ⎪⎝⎭g , ()28.3142981.065ln 0.8600.0596500V ⨯=-⨯=1.227V(3) 阴极反应 1()()Ag a e Ag s +-+→阳极反应 2()()Ag s e Ag a -+-→E ϕϕ=-阳阴分解12ln Ag Ag RT a F θϕ+-⎛⎫=-- ⎪⎝⎭,11ln Ag Ag RT a F θϕ+-⎛⎫- ⎪⎝⎭, 218.3142980.010.902ln ln 965000.500.526a RT F a ⨯⨯==⨯ =-0.0866V电池(3)的分解电压为负值,说明原来电池的表示法为非自发电解池,E 分解 应是正值,即0.0866V ,可见计算电池的分解电压,只要不考虑超电势,则分解电压(即理论值)应在数值上与可逆电池的电动势相等。
【3】在298K 和标准压力下,用镀铂黑的铂电极电解0.1=+H a 的水溶液,当所用电流密度为23105--⋅⨯=cm A j 时,计算使电解能顺利进行的最小分解电压。
已知0,487.022≈=H O V ηη,忽略电阻引起的电位降,H 2O(l)的标准摩尔Gibbs 生成自由能为1129.237-⋅-=∆mol kJ G m f θ。
【解】 电解时阳极反应:224()42()()OH OH a e H O l O p θ----→+ 阴极反应:24()42()H H a e H p θ++-+→总反应:2222()2()()H O l H p O p θθ→+122(,)474.258r m f m G G H O l kJ mol θθ-∆=-∆=⋅11474.258 1.229496500r m G kJ mol E V zF C mol θθ--∆⋅===---⨯g E ϕηϕη=+--阳阳阴阴分解()E ϕϕηηηη=-++=++阳阳阳阴阴阴可逆1.2290.4870.742V =-+=-【4】在298K 时,使下述电解池发生电解作用:)(|)0.1(),0.1(|)(1412s Pt kg mol NiSO kg mol CdCl s Pt --⋅⋅问当外加电压逐渐增加时,两电极上首先分别发生什么反应?这时外加电压至少为若干?(设活度因子均为1,超电势可忽略。