【重组优化卷】2020届高考化学复习考点22化学反应速率及其影响因素练习.pdf
- 格式:pdf
- 大小:324.18 KB
- 文档页数:13

高三化学影响化学反应速率的因素试题答案及解析1.下列条件一定能使反应速率加快的是①增加反应物的物质的量②升高温度③增大反应体系的压强④不断分离出生成物⑤加入MnO2A.全部B.①②⑤C.②D.②③【答案】C【解析】增加固体或纯液体,速率无影响;增大压强,若密闭容器体积一定,加入稀有气体,对气体参与的反应速率无影响;不断分离反应物,速率减小;催化剂对反应有选择性,并不是对所有反应都有效;答案选C。
2.下列生产或实验事实引出的相应结论不正确的是()在容积可变的密闭容器中发生反应:2NH3(g)N2H4(l)+H2(g),把容积的体积缩小一半A、B两支试管中分别加入等体积【答案】C【解析】C项中压缩容器体积,反应物、生成物浓度均增加,正逆反应速率均加快。
3.对于可逆反应mA(g)十nB(g)pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。
下列判断正确的是A.b1>b2,t1>t2B.两图中阴影部分面积一定相等C.A的平衡转化率(II)大于(Ⅰ)中A的转化率D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大【答案】B【解析】对于任何化学反应来说,加入催化剂,能提高化学反应速率,缩短达到平衡所需要的时间。
但是不能使化学平衡发生移动。
因此,b2> b1,t1>t2。
A错误。
达到平衡时物质的浓度改变数值相等。
Δc=Δv·Δt不变。
即两图中阴影部分面积相等。
B正确。
C.由于催化剂不能是平衡发生移动,所以A的平衡转化率(II)等于(Ⅰ)中A的转化率。
错误。
D. 该反应的正反应为气体体积减小的反应。
增大压强使平衡逆向移动;减小压强,平衡正向移动。
既压强对逆反应速率的影响程度比正反应速率影响程度大。
错误。
【考点】考查催化剂对化学反应速率、化学平衡、物质转化率的影响及压强对化学反应速率的影响的知识。
4.下列关于催化剂的说法不正确的是()A.温度越高,催化剂的催化效果越好B.汽车排气管上的“催化转化器”能减少有害气体排放C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂【答案】A【解析】A选项催化剂的活性与温度有关,只有在合适的温度下效果才最佳,不是温度越高越好。

『递进式』进阶20——化学反应的速率与影响因素“递进式”进阶(step by step):◆感知高考1.[2020·浙江1月选考,21]一定温度下,在2 L的恒容密闭容器中发生反应A(g)+2B(g)3C(g)。
反应过程中的部分数据如下表所示:n/mol下列说法正确的是A.0~5 min用A表示的平均反应速率为0.09 mol·L-1·min-1B.该反应在10 min后才达到平衡C.平衡状态时,c(C)=0.6 mol·L-1D.物质B的平衡转化率为20%【答案】 C【解析】反应到5 min时,生成物C的物质的量是0.9 mol,则反应物A的物质的量减少了0.3 mol,v(A)=0.3 mol/(2L×5 min)=0.03 mol·L-1·min-1,故A项错误;到10 min时,A的物质的量是1.6 mol,反应了0.4 mol,则B反应了0.8 mol,余2.4 mol-0.8 mol=1.6 mol,和15 min时B的物质的量相等,说明此时已达到平衡状态,故B项错误;达到平衡状态时,生成C的物质的量是1.2 mol,则c(C)=1.2 mol/2L =0.6 mol·L-1,故C项正确;物质B的平衡转化率=0.8 mol/2.4 mol=33.3%,故D项错误。
答案选C。
2.[2020·新课标Ⅰ节选]硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+12O2(g)钒催化剂−−−−→SO3(g) ΔH=−98 kJ·mol−1。
回答下列问题:(1)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa 和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。
反应在5.0MPa、550℃时的α=__________,判断的依据是__________。

高三化学化学反应速率练习题及答案一、选择题1. 在化学反应速率的实验中,下列哪种条件可以提高反应速率?A. 降低温度B. 增加反应物浓度C. 增大粒子大小D. 减小反应物表面积答案:B2. 下列关于化学反应速率的说法正确的是:A. 反应速率与化学反应的终点无关B. 反应速率与化学反应的机理无关C. 反应速率与反应物的浓度无关D. 反应速率与反应物的物理状态无关答案:A3. 反应速率可以通过以下哪种方法进行研究?A. 测定产物的质量B. 测定反应物的浓度随时间的变化C. 增加反应物的摩尔质量D. 降低反应的温度答案:B4. 当化学反应发生的速率相同时,实验中使用最大质量的反应物,则反应的摩尔浓度最高。
请问这个说法是否正确?A. 正确B. 错误答案:B5. 已知A物质与B物质发生反应生成产物C,下列实验数据反映了反应速率的大小顺序:实验一:[A]初始=2 mol/L,[B]初始=1 mol/L,速率=0.1 mol/(L·s)实验二:[A]初始=3 mol/L,[B]初始=2 mol/L,速率=0.15 mol/(L·s)实验三:[A]初始=1 mol/L,[B]初始=1 mol/L,速率=0.05 mol/(L·s)根据以上实验数据,反应速率的大小顺序是:A. 实验二 > 实验一 > 实验三B. 实验二 > 实验三 > 实验一C. 实验一 > 实验二 > 实验三D. 实验三 > 实验二 > 实验一答案:A二、判断题1. 反应速率与温度无关。
答案:错误2. 下列哪种操作不会影响反应速率?A. 加热反应体系B. 增加反应物浓度C. 增大粒子大小D. 提高反应体系的压力答案:C三、解答题1. 请问什么是化学反应速率?如何计量化学反应速率?解答:化学反应速率是指化学反应在单位时间内消耗或生成物质的量。
常用的计量化学反应速率的方法是测定反应物浓度随时间的变化。
第二节 影响化学反应速率的因素知识点清单速率表示方法回顾1.速率的表示方法有①定性观察法(冒气泡快慢);(颜色变化);(固体量减少);(浑浊程度);(温度变化等)。
②定量表示法: V=( △C/ t ) 单位是:( mol/( L.min) 、 mol/ ( L.s )) 2. 一定条件下,用不同的物质来表示某反应的速率,其(数值 )可能不同,但表示的意义(相同)。
且它们的数值之比等于反应方程式的(计量系数)之比。
影响化学反应速率的因素一、内因:参加反应的物质自身的结构和性质,这是决定化学反应速率的根本因素。
化学反应速率不仅与其自身的结构和性质有关,其他外界条件的改变也会引起化学反应速率的变化。
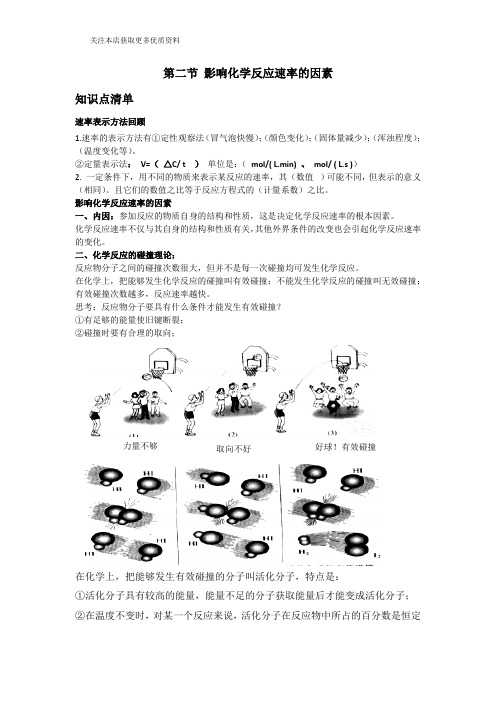
二、化学反应的碰撞理论:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。
在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;有效碰撞次数越多,反应速率越快。
思考:反应物分子要具有什么条件才能发生有效碰撞? ①有足够的能量使旧键断裂; ②碰撞时要有合理的取向;在化学上,把能够发生有效碰撞的分子叫活化分子,特点是:①活化分子具有较高的能量,能量不足的分子获取能量后才能变成活化分子; ②在温度不变时,对某一个反应来说,活化分子在反应物中所占的百分数是恒定力量不够取向不好好球!有效碰撞的,且与温度呈正比。
活化分子数=反应物分子总数×活化分子百分数⑴化学反应发生的先决(必要)条件:反应物分子相互接触和碰撞。
化学反应发生的充分条件:有效碰撞(2).化学反应的实质是:旧的化学键断裂,新的化学键形成。
三、外因:引起活化分子百分数以及反应物分子总数变化的条件。
主要包括:浓度、压强、温度和催化剂等。
1、浓度对反应速率的影响【参照书本实验】结论:当其他条件不变时,增加反应物浓度,可以增大化学反应速率,减小反应物浓度,可以减小化学反应速率。
思考:怎样从理论上解释上述结论?在其他条件不变时,活化分子在反应物分子中所占的百分比不变。

化学反应速率的影响因素有哪些关键信息项:1、反应物浓度:____________________________2、反应温度:____________________________3、反应物的接触面积:____________________________4、催化剂:____________________________5、压强(对于有气体参与的反应):____________________________11 反应物浓度反应物浓度是影响化学反应速率的重要因素之一。
在其他条件不变的情况下,增大反应物的浓度,单位体积内活化分子的数目增多,有效碰撞的几率增加,从而导致反应速率加快。
反之,减小反应物的浓度,反应速率则会减慢。
例如,在二氧化硫与氧气生成三氧化硫的反应中,增加二氧化硫或氧气的浓度,反应速率会显著提高。
111 反应温度温度对化学反应速率的影响非常显著。
升高温度,反应物分子的能量增加,活化分子的百分数增大,有效碰撞的频率提高,反应速率加快。
通常情况下,温度每升高 10℃,反应速率大约增大到原来的 2 至4 倍。
但对于某些反应,如酶催化的反应,过高的温度可能会导致酶的失活,从而使反应速率下降。
112 反应物的接触面积反应物的接触面积也会影响反应速率。
当反应物为固体时,将其粉碎成细小颗粒或增大其表面积,能够增加反应物之间的接触机会,从而加快反应速率。
例如,在块状碳酸钙与盐酸的反应中,将碳酸钙粉碎后,反应速率明显加快。
12 催化剂催化剂能够改变化学反应的速率。
正催化剂可以降低反应的活化能,使更多的反应物分子成为活化分子,从而增大反应速率。
负催化剂则能够减慢反应速率。
催化剂在反应前后的质量和化学性质不变。
例如,在双氧水的分解反应中,加入二氧化锰作为催化剂,可以显著加快反应的进行。
121 压强(对于有气体参与的反应)对于有气体参与的反应,压强的改变会影响反应速率。
增大压强,相当于增大了气体反应物的浓度,单位体积内活化分子的数目增多,反应速率加快。

化学反应速率的影响因素1、影响化学反应速率的因素:(1)内因:物质本身的性质;(2)外因:浓度、温度、压强、催化剂、物质状态、接触面积及其他因素2、外因对化学反应速率的影响:(1)浓度:浓度增大,单位体积内活化分子数增加,有效碰撞次数增加,反应速率增大.但固体或液体的浓度是个定值,因此增加固体或液体浓度不能增大反应速率.(2)温度:温度升高,活化分子百分数提高,有效碰撞增加,反应速率加快,升高10℃,速率增加2~4倍.(3)压强:对于有气体参与的反应,增大压强,体积减小,浓度增大,反应速率加快.注意:①没有气体参加的反应,压强的改变不影响反应速率.②惰性气体对反应速率的影响:恒温恒容充入惰性气体,反应物浓度不变,反应速率不变;恒温恒压充入惰性气体,体积增大,反应物浓度减小,反应速率减小.(4)催化剂:加入正催化剂,降低活化能,活化分子百分数增加,有效碰撞次数增多,反应速率加快.若题目未指出,一般催化剂均指正催化剂.(5)固体表面积:增加固体表面积可以增加反应速率.3、列表对比分析如下:反应条件单位体积内有效碰撞次数化学反应速率分子总数活化分子数活化分子百分数增大浓度增加增加不变增加加快增大压强增加增加不变增加加快升高温度不变增加增加增加加快加催化剂不变增加增加增加加快【命题方向】题型一:化学反应速率的影响因素综合典例1:下列措施肯定能使化学反应速率增大的是()A.增大反应物的量B.增加压强C.升高温度D.使用催化剂分析:一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,但需要注意一些特例情况,以此来解答.解答:A.若反应物为纯固体或纯液体,增大反应物的量,反应速率不变,故A不选;B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B不选;C.因升高温度,活化分子百分数增大,反应速率加快,故C选;D.催化剂能改变反应速率,可加快也可减慢,故D不选;故选C.点评:本题考查影响化学反应速率的因素,注意物质的状态、反应的特点来分析影响反应速率的因素,题目难度不大.典例2:用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是()A.加热B.不用稀硫酸,改用98%浓硫酸C.加水稀释硫酸D.不用铁片,改用铁粉分析:加快生成氢气的速率,可增大浓度,升高温度,增大固体的表面积以及形成原电池反应,反之不能,以此解答.解答:A.加热,增大活化分子的百分数,反应速率增大,故A不选;B.因浓硫酸具有强氧化性,铁与浓硫酸反应生成二氧化硫而不生成氢气,故B选;C.加水稀释硫酸,浓度降低,反应速率减小,故C选;D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.故选BC.点评:本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.题型二:压强对反应速率的影响典例2:反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率减小的是()A.增加C的量B.将容器体积缩小一半C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大分析:A.增大固体的量对反应速率没有影响;B.将体积缩小,反应物的浓度增大,反应速率增大;C.保持体积不变,充入与反应无关的气体,反应速率不变;D.保持压强不变,充入与反应无关的气体,容器体积增大,浓度减小.解答:A.C为固体,固体浓度为定值,增大固体的量对反应速率没有影响,故A错误;B.将体积缩小,气体的浓度增大,反应速率增大,故B错误;C.保持体积不变,充入氮气,但氮气不参加反应,由于参加反应的气体的浓度不变,反应速率不变,故C错误;D.保持压强不变,充入氮气,但氮气不参加反应,由于容器体积增大,浓度减小,反应速率减小,故D正确.故选D.点评:本题考查影响化学反应速率的因素,题目难度不大,本题注意固体对反应速率没有影响,易错点为C、D,注意加入与反应无关的气体对参加反应的气体的浓度的影响.题型三:影响因素综合分析典例3:(2013•福建模拟)把在空气中久置的铝片5.0g投入盛有500mL0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是()A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高C.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低D.t=c时反应处平衡状态分析:A、根据铝的表面有一层致密的氧化膜;B、金属和酸的反应是放热反应,根据温度对化学反应速率的影响分析;C、溶液的浓度影响化学反应速率;D、反应不是可逆反应,t=c时反应速率最大.解答:A、因铝的表面有一层致密的Al2O3能与HCl反应得到盐和水,无氢气放出,发生的反应为Al2O3+6HCl=2AlCl3+3H2O,故A正确;B、在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,故B正确;C、随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,故C正确;D、反应不是可逆反应,当t<c时,温度对速率的影响比浓度的影响大,因此速率上升,t >c时,温度影响不是主要因素,浓度减少是主要因素,反应速率下降,t=c时反应速率最大,故D错误.故选D.点评:本题主要考查了影响化学反应速率的因素,关键是分析图象结合外界条件对化学反应速率的影响等知识点来解答,难度不大.【解题方法点拨】对于该考点,需要注意以下几点:①升高温度一定能加快反应速率;增加物质浓度不一定能改变反应速率(固体、纯液体和不参与反应的物质不行);增大压强不一定能加快反应速率(注意两种情况:①无气体参与的反应;②加入惰性气体);催化剂有正负之分.②当反应速率受多个因素影响时,要分情况讨论.。
高考化学复习化学反应速率及其影响因素1 •中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面 涂上一种光催化剂涂料,可将汽车尾气中 45%的NO 和CO 转化成N 2和CO 。
下列对此反应的叙述正确的是()A. 使用光催化剂不改变反应速率B. 使用光催化剂能提高 NO 的转化率C. 升高温度能加快反应速率D. 改变压强对反应速率无影响解析:使用催化剂可以加快反应速率,但不能改变反应物的平衡转化率,故 A 、B 两项错误;该反应有气体参与,改变压强可影响化学反应速率,故D 项错误。
答案:C2•下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是 ( )①改变气体物质的浓度 ②改变气体的压强③加入催化剂④改变气体的温度A.只有①② B .只有③④ C.只有①③④D.①②③④解析:在影响反应速率的外界条件中, 只有温度和催化剂才是通过改变活化分子百分数 来实现的。
浓度和压强改变的是单位体积内的活化分子个数, 而不是活化分子的百分数, 故B 正确。
答案:B3.—定温度下,在某密闭容器中发生反应:2HI(g) . ----------- - H 2(g) + I 2(s)△ H>0,如果0〜15 s 内c (HI)由0.1 mol ・L 降到0.07 mol • L 1,则下列说法正确的是 ()A. 0〜15 s 内用丨2表示的平均反应速率为v (I 2) = 0.001 mol ・L L 1・s L 1B. c (HI)由0.07 mol 降到0.05 mol 所需的反应时间小于 10 sC. 升高温度,正反应速率加快,逆反应速率减慢D. 减小反应体系的体积,化学反应速率加快解析: 丨2为固态,不能用它表示化学反应速率,A 错误;0〜15 s , v (HI)_ 1 _ 10.07 mol •L _ 0.05 mol •L—1— 10.002 mol •L •s但随着反应的进行,反应物浓度降低,反应速率减慢,所用时间应大于 10 s , B 错误;升高温度,正、逆反应速率均加快,C 错误;减小反应体系的体积,从而增大了压强,化学_ 1 _ 10.1 mol •L _ 0.07 mol •L=0.002 mol 15 s-L _1・s _1,若反应仍以该反应速率进行,则10 s反应速率加快,D正确。
化学反应的速率与影响因素一、化学反应速率的概念化学反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
通常用反应物消失的速率或生成物产生的速率来表示。
二、化学反应速率的影响因素1.反应物浓度:反应物浓度越大,反应速率越快。
因为反应物浓度大,反应物分子之间的碰撞机会增多,从而增加了反应速率。
2.接触面积:固体与液体反应时,固体的接触面积越大,反应速率越快。
例如,煤粉的燃烧比煤块快得多。
3.温度:温度越高,反应速率越快。
因为温度高,分子运动速度快,分子之间的碰撞机会增多,从而增加了反应速率。
4.催化剂:催化剂能改变化学反应速率,有的催化剂能加快反应速率,有的催化剂能减慢反应速率。
5.压强:对于有气体参与的反应,压强越大,反应速率越快。
因为压强增大,气体分子之间的碰撞机会增多,从而增加了反应速率。
三、化学反应速率的测量化学反应速率的测量通常采用定时观察法,即在反应开始后,定时观察反应物消失或生成物产生的数量,然后计算单位时间内反应物消失或生成物产生的数量。
四、化学反应速率的计算化学反应速率可以用反应物的消失速率或生成物的产生速率来表示,通常用mol/L·s或mol/L·min表示。
例如,2H2 + O2 → 2H2O的反应速率可以用氢气或氧气的消失速率来表示。
五、化学反应速率的应用1.控制反应速率:在工业生产中,通过控制反应速率可以优化生产过程,提高产品质量。
2.加速反应:在实验室或工业生产中,通过使用催化剂或提高温度等方法,可以加速反应速率,提高生产效率。
3.减慢反应:在某些情况下,需要减慢反应速率,如在食品保存中,通过降低温度或使用抑制剂等方法,可以减慢食品腐败的速率。
化学反应速率是化学反应中重要的基本概念,影响化学反应速率的因素有反应物浓度、接触面积、温度、催化剂和压强等。
掌握化学反应速率的概念和影响因素,能够帮助我们更好地理解和控制化学反应。
习题及方法:1.习题:某化学反应的速率方程式为:v = k[A][B],其中k为速率常数,[A]和[B]分别为反应物A和B的浓度。
高中化学《影响化学反应速率的因素》练习题(附答案解析)学校:___________姓名:___________班级:______________一、单选题1.一定条件下的可逆反应:N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ·mol-1,下列说法正确的是()A.将氨气液化分离或升高温度,都有利于提高反应物的转化率B.保持容积不变时充入少量Ar气体,压强增大,平衡不移动C.将1molN2(g)和3molH2(g)充入一密闭容器中反应,放出92.4kJ的热量D.加入催化剂,改变了反应的路径,反应的△H也随之改变2.对于在一定条件下进行的化学反应 2SO2(g)+O2(g) 2SO3(g),改变下列条件,能提高反应物中活化分子百分数的是()A.增大压强B.升高温度C.降低温度 D.增大反应物浓度3.为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。
下列叙述中不正确的是()A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解反应的催化效果好C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间D.若比较Fe3+和Cu2+对H2O2分解的催化作用,应选用Fe2(SO4)3(aq)和CuSO4(aq)或FeCl3(aq)和CuCl2(aq)。
如果选用FeCl3(aq)和CuSO4(aq),虽然加入FeCl3(aq)的反应速率快,但两溶液的阴离子不同,不能得出结论。
4.298.15K 时,N 2、H 2与NH 3的平均能量与合成氨反应的活化能的曲线如图所示,下列说法正确的是( )A .合成氨反应的热化学方程式为N 2+3H 2=2NH 3△H =﹣92kJ/molB .在图中曲线a 表示加入催化剂时的能量变化曲线C .升高反应温度,活化分子数增多D .催化活性很强的新型催化剂可以提高N 2的转化率5.反应C(s)+H 2O(g)CO(g)+H 2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A .保持压强不变,充入N 2使容器的体积增大B .将容器的体积缩小一半C .保持体积不变,充入H 2O(g)D .增加C 的量 6.下列说法错误的是( )A .水玻璃常用于制备硅胶和木材防火剂B .在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率C .煤经过气化和液化两个物理变化过程,可变为清洁能源D .PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液7.如图为PCl 5(g)PCl 3(g)+Cl 2(g)(正反应为吸热反应)从平衡状态Ⅰ移动到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化是 ( )A .降温B .降压C .增加PCl 5的量D .增加PCl 3的量8.氯气与水反应的化学方程式为22Cl H OHCl HClO ++,可用于自来水消毒。
高考化学复习——《化学反应速率及其影响因素》知识点复习一、化学反应速率及其影响因素【知识整合】1.化学反应速率(1)概念:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
(2)表达式:v=常用单位:mol·L-1·s-1、mol·L-1·min-1。
(3)速率大小判断方法:对同一个反应,用不同物质表示时,数值可能不同,比较的方法是将其换算为同一种物质再进行比较,同时,还要注意其单位是否统一,若单位不统一,要先将单位统一,否则可能会得出错误结论。
①对反应物来说,Δc=c(始)-c(终);对生成物来说,Δc=c(终)-c(始)。
②表示化学反应速率时,要注明具体物质。
同一反应中,用不同的物质表示反应速率时,数值可能不同,但意义相同。
各物质的化学反应速率之比等于反应方程式中的化学计量数(系数)之比。
例如反应:mA(g)+nB(g)pC(g),其速率比为v(A)∶v(B)∶v(C)=m∶n∶p。
③固体和纯液体的浓度视为常数,因此表示化学反应速率时一般不用固体或纯液体来表示。
2.外界条件对反应速率的影响(其他条件不变,改变一个条件)浓度增大反应物的浓度,反应速率增大,反之减小。
压强对于有气体参加的反应,增大压强(反应混合物的浓度增大),反应速率加快,反之减慢。
温度升高温度,反应速率加快,反之减慢。
催化剂使用催化剂,能改变化学反应速率,且正逆反应速率的改变程度相同。
其他因素反应物间的接触面积、光照、放射线辐射、超声波等。
(1)当升高温度或增大压强时,正、逆反应速率都增大,但增大程度不同,取决于反应的热效应和方程式的化学计量数。
(2)当降低温度或减小压强时,正、逆反应速率都降低,但降低程度不同。
(3)温度对吸热方向反应速率影响程度大;压强对体积减小方向反应速率影响程度大。
3.利用有效碰撞理论理解外界条件对化学反应速率的影响【规律方法】关于化学反应速率的两个问题(1)灵活应用“反应速率之比=化学计量数(系数)之比=浓度变化量之比=物质的量变化量之比”这一公式求算化学反应速率,确定物质的化学计量数(系数)、书写化学方程式。