化学反应速率,影响化学反应速率的因素
- 格式:docx
- 大小:206.98 KB
- 文档页数:6

化学反应速率表观反应速率的计算与影响因素化学反应速率是指反应物质在单位时间内转化为生成物质的数量,是描述反应快慢程度的物理量。
表观反应速率是指在反应初期不考虑反应机理的情况下,根据反应物和生成物的浓度变化确定的反应速率。
本文将介绍如何计算化学反应的表观反应速率以及影响反应速率的因素。
一、表观反应速率的计算方法化学反应的表观反应速率可通过实验数据的处理计算获得。
通常,对于液相反应,可以通过测量反应物的浓度来确定反应速率。
1. 单组分反应对于单组分反应,反应物的浓度变化可以用以下公式表示:速率 = -Δ[A] / Δt其中Δ[A]表示反应物浓度的变化量,Δt表示时间的变化量。
负号表示反应物浓度的减少。
2. 多组分反应对于多组分反应,反应物浓度的变化可以用以下公式表示:速率 = -1 / aΔt * Δ[A] = -1 / bΔt * Δ[B]其中a和b表示反应物A和B的化学计量系数,Δ[A]和Δ[B]表示反应物浓度的变化量,Δt表示时间的变化量。
二、影响反应速率的因素反应速率受多种因素的影响,包括反应物浓度、温度、催化剂和反应物粒径大小等。
1. 反应物浓度反应物的浓度越高,反应发生的概率越大,反应速率也就越快。
反应速率与反应物浓度之间一般存在指数关系,即速率与浓度的幂次相关。
2. 温度根据麦尔斯定律,反应速率约每上升10摄氏度,速率大约会加快2至3倍。
这是因为随着温度升高,反应物分子的平均动能增加,反应发生的概率增加,反应速率增大。
3. 催化剂催化剂可以提高反应速率,但自身并不参与反应。
催化剂通过降低反应的活化能来加速反应。
催化剂提供了一个更低的能垒,使得反应物更容易通过。
4. 反应物粒径大小反应物粒径大小对反应速率有着显著影响。
通常来说,反应物的粒径越小,反应速率越快。
因为细小的颗粒有更大的比表面积,更容易与其他物质发生反应。
结论化学反应速率的计算与影响因素是研究化学反应过程中的重要内容。
通过实验数据的处理,可以计算得到反应的表观反应速率。

总结化学反应速率的影响因素化学反应速率是指在单位时间内反应物消耗或生成的量。
化学反应速率的大小不仅与反应物的性质有关,还与环境条件和其他因素密切相关。
本文将总结化学反应速率的影响因素,深入探讨各种因素对反应速率的影响。
一、物质的性质物质的性质对反应速率有很大的影响。
化学反应中,参与反应的物质分子需要发生相互作用才能发生化学反应。
物质的反应性越强,反应速率就越快。
比如,金属与酸反应,活泼金属如钠、铝与酸反应速率较快,而稳定的金属如铜、银与酸反应速率较慢。
二、温度温度对化学反应速率的影响是最为显著的。
在一定范围内,随着温度的升高,分子的平均动能增加,反应物的分子运动速度加快,发生碰撞的机会增加,因此反应速率增大。
例如,在低温下,一般的化学反应速率较慢,但是当温度升高到一定程度,反应速率会显著增加。
三、浓度浓度是影响反应速率的重要因素之一。
反应物浓度越高,反应物分子间的相互碰撞机会就越多,因此反应速率也就越快。
当浓度减小时,分子间的碰撞机会减少,反应速率也会明显下降。
因此,控制反应物浓度可以改变化学反应速率。
四、催化剂催化剂可以明显提高反应的速率,同时又不参与反应本身。
催化剂能够降低反应物分子间的碰撞活化能,使反应通道更易通过。
催化剂在反应过程中循环使用,可以提高反应的效率和速率。
例如,工业上常用的催化剂有铂、镍、酶等。
五、表面积反应物的表面积也会影响反应速率。
当反应物处于固体状态时,将固体细分、使表面积增大,可以提高反应速率。
因为反应发生在物质的表面上,更大的表面积意味着更多的分子与反应物接触,从而加快反应速率。
六、压力当反应物为气体时,压力的变化也会影响反应速率。
增加压力可以增加气体分子的浓度,从而提高分子碰撞的频率,加快反应速率。
这是因为高压下,气体分子的密度增加,分子之间的碰撞概率增大。
综上所述,化学反应速率受到多种因素的影响,包括物质的性质、温度、浓度、催化剂、表面积和压力。
通过控制这些因素,可以调节和控制化学反应速率,对一些特定的反应体系进行优化,提高反应效率。

化学反应速率影响因素1.反应物浓度:反应物浓度的增加通常会导致反应速率的增加。
这是因为反应物浓度的增加会增加反应物之间的碰撞频率,从而增加反应速率。
反应物浓度的增加还会导致反应中分子间的碰撞发生频率增加,增加了反应发生的机会。
2.温度:温度的增加通常会导致反应速率的增加。
这是因为在较高温度下,分子的平均动能增加,使得分子之间的碰撞具有更多的能量。
这种更高的能量使得碰撞更有可能成功地克服反应的活化能,从而增加了反应速率。
3.催化剂:催化剂是一种可以增加反应速率的物质。
催化剂通过提供一个可以降低反应过渡态能量的反应路径来增加反应速率。
催化剂通常会与反应物反应生成一个中间产物,然后再解离生成反应产物。
由于催化剂参与反应的数量较小,可以在多个反应周期中重复使用,所以催化剂可以极大地增加反应速率。
4.表面积:当反应物处于固体或液体界面时,反应物的表面积对反应速率有重要影响。
表面积的增加会导致反应物和其他反应物之间的接触面积增加,从而增加反应发生的机会和速率。
例如,将固体反应物粉碎成粉末,会增加反应物的表面积,从而加快反应速率。
5.反应物的物理状态:不同物理状态的反应物对反应速率有不同的影响。
一般而言,气体反应物的速率较快,液体反应物的速率次之,而固体反应物的速率最慢。
这是因为气体分子比液体和固体分子更具自由度,可以更自由地运动并碰撞。
此外,还有其他因素也可能影响化学反应速率,例如压力、溶剂、化学反应机制等。
这些因素会根据不同的反应而有所变化。
了解和控制这些因素对于合理设计和改进化学反应过程是非常重要的。

化学反应速率及影响因素化学反应速率是指在一定时间内,反应物消耗的量或生成物产生的量与时间的比值。
研究化学反应速率及其影响因素对于理解化学反应机理、优化反应条件以及工业生产等方面具有重要意义。
本文将介绍化学反应速率的概念,常见的影响因素以及如何控制反应速率。
一、化学反应速率的定义化学反应速率指的是在反应物浓度一定的情况下,单位时间内反应物消耗的量或生成物产生的量。
速率可以用实验中的数据推测,也可以根据化学方程式推算。
通常,表示化学反应速率的公式可以用如下形式表达:速率= Δ浓度/Δ时间其中,Δ浓度表示反应物浓度或生成物浓度的变化量,Δ时间表示时间的变化量。
二、影响化学反应速率的因素1. 反应物浓度:反应物浓度的增加会导致反应物分子之间的碰撞频率增加,从而提高了反应速率。
根据速率与浓度的关系,可以得到以下指数关系式:速率 = k[A]^m[B]^n其中,k为速率常数,[A]和[B]分别表示反应物的浓度,m和n表示反应物对速率的反应阶数。
2. 温度:温度的增加会提高反应物的动力学能量,使反应物分子的平均碰撞能量增加,从而增加了反应速率。
根据阿伦尼乌斯方程,可以得到以下指数关系式:反应速率 = A × e^(-Ea/RT)其中,A为指前因子,Ea为活化能,R为气体常数,T为温度。
3. 催化剂:催化剂能够降低活化能,提高反应速率,但不参与反应本身。
催化剂通过提供反应物的合适反应场所或改变反应物的电子环境来促进反应的进行。
4. 反应物表面积:反应物的粒子越小,表面积越大,反应速率越快。
这是因为反应发生在反应物粒子之间的界面上,表面积越大,碰撞频率越高。
5. 反应物间隔离程度:反应物之间的距离越近,反应速率越快。
反应物分子间的碰撞频率与它们之间的距离成反比。
三、控制化学反应速率的方法1. 温度控制:通过控制反应温度,可以提高或降低反应速率。
增加温度可以加快反应速率,降低温度则相反。
2. 浓度控制:增加反应物浓度可以提高反应速率,减少反应物浓度则相反。
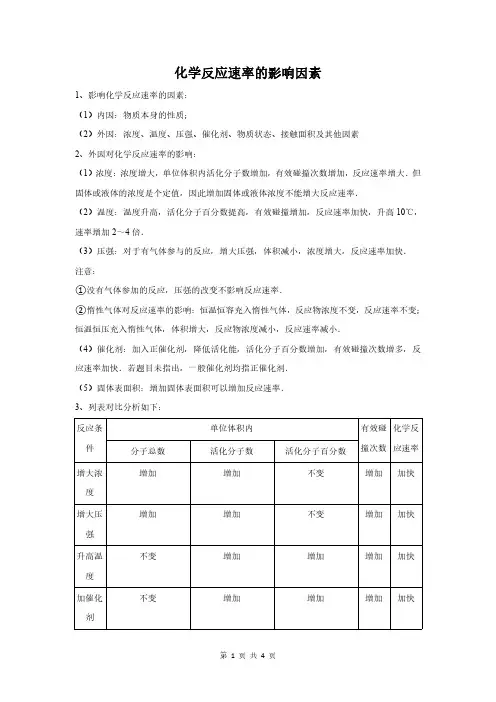
化学反应速率的影响因素1、影响化学反应速率的因素:(1)内因:物质本身的性质;(2)外因:浓度、温度、压强、催化剂、物质状态、接触面积及其他因素2、外因对化学反应速率的影响:(1)浓度:浓度增大,单位体积内活化分子数增加,有效碰撞次数增加,反应速率增大.但固体或液体的浓度是个定值,因此增加固体或液体浓度不能增大反应速率.(2)温度:温度升高,活化分子百分数提高,有效碰撞增加,反应速率加快,升高10℃,速率增加2~4倍.(3)压强:对于有气体参与的反应,增大压强,体积减小,浓度增大,反应速率加快.注意:①没有气体参加的反应,压强的改变不影响反应速率.②惰性气体对反应速率的影响:恒温恒容充入惰性气体,反应物浓度不变,反应速率不变;恒温恒压充入惰性气体,体积增大,反应物浓度减小,反应速率减小.(4)催化剂:加入正催化剂,降低活化能,活化分子百分数增加,有效碰撞次数增多,反应速率加快.若题目未指出,一般催化剂均指正催化剂.(5)固体表面积:增加固体表面积可以增加反应速率.3、列表对比分析如下:反应条件单位体积内有效碰撞次数化学反应速率分子总数活化分子数活化分子百分数增大浓度增加增加不变增加加快增大压强增加增加不变增加加快升高温度不变增加增加增加加快加催化剂不变增加增加增加加快【命题方向】题型一:化学反应速率的影响因素综合典例1:下列措施肯定能使化学反应速率增大的是()A.增大反应物的量B.增加压强C.升高温度D.使用催化剂分析:一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,但需要注意一些特例情况,以此来解答.解答:A.若反应物为纯固体或纯液体,增大反应物的量,反应速率不变,故A不选;B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B不选;C.因升高温度,活化分子百分数增大,反应速率加快,故C选;D.催化剂能改变反应速率,可加快也可减慢,故D不选;故选C.点评:本题考查影响化学反应速率的因素,注意物质的状态、反应的特点来分析影响反应速率的因素,题目难度不大.典例2:用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是()A.加热B.不用稀硫酸,改用98%浓硫酸C.加水稀释硫酸D.不用铁片,改用铁粉分析:加快生成氢气的速率,可增大浓度,升高温度,增大固体的表面积以及形成原电池反应,反之不能,以此解答.解答:A.加热,增大活化分子的百分数,反应速率增大,故A不选;B.因浓硫酸具有强氧化性,铁与浓硫酸反应生成二氧化硫而不生成氢气,故B选;C.加水稀释硫酸,浓度降低,反应速率减小,故C选;D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.故选BC.点评:本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.题型二:压强对反应速率的影响典例2:反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率减小的是()A.增加C的量B.将容器体积缩小一半C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大分析:A.增大固体的量对反应速率没有影响;B.将体积缩小,反应物的浓度增大,反应速率增大;C.保持体积不变,充入与反应无关的气体,反应速率不变;D.保持压强不变,充入与反应无关的气体,容器体积增大,浓度减小.解答:A.C为固体,固体浓度为定值,增大固体的量对反应速率没有影响,故A错误;B.将体积缩小,气体的浓度增大,反应速率增大,故B错误;C.保持体积不变,充入氮气,但氮气不参加反应,由于参加反应的气体的浓度不变,反应速率不变,故C错误;D.保持压强不变,充入氮气,但氮气不参加反应,由于容器体积增大,浓度减小,反应速率减小,故D正确.故选D.点评:本题考查影响化学反应速率的因素,题目难度不大,本题注意固体对反应速率没有影响,易错点为C、D,注意加入与反应无关的气体对参加反应的气体的浓度的影响.题型三:影响因素综合分析典例3:(2013•福建模拟)把在空气中久置的铝片5.0g投入盛有500mL0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是()A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高C.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低D.t=c时反应处平衡状态分析:A、根据铝的表面有一层致密的氧化膜;B、金属和酸的反应是放热反应,根据温度对化学反应速率的影响分析;C、溶液的浓度影响化学反应速率;D、反应不是可逆反应,t=c时反应速率最大.解答:A、因铝的表面有一层致密的Al2O3能与HCl反应得到盐和水,无氢气放出,发生的反应为Al2O3+6HCl=2AlCl3+3H2O,故A正确;B、在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,故B正确;C、随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,故C正确;D、反应不是可逆反应,当t<c时,温度对速率的影响比浓度的影响大,因此速率上升,t >c时,温度影响不是主要因素,浓度减少是主要因素,反应速率下降,t=c时反应速率最大,故D错误.故选D.点评:本题主要考查了影响化学反应速率的因素,关键是分析图象结合外界条件对化学反应速率的影响等知识点来解答,难度不大.【解题方法点拨】对于该考点,需要注意以下几点:①升高温度一定能加快反应速率;增加物质浓度不一定能改变反应速率(固体、纯液体和不参与反应的物质不行);增大压强不一定能加快反应速率(注意两种情况:①无气体参与的反应;②加入惰性气体);催化剂有正负之分.②当反应速率受多个因素影响时,要分情况讨论.。

化学平衡反应速率及影响因素分析化学反应是物质转化过程中发生的变化。
其中,反应速率是指单位时间内反应物消耗量或产物生成量的变化速率。
了解化学反应速率及其影响因素对于理解反应机理、优化反应条件以及控制化学过程具有重要意义。
在化学平衡反应中,反应速率的分析尤为重要。
反应速率的定义是单位时间内反应物消耗量或产物生成量的变化速率。
在化学平衡反应中,反应物逐渐转化为产物,并且在一定条件下达到平衡状态。
此时,反应速率的变化是非常有限的。
化学平衡反应速率的分析需要考虑以下几个因素:1. 浓度变化:在化学反应中,反应物与反应速率之间存在一定的关系。
根据反应物的浓度变化,可以确定反应速率的变化趋势。
一般来说,反应物浓度越高,反应速率越快,反之亦然。
这是因为高浓度下反应物之间的碰撞频率增加,进而增加了反应速率。
2. 温度变化:温度是影响化学反应速率的重要因素之一。
根据化学动力学理论,反应速率和温度之间存在一个指数关系。
随着温度的升高,反应物分子的平均动能增加,反应物分子之间的碰撞频率和碰撞能量也增加,从而提高了反应速率。
3. 催化剂的存在:催化剂是可以改变反应速率的物质。
催化剂通常通过提供可供分子反应的表面,提供反应物之间相互作用的位置,从而降低反应的活化能。
催化剂能够促进化学平衡反应的进行,加快反应速率。
在化学平衡反应中,反应速率的分析还需要考虑反应物的摩尔比例以及反应物的物理性质等因素。
此外,其他影响化学反应速率的因素包括媒介(溶剂)效应、离子强度、光照等因素。
这些因素都可以进一步调节化学反应速率,达到控制反应的目的。
除了以上因素,还有以下几个常见的影响化学平衡反应速率的因素:1. 压力:在气相反应中,压力是影响反应速率的重要因素之一。
根据理想气体定律,压强和气体的摩尔浓度成正比。
因此,增加反应物的压力可以有效地增加反应物分子之间的碰撞频率,从而提高反应速率。
2. 表面积:反应物的表面积对于固体相反应速率的影响非常显著。

影响化学反应速率的因素和具体的影响方式(1)反应物的浓度:反应物的浓度越大.反应速率越快。
(2)反应物间的接触面积:反应物间的接触面积越大,反应速率越快。
(3)反应的温度:反应时的温度越高。
反应速率越快。
(4)有无催化剂及催化剂的种类:一般情况下,催化剂可以加快反应速率;在有的反应中,不同种类的催化剂对化学反应速率的影响不同。
化学反应速率定义:化学反应速率就是化学反应进行的快慢程度(平均反应速率)。
外在因素对化学反应速率的影响对于同一个化学反应,若外界条件出现不同,反应发生的速率也不会相同,对于化学反应速率的外在影响,主要有温度、催化剂、浓度、压强等。
温度在化学反应的过程中,增加温度,会导致正逆化学反应速率发生增大,对于吸热反应增大的程度会更大一些,若降低温度,则会导致正逆化学反应速率减小,对于吸热反应减少的更小。
由此可见,温度变化将会导致反应物分子的能量发生改变,若升高温度,分子获得更多的能量,特别是一些能量较低的分子,获得的能量更多,将会变成活化分子,从而使得运动频率增加,Z终影响到化学反应速率的增加。
若温度降低,一些分子获得的能量将较少,活化的分子因缺少能量而运动频率降低,从而影响到化学反应速率的降低。
2、催化剂催化剂主要有两种,一是负催化剂,一是正催化剂。
顾名思义,正催化剂的作用就是加快化学反应的速率,负催化剂是减慢化学反应速率。
在正常的使用过程中,我们多是使用正催化剂,它能够使更多的反应物分子转变成活化分子,使得化学反应速率增大。
浓度对于一个可逆反应,当其他条件不发生改变的时候,若减少反应物的浓度,则会导致正反应的速率出现下降,若减少生成物的浓度,则会导致逆反应的速度降低。
反之,若在化学反应进行的过程中,采取增加反应物浓度的方式,则会导致正反应的速率出现增加,若增大生成物的浓度,则会导致逆反应的速率出现增大。
出现以上现象Z主要的原因是由于在其他条件不发生改变的情况下,活化分子数在反应物中所占的比例是固定的,只有增加了活化分子数的百分比,才会导致浓度发生改变,从而引起化学反应速率的变化。

化学反应速率及其影响因素化学反应速率及其影响因素2023年,我们生活在一个高科技的时代,科技的进步让我们对化学反应速率有了更深入的理解。
化学反应速率是指化学反应中反应物的消耗量和产物的生成量随时间变化的快慢程度。
这是一个非常重要的概念,因为化学反应速率可以影响到我们生活中的很多方面。
影响化学反应速率的因素有很多,其中最重要的因素是温度。
温度对化学反应速率的影响是非常大的,因为随着温度的升高,反应物的分子运动速度也会变快。
这样一来,反应物之间的碰撞概率也就增大了,反应速率也就变快了。
如果反应物之间的碰撞不够频繁,化学反应速率就会非常缓慢。
除了温度之外,还有很多其他的因素也会影响到化学反应速率,比如浓度、表面积、催化剂等。
浓度指的是反应物在单位体积内的含量,通俗来讲就是越多越容易反应。
表面积指的是反应物的表面积与其体积之比,表面积越大,反应速率也就越快。
而催化剂则是可以加速反应速率的物质,它们并不直接参与反应,只是稳定反应物或助催化剂的作用。
此外,光照、气压和溶液中离子的种类和浓度等因素都会影响化学反应速率。
光照引起的化学反应被称为光化学反应,常见于自然的光合作用和光解作用等。
气压对反应速率的影响主要表现在气态反应中,一般情况下,气压越高,分子之间的碰撞越频繁,反应速率就越快。
在溶液中,离子的种类和浓度也会影响到反应速率,其中离子浓度越高,反应速率也就越大。
最后,我们还需要了解化学反应速率的计算方法。
通常情况下,使用反应物消耗量随时间的变化来描述反应速率,即通过测量两个时刻之间反应物浓度的变化量对时间的比值来计算反应速率。
另外,还有微分法和整除法等计算反应速率的方法,但这些方法相对复杂,需要更深入的理解。
总之,化学反应速率及其影响因素在我们生活中都非常重要。
只有深入了解这些概念,我们才能更好地掌握化学反应的本质,应用化学知识解决实际问题。

化学反应和反应速率的主要影响因素化学反应是化学变化的过程,化学反应产生新的化学物质,通常涉及原子、离子、分子的重排、组合和分解。
不同的物质在进行化学反应时会产生不同的反应速率,反应速率是指单位时间内反应物消耗量的变化量。
而化学反应和反应速率受到许多因素的影响,下面我们就来探讨一下这些影响因素。
一、反应物浓度反应物浓度是影响化学反应速率的重要因素之一。
反应物浓度越高,反应速率就越快。
这是因为反应物浓度越高,反应物在单位时间内碰撞的次数就越多,碰撞的频率也就越高,因此反应速率也就越快。
例如,酸和碱反应时,加入更多的酸或碱可以加快反应速率。
因为在更高的浓度下,反应物分子之间的碰撞频率就越高,反应就越容易发生。
二、温度温度也是影响化学反应速率的关键因素。
温度越高,反应速率就越快。
这是因为高温下,反应物分子的平均能量增加,碰撞的能量也就越大。
大的碰撞能量可以使分子之间的化学键容易断裂,反应就更容易发生。
例如,火柴在摩擦时会产生热量,如果热量足够高,就会点燃火柴。
这是因为火柴上的化学物质在高温下可以快速反应,从而产生火焰。
三、反应物表面积反应物的表面积也可以影响化学反应速率。
通常来说,表面积越大,反应速率就越快。
因为表面积越大,反应物分子间的碰撞次数就越多,因此反应就越容易发生。
例如,将一块糖放入水中,比将糖粉放入相同体积的水中需要更多的时间来完全溶解。
糖块的表面积比糖粉小得多,因此需要更多的时间才能使糖分子与水分子发生反应。
四、催化剂催化剂是另一种可以影响化学反应速率的化学物质。
催化剂可以加速反应速率,但并不直接参与反应。
催化剂能够降低反应的活化能,从而使反应更容易发生。
催化剂通常只需要非常小的量就可以加速大量反应的发生。
例如,生物体中的酶就是一种催化剂。
酶可以加速化学反应,帮助身体在更短的时间内消化食物,从而为身体提供能量。
总结化学反应和反应速率是涉及到我们生活中许多方面的化学变化。
反应物浓度、温度、反应物表面积和催化剂是影响反应速率的主要因素。

考点过关(上)考点 2 影响化学反应速率的因素化学反应速率是定量描述化学反应进行快慢程度的物理量。
通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
其数学表达式为v =ΔcΔt或v =ΔnV ·Δt 。
影响化学反应速率的主要因素是反应物本身的性质,不同化学反应具有不同的反应速率,外界条件对化学反应速率也产生影响,外界条件包括浓度、温度、压强、催化剂、反应物颗粒大小等。
1.浓度:浓度增大,单位体积内活化分子数增多(活化分子百分数不变),有效碰撞的几率增加,化学反应速率增大。
浓度改变,可使气体间或溶液中的化学反应速率发生改变。
固体或纯液体的浓度可视为常数,它们的物质的量的变化不会引起反应速率的变化,但固体颗粒的大小会导致接触面积的变化,故影响化学反应速率。
2.压强:改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。
对于有气体参加的反应体系,有以下几种情况:(1)恒温时:增大压强――→引起体积缩小――→引起浓度增大――→引起反应速率增大。
(2)恒容时:充入气体反应物――→引起反应物浓度增大――→引起总压强增大――→引起反应速率增大;充入“稀有气体”――→引起总压强增大,但各物质的浓度不变,反应速率不变。
(3)恒压时:充入“稀有气体”――→引起体积增大――→引起各物质浓度减小――→引起反应速率减小。
压强是否影响化学反应速率,取决于是否影响反应物的浓度。
如恒容下充入稀有气体,气体压强增大,但反应物浓度不变,故反应速率不变。
恒压下充入稀有气体,气体压强不变,但体积增大,反应物浓度减小,反应速率减小。
3.温度:所有化学反应的反应速率都与温度有关。
温度升高,活化分子百分数提高,分子间的碰撞频率提高,化学反应速率增大。
温度升高,吸热反应和放热反应的速率都增大。
实验测得,温度每升高10 ℃,化学反应速率通常增大为原来的2~4倍。
对于可逆反应来说,升高体系的温度,反应物和生成物中的活化分子数都增加,所以正反应的速率和逆反应的速率都增大。

化学元素知识:化学反应速率-化学反应的速度和影响因素化学反应速率是对于化学反应进行研究时比较重要的一个参数,它与化学反应的速度有着密不可分的关系。
化学反应速率描述了化学反应过程中反应物的浓度随时间的变化率,即化学反应速度。
而化学反应速度又受到多种因素的影响,本文将从化学反应速度和影响因素两个方面来探讨化学反应速率这一研究领域的相关内容。
一、化学反应速率化学反应速率,又称反应速度,是指化学反应物质反应进程中所消耗或生成的物质量的变化率。
通常情况下,我们会根据反应物消耗或生成的时间来计算化学反应速率。
化学反应速率的大小直接决定了化学反应过程中的能量消耗和生成,以及所需的反应时间。
因此,深入了解化学反应速率所受影响因素,对于很多研究领域都有着重要作用。
1.1化学反应速率的计算方法一般情况下,化学反应速率的计算是基于化学反应速率方程式进行的。
化学反应速率方程式是指用化学反应物质量或浓度随时间的变化率来描述化学反应过程的数学等式。
因此,我们可以通过实验来确定不同反应物质质量随时间的变化来计算化学反应速率。
1.2化学反应速率的影响因素化学反应速率受到多种因素的影响,其中主要包括反应物浓度、温度、催化剂和反应物表面积等。
下面我们将分别对这些影响因素进行简单的介绍。
1.2.1反应物浓度反应物浓度是影响化学反应速率的主要因素之一。
随着反应物浓度的增加,化学反应速率也会随之增加。
这是因为反应物浓度增加会导致碰撞的频率增加,从而使化学反应加速。
同时,由于反应物浓度的变化对于化学反应速率有着很大的影响,因此在化学反应研究中经常会对反应物浓度进行控制。
1.2.2温度温度是影响化学反应速率的另一个关键因素。
随着温度的升高,化学反应速率也会增加。
这是因为高温下分子的平均动能增加,导致分子间的碰撞能量增加,从而使反应速率增加。
实际上,温度对于化学反应速率的影响是十分显著的,因此在很多化学反应研究中都需要对反应体系的温度进行控制。
反应速率化学反应的速度反应速率是描述化学反应进行的快慢程度的重要指标,它表示单位时间内物质浓度的变化。
本文将介绍反应速率的概念、影响反应速率的因素以及调控反应速率的方法。
一、反应速率的概念反应速率是指在化学反应中,反应物消耗或生成的速度。
反应速率可以用反应物的浓度变化来表示,通常以浓度随时间的变化速率表示。
化学反应速率的计量单位常用摩尔/升·秒(mol/L·s)或摩尔/升·分钟(mol/L·min)等。
快速反应的速率常较大,而慢速反应则速率相对较小。
二、影响反应速率的因素1. 反应物浓度:反应物浓度的增加可以提高反应速率。
反应物浓度越高,反应物分子间的碰撞频率越高,从而促进反应的发生。
2. 温度:温度升高能够加快反应物分子的平均动能,增加分子间的碰撞力度和频率,因此提高了反应速率。
3. 压力(对气体反应):压力的增加会使气体分子的运动更加频繁,从而增加碰撞频率,促进反应的进行。
4. 催化剂:催化剂可以降低反应活化能,提供反应所需的活化能,从而加速反应速率。
催化剂在反应过程中参与反应,但在反应结束时会得到再生,因此可反复使用。
三、调控反应速率的方法1. 温度控制:根据化学反应的需要,调节反应体系的温度。
增加温度可以提高反应速率,降低温度则可以减缓反应速率。
2. 压力控制:对于气体反应,可以通过改变反应体系的压力来调节反应速率。
增加压力会增加分子间的碰撞频率,从而促进反应。
3. 反应物浓度控制:通过调节反应物的浓度,来控制反应速率。
增加浓度可以提高反应速率,减少浓度则反应变缓慢。
4. 使用催化剂:若反应中存在催化剂,则使用适量的催化剂可显著加速反应速率。
总结:反应速率是衡量化学反应快慢的重要指标,它可以通过多种方式进行调控。
我们可以通过控制温度、压力和反应物浓度来改变反应速率,同时使用催化剂也能有效加速反应。
了解反应速率的影响因素和调控方法对于理解化学反应过程以及应用该知识于工业生产中具有重要意义。
化学反应速率的影响因素1.反应物浓度:反应物浓度的增加会使反应物分子之间碰撞的机会增多,从而加快反应速率。
根据碰撞理论,化学反应发生是由于反应物分子之间有效碰撞所引发的。
而较高的反应物浓度意味着较高的反应物分子浓度,从而增加了反应物分子之间的有效碰撞的概率,加快了反应速率。
2.温度:温度对反应速率的影响十分显著。
温度升高会导致反应物分子的平均动能增加,使分子的碰撞频率增加且有更多的反应物分子具有足够的能量来克服活化能,从而加快反应速率。
根据阿累尼乌斯方程,反应速率随着温度的升高而指数增加。
3.催化剂:催化剂在化学反应中扮演着重要的角色。
催化剂可以降低化学反应的活化能,提供新的反应路径或改变反应物分子之间的碰撞方式,从而增加反应速率。
催化剂不参与反应过程,因此可以在反应结束后重新使用。
4.反应物表面积:反应物的表面积对反应速率也有较大影响。
表面积增大意味着反应物能更容易与其他反应物碰撞,因此提高了反应速率。
常见的方法是使用粉末状或颗粒状的反应物,具有较大的表面积。
5.反应物粒度:反应物颗粒的大小和粒度分布也会影响反应速率。
较小的颗粒具有较大的表面积,因此较容易与其他反应物分子发生有效碰撞,加快了反应速率。
6.光照:光照条件下的光化学反应速率受到光的强度、波长和光照时间的影响。
光能被吸收后,光化学反应可以被激活,并且光的能量可以用于激发反应物分子,使其获得充足的能量来发生反应。
因此,光的存在可以加速反应速率。
除了上述因素外,反应物之间的化学性质、反应体系中的溶剂性质和反应物的浓度也会对反应速率产生一定影响。
反应物的化学性质可能导致需要更高的能量才能发生反应,从而降低反应速率。
溶剂性质在一些溶解型反应中可以提供合适的环境,加速反应进行。
反应物浓度的变化也可能改变反应的速率,但这与反应物浓度的影响因素中的浓度是不同的。
在实际的化学反应过程中,这些因素往往同时存在并相互作用。
可以通过合理控制这些因素来优化反应条件,提高反应速率,以达到自身需求。
化学反应速率与影响因素化学反应速率是指化学反应物质转变为产物的速度,通常用反应物质消失或产物生成的速率来表示。
化学反应速率的大小与多种因素有关,下面将从浓度、温度、催化剂和表面积四个方面来探讨化学反应速率与影响因素。
一、浓度对化学反应速率的影响在化学反应中,反应物的浓度越高,分子碰撞的次数就越频繁,从而增加了反应的速率。
因此,浓度是影响化学反应速率的重要因素之一。
可以通过增加反应物的物质量或体积来提高反应物的浓度,从而加快反应速率。
二、温度对化学反应速率的影响温度是影响化学反应速率的另一个重要因素。
根据动能理论,反应物分子的平均动能与温度成正比。
提高温度会增加反应物分子的动能,使它们更容易克服活化能壁垒,从而增加反应速率。
换句话说,温度升高会增加分子的碰撞频率以及碰撞的有效能量,从而加快反应速率。
三、催化剂对化学反应速率的影响催化剂是一种能够提高反应速率但本身不参与反应的物质。
催化剂通过降低反应的活化能来加速反应速率。
它提供了一条反应途径,使反应物分子更容易达到活化能。
催化剂并不改变化学反应的末态和平衡常数,只是改变了反应的速率。
因此,催化剂在化学工业中具有广泛的应用。
四、表面积对化学反应速率的影响对于固体与气体反应,表面积也是一个重要的影响因素。
固体或液体的表面积越大,接触到气体或液体相的面积就越多,反应物更容易吸附在固体表面,从而增加反应的速率。
因此,在工业生产过程中常采用细粉末状物质作为催化剂或吸附剂,以增加反应物与固体表面的接触面积,提高反应速率。
综上所述,化学反应速率受多种因素的影响,包括浓度、温度、催化剂和表面积。
通过调控这些因素,可以有效地改变化学反应的速率。
理解和掌握这些影响因素对于合理设计和优化化学反应过程具有重要意义,对于提高反应效率和降低生产成本具有重要作用。
化学反应速率的影响因素与公式化学反应速率是指反应物转变成产物的速度。
在化学反应的过程中,有许多因素会影响反应的速率。
本文将从温度、浓度、催化剂和表面积四个方面来探讨化学反应速率的影响因素,并介绍一些与速率有关的公式。
一、温度的影响温度是影响化学反应速率的主要因素之一。
根据化学动力学理论,温度升高会增加反应物的动能,使分子运动更加剧烈,从而增加反应碰撞的频率和能量。
反应速率与温度之间符合阿伦尼乌斯方程,即速率常数k与温度呈指数关系:k = Ae^(-Ea/RT)其中,k为速率常数,A为反应前因子,Ea为活化能,R为气体常数,T为温度(单位为K)。
从公式中可以看出,温度的升高会导致速率常数的增加,从而加快反应速率。
二、浓度的影响浓度是影响化学反应速率的另一个重要因素。
根据碰撞理论,反应速率与反应物浓度的关系可以用速率方程表示。
一般而言,反应物浓度的增加会导致反应物分子之间的碰撞频率增加,从而增加反应速率。
对于一级反应来说,速率与反应物浓度的关系可以表示为:v = k[A]其中,v为反应速率,k为速率常数,[A]为反应物A的浓度。
从公式中可以看出,反应速率与反应物浓度呈正比关系。
三、催化剂的影响催化剂是一种可以改变反应速率而不直接参与反应的物质。
催化剂的存在可以提供一个新的反应路径,降低反应的活化能,从而加快反应速率。
根据势能图理论,催化剂能够通过形成更稳定的过渡态来促进反应的进行。
催化剂的添加可以改变反应的机理和速率方程,提高反应的效率。
四、表面积的影响对于涉及固体反应的化学反应而言,固体颗粒的表面积是一个重要的因素。
固体颗粒的表面积越大,与反应物接触的面积就越大,反应速率也就越快。
这是因为固体颗粒的表面可以提供更多的反应位点,从而增加反应物之间的碰撞频率。
例如,在金属催化剂催化下的氧化反应中,当金属表面积增大时,反应速率也会增加。
综上所述,化学反应速率受到温度、浓度、催化剂和表面积等因素的影响。
温度升高、浓度增大、催化剂的存在以及表面积的增大都会加快反应速率。
化学反应速率的影响因素及实验测定技巧化学反应速率是指化学反应在单位时间内转化的物质的数量。
研究化学反应速率的影响因素对于理解反应动力学以及工业生产和环境保护等方面具有重要意义。
本文将就化学反应速率的影响因素及实验测定技巧进行探讨。
一、影响化学反应速率的因素1. 反应物浓度反应物浓度是影响化学反应速率的重要因素之一。
通常情况下,反应物浓度越高,碰撞的机会越多,反应速率越快。
这是因为反应物浓度增加会导致反应物分子之间的相互碰撞频率增加,从而增加有效碰撞的可能性。
举个例子,硫酸和钠碱溶液反应生成盐和水,如果其中一方反应物浓度增加,反应速率将会增加。
2. 反应温度反应温度是影响化学反应速率的另一个重要因素。
一般来说,反应温度升高,分子的平均动能增加,相应地,分子的碰撞能量也增加。
这使得反应物分子更容易克服潜在能垒,从而促进了反应速率的增加。
例如,火焰的燃烧就是一个温度对反应速率影响的典型例子。
3. 催化剂催化剂是一种能够影响反应速率却在反应结束时不参与化学反应的物质。
催化剂通过提供一个新的反应途径,降低了反应的活化能,使得反应更容易发生。
催化剂能够提高反应速率的原因有很多,比如增加反应物分子的有效碰撞频率,或者改变反应物分子的构型,使得反应活性更高。
例如,铁催化剂在氨的合成过程中起到了重要的催化作用。
二、实验测定技巧1. 逐点法逐点法是一种常见的测定化学反应速率的方法。
该方法通过在不同时间点记录反应物浓度的变化,然后计算在每个时间点的反应速率。
实验中需要控制反应温度和反应物浓度等条件,并使用合适的仪器(如分光光度计等)进行测量和记录。
逐点法适用于反应速率变化较慢的反应。
2. 起止法起止法是另一种常用的测定化学反应速率的方法。
该方法通过记录反应物浓度在一个很短的时间段内变化的情况,然后计算反应速率。
实验中需要选择一个合适的时间窗口,并使用快速测量技术(如快速混合技术)来准确测量反应物浓度的变化。
起止法适用于反应速率变化较快的反应。
请解释一下反应速率以及如何影响它的因素反应速率是化学反应中物质浓度随时间变化的速度。
它是衡量化学反应快慢的物理量,单位通常是摩尔每升每秒(mol/L·s)或摩尔每升每小时(mol/L·h)。
反应速率不仅影响化学反应的结果,还影响化学反应的过程,因此,了解影响反应速率的因素对于理解和控制化学反应至关重要。
影响反应速率的因素主要有以下几个:
1. 反应物的浓度:一般来说,反应物的浓度越高,反应速率越快。
这是因为在单位体积内,反应物的分子数目越多,相互碰撞的机会就越多,从而加快了反应的速率。
2. 温度:一般来说,温度越高,反应速率越快。
这是由于高温可以提供更多的能量,使反应物的分子具有更高的活性和能量,从而更容易发生化学反应。
3. 催化剂:催化剂可以降低化学反应的活化能,增加反应物的活性,从而加速反应的速率。
不同的催化剂对不同的反应有不同的影响,因此选择合适的催化剂可以有效地提高反应速率。
4. 光辐射:某些化学反应可以在光的照射下进行,光辐射可以为反应物提供能量,增加其活性和能量,从而加速反应的速率。
5. 压力:对于涉及气体的化学反应,压力可以影响反应速率。
压力越大,气体分子的浓度越高,碰撞的频率越高,从而加快了反应的速率。
在实际的化学实验中,可以通过控制这些因素来调节反应速率。
了解这些因素对反应速率的影响有助于我们更好地控制化学实验的条件,获得更准确的结果。
同时,对于工业生产和科学研究中需要快速进行或缓慢进行的化学反应,通过调整这些因素,可以优化化学反应的条件,提高产物的质量和产量。
化学反应速率1.化学反应速率的定义:_________________________________________________。
2.化学反应速率的计算公式:v= ,单位:。
注意:(1)在同一个化学反应中,用不同物质所表示的化学反应速率,数值上可能是的(填“相等”或“不等”),但各反应速率所表示的意义是相同的,所以计算化学反应速率时,要注明具体物质;(2)在同一个化学反应中,用不同物质所表示的化学反应速率,其比值等于之比;(3)固体、纯液体在反应中可视为浓度,一般不用固体或纯液体来表示反应速率;3.化学反应速率的相关计算,常用“三段式”方法。
4.影响化学反应速率的内因:反应物自身的性质,如Na、Mg、Al与水反应的速率由大到小的顺序为:Na>Mg>Al。
5.影响化学反应速率的外因,可从分子碰撞理论解释(充分接触和有效碰撞):(1)浓度:其它条件相同时,增大反应物的浓度,化学反应速率加快;减少反应物的浓度,化学反应速率降低。
注意:纯固体、纯液体的浓度看作常数,故其反应速率与其用量无关。
(2)温度:其它条件相同时,升高温度,化学反应速率加快;降低温度,化学反应速率降低。
一般,温度每升高10℃,反应速率增大2—4倍。
(3)压强:其它条件相同时,增大气体反应物的压强,化学反应速率加快;减小气体反应物的压强,化学反应速率降低。
注意:①压强只影响气体反应的速率;②恒温、恒容充入“惰性气体”化学反应速率不变;恒温、恒压充入“惰性气体”,化学反应速率减小。
(4)固体反应物的表面积:其它条件相同时,固体反应物表面积越大,反应速率越大。
(5)催化剂:其它条件相同时,催化剂可以改变化学反应速率,大部分加快反应速率。
(6)其他外因:光波、电磁波、放射线、超声波和溶剂等。
6.硫代硫酸钠溶液和盐酸的化学反应方程式为:Na2S2O3 + 2HCl →2NaCl + S↓+SO2↑+H2O,Na2S2O3,还原剂是Na2S2O3,氧化产物是SO2,还原产物是S。
例1.(化学反应速率的基本计算与大小的比较)1.对于反应A2(g)+3B2(g)2AB3(g)来说,下列反应速率中表示该反应进行得最快的是(A)A.v(A2)=0.6 mol/(L·s)B.v(B2)=2.7 mol/(L·min)C.v(AB3)=12 mol/(L·min)D.v(A2)=6 mol/(L·min)例2.(“三段式”法计算反应速率、转化率等)2.将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)+a Q(g),2 min 后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是(B)A.a的值为2B.平衡时X的浓度为0.2 mol·L-1C.Y的转化率为60%D.反应速率v(Y)=0.3 mol·(L·min)-1例3.(化学反应速率图像分析)3.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是(C)A.该反应的化学方程式为3B+4D6A+2CB.反应进行到1 s时,v(A)=v(D)C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1D.反应进行到6 s时,各物质的平均反应速率相等C[A项,B、C为反应物,A、D为生成物;B项,v(A)≠v(D);D项,A、B、C、D的化学计量数不同,其各自的平均速率不同。
]例4.(影响化学反应速率的因素,尤其是理解压强对化学反应速率的影响)4.反应:C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(C)①增加木炭的量②将容器的体积缩小一半③保持体积不变,充入N2使体系压强增大④保持压强不变,充入Ne使容器体积变大A.①④B.②③C.①③D.②④变式训练:1.将气体A、B置于容积为2 L的密闭容器中,发生如下反应:4A(g)+B(g)2C(g)反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,则下列反应速率不正确的是(B)A.v(A)=0.05 mol/(L·s) B.v(B)=0.025 mol/(L·s)C.v(C)=0.025 mol/(L·s)D.v(B)=0.0125 mol/(L·s)2.已知反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是(D)A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)3.对于反应A2 + 3B2→ 2AB3,以下表示的化学反应速率中,速率最大的是(D )A.v(A2)=0.4 mol·L-1·min-1B.v(B2)=0.9 mol·L-1·min-1C.v(AB3)=0.6 mol·L-1·min-1D.v(A2)=0.01 mol·L-1·s-14.把0.6mol X气体和0.4mol Y气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)nZ(g)+2W(g).若5min末生成0.2mol W,若测知以Z浓度变化表示的平均反应速率为0.01mol/(L·min),则n的值为(D )A.4 B.3 C.2 D.15.(2014北京)一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解(溶液体积变化忽略不计)。
不同时刻测得生成O2的体积(已折算为标准状况)如下表。
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)C.反应至6 min时,c(H2O2)=0.30 mol/LD.反应至6 min时,H2O2分解了50%C [ 2H 2O 2=====催化剂2H 2O +O 2↑A .6 min 时,生成O 2的物质的量n (O 2)=22.4 mL×10-3 L/mL 22.4 L/mol=1×10-3 mol ,依据反应方程式,消耗n (H 2O 2)=2×10-3 mol ,所以0~6 min 时,v (H 2O 2)=2×10-3 mol 0.01 L×6 min≈3.3×10-2 mol/(L·min),A 正确。
B.6~10 min 时,生成O 2的物质的量n (O 2)=--3 L 22.4 L/mol≈0.335×10-3 mol ,依据反应方程式,消耗n (H 2O 2)=0.335×10-3 mol×2=0.67×10-3 mol ,6~10 min 时,v (H 2O 2)=0.67×10-3 mol 0.01 L×4 min≈1.68×10-2 mol/(L·min)<3.3×10-2 mol/(L·min),B 正确。
C.反应至6 min 时,消耗n (H 2O 2)=2×10-3 mol ,剩余n (H 2O 2)=0.40 mol/L×0.01 L -2×10-3 mol =2×10-3 mol ,c (H 2O 2)=2×10-3 mol 0.01 L=0.20 mol/L ,C 错误。
D.反应至6 min 时,消耗n (H 2O 2)=2×10-3 mol ,n (H 2O 2)总=4×10-3 mol ,所以H 2O 2分解了50%,D 正确。
]6.将4 mol A 气体和2 mol B 气体在2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若2 s 后测得C 的浓度为0.6 mol·L -1,现有下列几种说法:①用物质A 表示的反应的平均速率为0.3 mol·L -1·s -1②用物质B 表示的的反应的平均速率为0.6 mol·L -1·s -1③2 s 时,物质A 的转化率为70%④2 s 时,物质B 的浓度为0.7 mol·L -1,其中正确的是( B )A.①③B.①④C.②③D.③④7.一定条件下发生反应:3A(g) + 2B(g)x C(g) + 2D(g),在2 L 密闭容器中,把4 mol A 和2 mol B 混合,2 min 后达到平衡时生成1.6 mol C ,又测得反应速率v (B) = 0.2 mol /(L·min),则下列说法正确的是( C )A.x = 3B.物质B 的转化率为20%C.达到平衡时A 的浓度为1.4 mol·L –1D.平衡时气体压强是原来的0.94倍8.下列措施肯定能使化学反应速率增大的是( C )A.增大反应物的量B.增大压强C.升高温度D.使用催化剂9.下列四种情况中最早出现浑浊的是( C )A.10℃时,0.1 mol /L Na 2S 2O 3和0.1 mol /L H 2SO 4各 5 mLB.10℃时,0.1 mol /L Na 2S 2O 3和0.1 mol /L H 2SO 4 各5 mL ,加水10mLC.20℃时,0.1 mol /L Na 2S 2O 3和0.1 mol /L H 2SO 4各 5 mLD.20℃时,0.1mol /L Na 2S 2O 3和0.1 mol /L H 2SO 4各5 mL ,加水10 mL10.在2 L 密闭容器中充入2 mol SO 2和一定量O 2发生反应:2SO 2+O 22SO 3反应,反应进行4 min 时,测得n (SO 2)=0.4 mol ,则反应进行到2 min 时,容器中n (SO 2)为( D )A.1.6 molB.1.2 molC.大于1.6 molD.小于1.2 mol11.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( B )A.加热B.改用98%的硫酸C.滴加少量硫酸铜溶液D.改用铁粉12.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成H 2的总量,可向 盐酸中加入适量的( B )A.固体CH 3COONaB.Na 2SO 4溶液C.KNO 3溶液D.固体CuSO 413.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t )内产生气体体积(V )的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是(D ) 组别 对应曲线 c (HCl)/mol·L -1 反应温度/℃ 铁的状态A.第4B.第1组实验中盐酸的浓度大于2.5 mol·L -1C.第2组实验中盐酸的浓度等于2.5 mol·L -1D.第3组实验的反应温度低于30 ℃D [由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。