α1-抗胰蛋白酶在临床上的应用
- 格式:doc
- 大小:24.00 KB
- 文档页数:3


宁夏地区慢性阻塞性肺疾病血清α1-抗胰蛋白酶检测分析邱洁;张雅囡;陈娟;谭海;陆学兰;张锦【期刊名称】《中国现代医学杂志》【年(卷),期】2012(22)17【摘要】目的结合宁夏地区慢性阻塞性肺疾病(COPD)流行病学调查,探讨该地区α1-抗胰蛋白酶(α 1-AT)血清水平以及对COPD发病的影响.方法采用酶联免疫吸附实验法检测267例COPD患者及213例对照组α 1-AT血清水平.结果本研究入选的213例对照组中α 1-AT平均血清水平为(19.10±7.57 )g/L,267例COPD患者中α1-AT平均血清水平为(11.31±4.87 )g/L,COPD组α1-AT血清水平显著低于对照组(P=0.000).对照组中不吸烟组和吸烟组α1-AT值分别为(18.96±7.54)g/L、(18.33±7.66 )g/L; COPD组中不吸烟组和吸烟组α 1-AT值分别为(11.64±5.52)g/L、( 11.02±4.22 )g/L,对照组和COPD组两组之间α1-AT血清水平差异无统计学意义.对照组中回、汉族的α 1-AT值分别为(20.91±6.97 )g/L、(18.71±7.65)g/L;COPD组中回、汉族的α1-AT值分别为(11.03±4.75 )g/L、( 11.58±4.99 )g/L,对照组和COPD组回汉之间的α1-AT血清水平差异无统计学意义.对照组中城镇、乡村的α 1-AT值分别为(19.20±7.14)g/L、( 18.96±8.21 )g/L;COPD组中城镇、乡村的α1-AT值分别为(11.28±4.62 )g/L、(11.33±5.14 )g/L,对照组和COPD组城镇、乡村间的α 1-AT血清水平差异无统计学意义.结论对宁夏地区COPD进行流行病学调查显示,COPD组患者血清α 1-AT水平显著低于对照组,α1-AT的降低可能与COPD的发病有关.吸烟、回汉民族间、城乡对α1-AT血清水平无明显影响.【总页数】4页(P58-61)【作者】邱洁;张雅囡;陈娟;谭海;陆学兰;张锦【作者单位】宁夏医科大学总医院呼吸内科,宁夏银川750004;宁夏医科大学总医院呼吸内科,宁夏银川750004;宁夏医科大学总医院呼吸内科,宁夏银川750004;宁夏医科大学总医院呼吸内科,宁夏银川750004;宁夏医科大学总医院呼吸内科,宁夏银川750004;宁夏医科大学总医院呼吸内科,宁夏银川750004【正文语种】中文【中图分类】R563【相关文献】1.血清α1-抗胰蛋白酶和C反应蛋白水平与慢性阻塞性肺疾病的相关性研究 [J], 庞国菊;刘怀平2.低气温条件下中重度慢性阻塞性肺疾病患者血清α1-抗胰蛋白酶含量变化及临床意义 [J], 刘贤兵;陈传辉;张伟3.沙美特罗替卡松粉吸入剂对慢性阻塞性肺疾病肺气肿患者血清中性粒细胞弹性蛋白酶、α1-抗胰蛋白酶的影响 [J], 孙金林;陈旭东4.慢性阻塞性肺疾病稳定期患者血清α1-抗胰蛋白酶与气道炎症及肺功能的相关性研究 [J], 刘羽翔;杨汀;叶艳平;李晓斌;陈谨;叶寰;何耀红;李宁;席修明5.慢性阻塞性肺疾病患者血清α1-抗胰蛋白酶和白三烯变化的临床意义 [J], 付群因版权原因,仅展示原文概要,查看原文内容请购买。
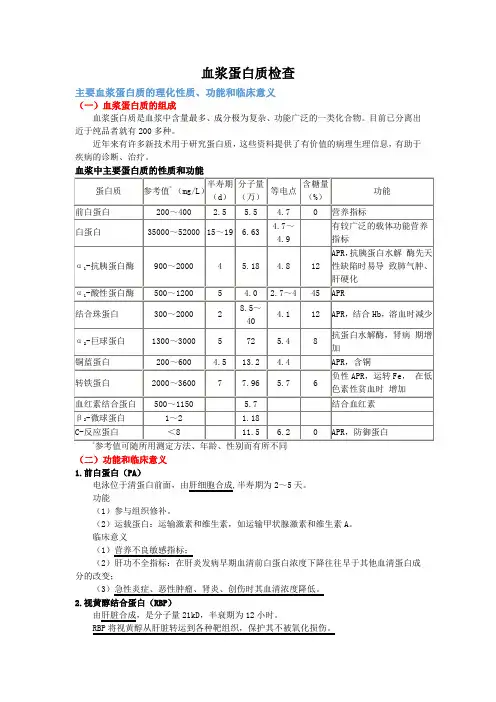
血浆蛋白质检查主要血浆蛋白质的理化性质、功能和临床意义(一)血浆蛋白质的组成血浆蛋白质是血浆中含量最多、成分极为复杂、功能广泛的一类化合物。
目前已分离出近于纯品者就有200多种。
近年来有许多新技术用于研究蛋白质,这些资料提供了有价值的病理生理信息,有助于疾病的诊断、治疗。
参考值可随所用测定方法、年龄、性别而有所不同(二)功能和临床意义1.前白蛋白(PA)电泳位于清蛋白前面,由肝细胞合成,半寿期为2~5天。
功能(1)参与组织修补。
(2)运载蛋白:运输激素和维生素,如运输甲状腺激素和维生素A。
临床意义(1)营养不良敏感指标;(2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变;(3)急性炎症、恶性肿瘤、肾炎、创伤时其血清浓度降低。
2.视黄醇结合蛋白(RBP)由肝脏合成,是分子量21kD,半衰期为12小时。
RBP将视黄醇从肝脏转运到各种靶组织,保护其不被氧化损伤。
在血浆中RBP与TTR(甲状腺素转运蛋白)以1:1结合,可避免小分子RBP从肾小球滤过。
在靶细胞内,随TTR-RBP复合物的降解,视黄醇被摄入细胞。
3.白蛋白(Alb)Alb由肝细胞合成。
白蛋白是血浆中含量最多的蛋白质,占总蛋白的57%~68%。
功能(1)内源性氨基酸营养源;(2)维持血浆的胶体渗透压;(3)具有酸碱缓冲能力,维持血浆的正常pH;(4)运输和储存作用:是血浆中主要的非特异性载体。
可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等。
因分子量较小,它在血管外体液中的浓度可作为各种膜屏障完整性的良好指标。
临床意义(1)个体营养状态的评价指标。
(2)血浆蛋白质浓度明显下降时,可以影响一些内源性的代谢物、激素和外源性的药物在血液循环中的存在形式。
(3)血浆的清蛋白增高较少见,血液浓缩如严重脱水、休克、饮水不足等。
(4)浓度降低见于①白蛋白合成降低,如急、慢性肝病;②营养或吸收不良;③组织损伤或炎症引起的白蛋白分解代谢增加如大面积组织损伤;④消耗性疾病(恶性肿瘤,严重感染等);⑤白蛋白异常丢失,如肾病综合征、慢性肾炎等;⑥白蛋白分布异常,如有门静脉高压腹水时;⑦遗传性疾病等。

α1-抗胰蛋白酶缺乏症有哪些症状?*导读:本文向您详细介绍α1-抗胰蛋白酶缺乏症症状,尤其是α1-抗胰蛋白酶缺乏症的早期症状,α1-抗胰蛋白酶缺乏症有什么表现?得了α1-抗胰蛋白酶缺乏症会怎样?以及α1-抗胰蛋白酶缺乏症有哪些并发病症,α1-抗胰蛋白酶缺乏症还会引起哪些疾病等方面内容。
……*α1-抗胰蛋白酶缺乏症常见症状:肝肿大、肝昏迷、门脉高压*一、症状高加索人群中,约1%~2%的肺气肿患者伴有α1-AT缺乏,80%~90%的PiZZ型个体有全小叶型肺气肿,其临床特点是:发病年龄早,呼吸道症状出现于30~40岁,早期症状为活动后呼吸困难,多有咳嗽和反复呼吸道感染,体检见病人有过度消瘦,呼吸音低;胸片示横膈低平,肺过度充气,外周血管减少,尤其是以肺小叶明显,肺功能提示严重肺气肿,肺总量受限,弥散量减低,血气分析检查提示:早期有轻至中度低氧血症,而无高碳酸血症;晚期患者低氧血症加重伴有高碳酸血症,心电图示右心室肥厚,可伴右束支传导阻滞。
*二、诊断临床表现结合病史可作出肺气肿的诊断,在高加索人群中凡是肺气肿患者均应除α1-AT缺乏症的可能性,可经血清蛋白电泳,醋酸纤维电泳,放射免疫扩散法和电泳免疫分析等免疫分析,还可测血清胰蛋白酶抑制活性,进一步作定型检查可帮助确诊α1-AT缺乏症。
*以上是对于α1-抗胰蛋白酶缺乏症的症状方面内容的相关叙述,下面再看下α1-抗胰蛋白酶缺乏症并发症,α1-抗胰蛋白酶缺乏症还会引起哪些疾病呢?*α1-抗胰蛋白酶缺乏症常见并发症:常见并发症、*一、并发病症并发高碳酸血症和呼吸衰竭。
*温馨提示:以上就是对于α1-抗胰蛋白酶缺乏症症状,α1-抗胰蛋白酶缺乏症并发症方面内容的介绍,更多疾病相关资料请关注疾病库,或者在站内搜索“α1-抗胰蛋白酶缺乏症”可以了解更多,希望可以帮助到您!。

阿尔法1球蛋白偏高的原因一、定义与正常范围1. 定义- α1 - 球蛋白是血清蛋白电泳中的一个组分,它包含多种蛋白质,如α1 - 抗胰蛋白酶等,在人体的生理功能中发挥着重要作用。
2. 正常范围- 不同检测方法和检测机构可能会有一定差异,但一般来说,α1 - 球蛋白在血清总蛋白中的正常占比约为2% - 5%。
二、偏高的原因1. 炎症反应- 当身体遭受感染时,无论是细菌感染(如肺炎球菌引起的肺炎)还是病毒感染(如流感病毒感染),免疫系统会被激活。
- 在炎症过程中,肝脏会合成更多的α1 - 球蛋白,尤其是α1 - 抗胰蛋白酶等成分。
这是一种机体的防御机制,α1 - 抗胰蛋白酶可以抑制炎症反应中释放的蛋白酶,防止组织过度损伤。
2. 肝脏疾病- 急性肝炎:在急性肝炎的早期阶段,肝细胞受到损伤后会发生一系列的病理生理变化。
肝脏细胞会增加α1 - 球蛋白的合成,试图修复受损组织和抵御可能的感染。
- 肝癌:肿瘤细胞会影响肝脏的正常功能,改变肝脏内蛋白质的合成和代谢模式。
肝癌细胞可能刺激周围的肝细胞或者肝脏内的免疫细胞,导致α1 - 球蛋白的合成增多。
同时,机体针对肿瘤产生的免疫反应也可能促使肝脏增加α1 - 球蛋白的产生。
3. 自身免疫性疾病- 例如类风湿关节炎,这是一种自身免疫性疾病,免疫系统错误地攻击自身关节组织。
在疾病过程中,身体处于慢性炎症状态,免疫系统持续激活。
- 这种慢性炎症会刺激肝脏增加α1 - 球蛋白的合成,以参与免疫调节和炎症抑制等过程。
4. 某些药物影响- 长期使用某些药物可能会影响肝脏的代谢功能,导致α1 - 球蛋白水平偏高。
例如,一些抗生素(如红霉素长期大剂量使用)或者抗癫痫药物(如苯妥英钠),这些药物在肝脏代谢过程中可能干扰肝脏正常的蛋白质合成调控机制,使得α1 - 球蛋白的合成增加。





蛋白质结构异常与人类疾病作者:叶渝洋16级医学院(深圳)17班学号:16353138摘要:随着国际人类蛋白质组计划(HPP)的进展,我们对人类蛋白质的生物效应有了更全面的认识,对蛋白质异常带来的人类疾病也有了进一步的了解。
蛋白质是生命活动的主要承担者【1】,蛋白质结构的异常往往会对其功能造成影响,并体现为人类疾病。
本文通过对镰刀细胞贫血症(sickle-cell anemia)、克雅氏病(CJD)、肺气肿(α1-AT缺乏症)、亨廷顿病(Huntington’s disease)几种典型蛋白质分子病的介绍,揭示蛋白质结构异常与人类疾病的关系。
Abstract: With the progress of HPP, We have a more comprehensive knowledge of biological effect of protein, and a further comprehension of human diseases caused by structurally abnormal protein. Protein is in charge of life 【1】, which can be influenced by its abnormal structure and causes diseases. Through the introduction of sickle-cell anemia, CJD, emphysema and Huntington’s disease, We’ll show the connection between structurally abnormal protein and human diseases.关键词:蛋白质结构镰刀细胞贫血症克雅氏病肺气肿亨廷顿病Keyword: protein structure sickle-cell anemia CJD emphysema Huntington’s disease(一)镰刀细胞贫血症镰刀细胞贫血症是最早被研究的分子病之一,主要在非洲黑种人群中流行。

肺气肿的有效治疗方法肺气肿是指终末细支气管远端的气道弹性减退,过度膨胀、充气和肺容积增大或同时伴有气道壁破坏的病理状态。
那么,对于肺气肿要怎么治疗呢?接下来,店铺就和大家分享肺气肿的有效治疗方法,希望对大家有帮助!肺气肿的病因环境因素(35%):引起慢支的各种因素如感染,吸烟,大气污染,职业性粉尘和有害气体的长期吸入,过敏等,均可引起阻塞性肺气肿。
机体因素(30%):弹性蛋白酶及其抑制因子失衡学说。
α1-抗胰蛋白酶缺乏和肺气肿关系的研究提示,肺气肿是由肺内的蛋白酶和抗蛋白酶含量的不平衡,使肺泡间隔破坏,大量肺气肿的动物模型支持这一假说,人类肺气肿的研究证明,弹性多肽的浓度在肺气肿的病人中增加,吸烟可增加弹性蛋白溶解活性,抑制肺的成纤维细胞的浸润,造成对弹性蛋白酶的组织敏感性增加,抑制了抗弹性蛋白酶的活性,这些发现支持吸烟使弹性蛋白酶和抗弹性蛋白酶的平衡被打破,从而造成肺的微细结构的破坏,引起肺气肿。
肺气肿的有效西医治疗方法肺气肿治疗包括一般内科治疗和外科手术治疗。
内科治疗肺气肿的内科治疗包括应用支气管扩张、祛痰剂,排除痰液,呼吸功能及体育锻炼,改善呼吸功能,加强营养,增加机体免疫力。
采用益肺、健脾、补肾等中药扶正固本。
发生呼吸道急性感染时,则须使用有效抗生素控制感染,并给予低流量吸氧,防止动脉血氧的急剧下降,有严重通气不足并发呼吸性酸中毒和神志改变者,则应进行人工机械辅助通气治疗。
1、适当应用舒张支气管药物,如氨茶碱,β2受体兴奋剂。
如有过敏因素存在,可适当选用皮质激素。
2、根据病原菌或经验应用有效抗生素,如青霉素、庆大霉素、环丙沙星、头孢菌素等。
3、呼吸功能锻炼作腹式呼吸,缩唇深慢呼气,以加强呼吸肌的活动。
增加膈的活动能力。
4、家庭氧疗,每天12-15h的给氧能延长寿命,若能达到每天24h的持续氧疗,效果更好。
5、物理治疗,视病情制定方案,例如气功、太极拳、呼吸操、定量行走或登梯练习。
6、预防。
α-1抗胰蛋白酶缺失:遗传性肝脏疾病导致肝细胞癌的一种新范例Rudnick D.A.;Perlmutter D.H.;李翔【期刊名称】《世界核心医学期刊文摘:胃肠病学分册》【年(卷),期】2006(0)1【摘要】Liver disease in alpha-1-antitrypsin (α 1AT) deficiency is caused by a gain-of-toxic function mechanism engendered by the accumulation of a mutant glycoprotein in the endoplasmic reticulum (ER). The extraordinary degree of variation in phenotypical expression of this liver disease is believed to be determined by genetic modifiers and/or environmental factors that influence the intracellular disposal of the mutant glycoprotein or the signal transduction pathways that are activated. Recent investigations suggest that a specific repertoire of signaling pathways are involved, including the autophagic response, mitochondrial-and ER-caspase activatio n, and nuclear factor kappa B (NFκ B) activation. Whether activation of these signaling pathways, presumably to protect the cell, inadvertently contributes to liver injury or perhaps protects the cell from one injury and, in so doing, predisposes it to another type of injury, such as hepatocarcinogenesis, is not yet known. Recent studies also suggest that hepatocytes with marked accumulation of α 1ATZ, globule-containing hepatocytes, engender a cancer-prone state by surviving with intrinsic damage and by ch ronically stimulating in‘ trans’ adjacentrelatively undamaged hepatocytes that have a selective proliferative advantage. Further, this paradigm may apply to other genetic and infectious liver diseases that are predisposed to hepatocellular carcinoma.【总页数】2页(P39-40)【关键词】肝脏疾病;抗胰蛋白酶;肝细胞癌;肝脏损伤;信号转导途径;基因表型;酶激活;球状体;变异程度;遗传修饰【作者】Rudnick D.A.;Perlmutter D.H.;李翔【作者单位】University of Pittsburgh School of Medicine, Children’ s Hospital of Pittsburgh, Department of Pediatrics, 3705 Fifth Avenue, Pittsburgh, PA 15213, United States Dr.【正文语种】中文【中图分类】R575;R735.7【相关文献】1.一种导致遗传性低纤维蛋白原血症的FGG基因新突变 [J], 王莹宇;丁红香;郝秀萍;朱丽青;杨丽红;金艳慧;王明山2.一种导致遗传性凝血因子Ⅻ缺陷症的FⅫ基因新突变 [J], 谢海啸;吕美艳;杨小丽;朱丽青;杨丽红;金艳慧;王明山3.一种新的FⅩⅢ基因突变导致的遗传性FⅩⅢ缺陷症 [J], 焦卫云;吴竞生;丁秋兰;王学锋;徐修才;丁凯阳;刘欣4.一种新的抗凝血酶基因突变导致遗传性抗凝血酶缺陷症 [J], 张付华;丁秋兰;吴竞生;周荣富;王学锋;徐修才5.一种新的FGA基因无义突变导致遗传性无纤维蛋白原血症 [J], 吴淑燕;王兆钺;董宁征;白霞;阮长耿因版权原因,仅展示原文概要,查看原文内容请购买。
α1抗胰蛋白酶缺乏性肝病有哪些症状?*导读:本文向您详细介绍α1抗胰蛋白酶缺乏性肝病症状,尤其是α1抗胰蛋白酶缺乏性肝病的早期症状,α1抗胰蛋白酶缺乏性肝病有什么表现?得了α1抗胰蛋白酶缺乏性肝病会怎样?以及α1抗胰蛋白酶缺乏性肝病有哪些并发病症,α1抗胰蛋白酶缺乏性肝病还会引起哪些疾病等方面内容。
……*α1抗胰蛋白酶缺乏性肝病常见症状:出血倾向、腹胀、肝脾肿大、肝功能衰竭*一、症状α1-AT缺乏性肝病可在婴幼儿期初次被发现,也可在此期无肝脏病变表现,到成年后出现慢性肝病表现,8%~12%的PiZZ 型α1抗胰蛋白酶缺乏的新生儿在出生后1个月内即发生胆汁淤积性黄疸,血清胆红素可高达340 μmol/L,血清碱性磷酸酶(ALP)活性可达150~1300U/L,患儿体重增加缓慢,嗜睡,易激怒,出现无胆汁粪便,3个月月龄的小儿半数出现高转氨酶血症,血清谷草转氨酶(AST)活性可达80~600U/L,12%~15%的α1抗胰蛋白酶缺乏患儿出现肝硬化病症,表现为腹胀,肝脾肿大,因食管静脉曲张引起的上消化道出血,也可有紫癜等其他部位出血倾向,大多数患者新生儿肝脏淤胆持续7个月左右至1年可消退,如无好转,则可逐渐发展出现进行性肝损害,进展为肝硬化甚至死亡,引起的肝硬化也可在成年时发生,但在中老年期才出现肝硬化者很少,成年期发病多见于杂合子型α1-AT缺乏性肝病患者,病情发展较缓慢,临床表现各异,有报道成人杂合子型α1-AT 缺乏性肝病患者肝功能衰竭的危险性明显增加,Sreger报告的120名PiZZ型新生儿中有14名长期有梗阻性黄疸,新生儿期肝炎和幼年期肝硬化,成年期肺气肿,成人α1抗胰蛋白酶缺乏肝硬化可无症状,可出现肝硬化的临床表现,也可伴发肝癌,多见于50岁以上的纯合子型患者。
对于任何非感染性慢性肝炎患者,原因未明的肝脾肿大,肝硬化和门静脉高压患者都应考虑有α1-AT缺乏性肝病的可能性,也应警惕少数肝癌是因α1-AT缺乏引起。
/α1抗胰蛋白酶缺乏性肝病常见的症状有哪些,α1抗胰蛋白酶缺乏性肝病的早期症状介绍α1抗胰蛋白酶缺乏性肝病的常见症状出血倾向、腹胀、肝脾肿大、肝功能衰竭α1抗胰蛋白酶缺乏性肝病有什么症状一、症状α1-AT缺乏性肝病可在婴幼儿期初次被发现,也可在此期无肝脏病变表现,到成年后出现慢性肝病表现,8%~12%的PiZZ型α1抗胰蛋白酶缺乏的新生儿在出生后1个月内即发生胆汁淤积性黄疸,血清胆红素可高达340 µmol/L,血清碱性磷酸酶(ALP)活性可达150~1300U/L,患儿体重增加缓慢,嗜睡,易激怒,出现无胆汁粪便,3个月月龄的小儿半数出现高转氨酶血症,血清谷草转氨酶(AST)活性可达80~600U/L,12%~15%的α1抗胰蛋白酶缺乏患儿出现肝硬化病症,表现为腹胀,肝脾肿大,因食管静脉曲张引起的上消化道出血,也可有紫癜等其他部位出血倾向,大多数患者新生儿肝脏淤胆持续7个月左右至1年可消退,如无好转,则可逐渐发展出现进行性肝损害,进展为肝硬化甚至死亡,引起的肝硬化也可在成年时发生,但在中老年期才出现肝硬化者很少,成年期发病多见于杂合子型α1-AT缺乏性肝病患者,病情发展较缓慢,临床表现各异,有报道成人杂合子型α1-AT缺乏性肝病患者肝功能衰竭的危险性明显增加,Sreger报告的120名PiZZ型新生儿中有14名长期有梗阻性黄疸,新生儿期肝炎和幼年期肝硬化,成年期肺气肿,成人α1抗胰蛋白酶缺乏肝硬化可无症状,可出现肝硬化的临床表现,也可伴发肝癌,多见于50岁以上的纯合子型患者。
对于任何非感染性慢性肝炎患者,原因未明的肝脾肿大,肝硬化和门静脉高压患者都应考虑有α1-AT缺乏性肝病的可能性,也应警惕少数肝癌是因α1-AT缺乏引起。
按起病缓急和病程进展,可分为缓进型和急进型,以缓进型多见。
二、诊断血清蛋白电泳可见α1球蛋白缺乏常提示该病,直接测定α1抗胰蛋白酶可确诊,但应重视遗传表型分析,因为α1-AT的产生受这些因素影响,所以诊断应根据表型分析,而不单根据α1-AT水平检测。
α1-抗胰蛋白酶在临床上的应用
肺气肿是慢性阻塞性肺疾的一种,造成的原因是肺泡持续反复接受到不可逆的损伤,细胞修补结痂后组织内的弹性纤维被胶原(Collagen)取代,导致肺泡的弹性下降,气体交换容积减小,最后造成肺囊泡塌陷,气体滞留在肺内,而形成肺气肿。
肺气肿的疾病病程与肺部内的弹性蛋白酶(elasrase)有很大的相关性。
体内为避免某些蛋白酶过度活跃,进而造成组织伤害,体内会产生一些蛋白酶抑制剂(ptotease inhibitor),和体内蛋白酶结合,以防止蛋白酶的过度作用并达到一个巧妙的平衡。
其中α1-antitrypsin(α1-抗胰蛋白酶,简称AAT)就是用来拮抗弹性蛋白酶的作用。
弹性蛋白酶是一种丝胺酸蛋白分解酶(serine protease),当嗜中性白血球受到外来抗原的刺激而产生。
它可以调解许多生理反应,如凝集反应与纤维蛋白溶解步骤。
而AAT是一个52KDα糖蛋白(glycoprotein),合成于肝脏并发布于血液及肺部的组织间液中。
在正常血浆中的AAT浓度约20-53μM,而在肺部AAT 的含量需维持相当于弹性蛋白酶活性的90%以上。
且血浆中最低的有效浓度不可低于11μM,否则弹性蛋白酶会过度活化,进而造成不可逆的伤害。
有些人先天AAT活性不足或缺乏,使得弹性蛋白酶相对的过度活化,这些AAT缺损(deficiency)的患者与吸烟者一样都为
肺气肿的高危险群,AAT缺损是一种遗传性疾病,这类患者体内的AAT基因功能异常,使得AAT的制造不足或活性变差,无法维持正常抑制蛋白酶的功能。
AAT缺损的首例在北欧发现,而在美国大约每2000-4000人就有一人是AAT缺损的患者。
若从流行病学来看,AAT缺乏且有烟瘾的患者会比不抽烟的伤害更大,气喘、下呼吸道感染、家族病史等,也会影响AAT 缺乏症的进展。
抽烟和环境中的部分物质会引发AAT的氧化、降低AAT的效用,而气喘及感染则会引起嗜中性白血球的活化导致弹性蛋白酶过度反应。
实际上,AAT缺乏又抽烟的患者在25岁之前并不会有明显的症状,往往在40岁才会出现呼吸困难及肺气肿的情形,并可能在60岁之前死亡。
治疗因AAT缺损而引起的肺功能下降,目前临床上是以施打AAT来补充患者体内的不足。
三者都是由人类血浆纯化得来,差别只在于纯化的步骤不同。
如Prolastin使用的是cold ethanol extraction method萃取,并以60±0.5℃;连同溶剂低温灭菌至少10小时,缺点是只靠单一的纯化步骤,无法得到较纯化的AAT 血浆制剂,仍然有许多的杂质存在(如C1-esterase inhibitor, antithrombinⅢ,immunoglobulinA等),而且只要是血浆制剂就无法排除是否存在一些未知的感染源。
Aralast是最新用来治疗α1-antitrypsin deficiency的α1 -ptotease inhibitor,它使用更多的纯化步骤(如离子交换层析法),减少可能存在血液中的感染源(如B型肝炎、C型肝炎、HIV),
并提高了单位含量中所含的有效活性。
在临床上,三者的治疗效果差别不大,建议使用剂量是每周静脉注射60mg/kg.
Aralast具有良好的耐受性及安全性,出现副作用的机率低,且目前尚没有严重的不良反应案例。
常用的副作用有头痛(0.3%)、嗜睡(0.3%);其它如寒颤、发烧、眩晕、搔痒、红疹、视力异常、胸痛、咳嗽及呼吸困难(0.1%)等。
目前临床研究证实,适时给予AAT产品可以延缓AAT缺损疾病的病程,延长病人的存活率。
但过去15年只有Prolastin可供这类患者使用,随着科学技术的进步,发展出更优良的纯化技术,陆续研制出Zemaira与Aralast,希望能给予AAT缺损的患者安全的用药及更多的选择。
参考文献:
……。