第7章 多环芳烃和非苯芳烃-2012
- 格式:pdf
- 大小:444.33 KB
- 文档页数:36


第七章? 多环芳烃和非苯芳烃
1. 环戊二烯为什么可以与Na反应?
解答:环戊二烯负离子具有芳性,稳定;故环戊二烯的氢酸性较强,可与Na反应。
2. 环庚三烯中的CH2上的H的酸性要比典型烯丙基H 的酸性小
解答:
无芳性,不稳定。
负离子较稳定。
3. 蓝烃的结构式为,判断其是否有芳性;如有,亲电取代反应发生在几元环上?
解答:为偶极分子:,有芳性。
亲电取代反应发生在电子云密度大的五元环上。
4. 下列化合物有芳香性的是()。
解答:A 、E 、F。
芳香性的判断: 休克尔规则,Π电子数满足4n+2,适用于单环、平面、共轭多烯体系。
对于多环体系,
处理如下:
5. 分子式为C8H14的A,能被高锰酸钾氧化,并能使溴的四氯化碳溶液褪色,但在汞盐催化
下不与稀硫酸作用。
A经臭氧化,再还原水解只得到一种分子式为C8H14O2的不带支链的
开链化合物。
推测A的结构,并用反应式加简要说明表示推断过程。
解答:
即环辛烯及环烯双键碳上含非支链取代基的分子式为C8H14O2的各种异构体,例如以上各种异构体。



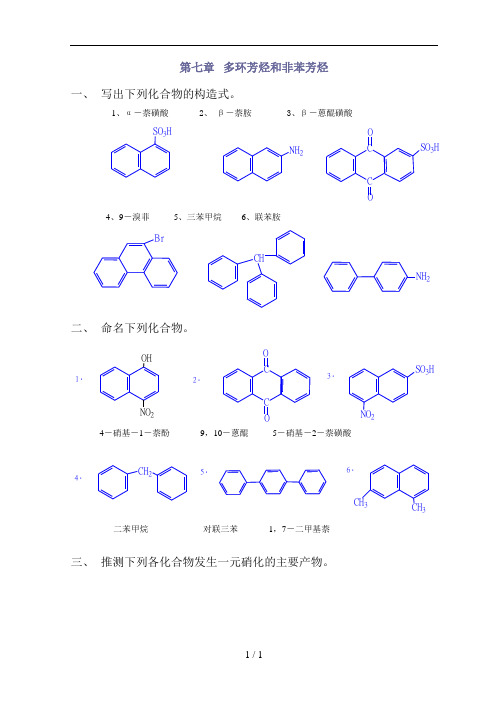
第七章 多环芳烃和非苯芳烃一、 写出下列化合物的构造式。
1、α-萘磺酸2、 β-萘胺3、β-蒽醌磺酸SO 3HNH 2C C OO SO 3H4、9-溴菲5、三苯甲烷6、联苯胺BrCHNH 2二、 命名下列化合物。
1.2.C COO 3.SO 3HNO 24.CH 25.6.CH 3CH 3OHNO 2二苯甲烷 对联三苯 1,7-二甲基萘三、 推测下列各化合物发生一元硝化的主要产物。
SO 3HSO 3H1.HNO 3H 2SO 4O 2NSO 3HNO 2+2.CH 3H 2SO 4HNO CH 3NO 23.OCH HNO 3H 2SO 4NO 2OCH4.CNCNNO 2HNO 3H 2SO 4NO 2CN四、 回答下列问题:1,环丁烯只在较低温度下才能生成,高于350K 即(如分子间发生双烯合成)转变为二聚体什么?写出二苯环丁烯三种异构体的构造式。
解:环丁二烯π-电子为四个,具有反芳香性,很不稳定,电子云不离域。
三种二苯基环丁二烯结构如下:2,1,3,5,7-环辛四烯能使高锰酸钾水溶液迅速褪色,和溴的四氯,已知它的衍生物二苯基环丁二烯,有三种异构体。
上述现象3 3化碳溶液作用得到C 8H8Br8。
(a),它具有什么样结构?这两个共振结构式表示?解:不可以,因为1,3,5,7-辛环四烯不具有离域键,不能用共振结构式表示。
(c),用金属钾和环辛四烯作用即得到一个稳定的化合物2K+C8H8(环辛四烯二负离子),这种盐的形成说明了什么?预期环辛四烯二负离子将具有怎样的结构?解:环辛四烯二负离子具有芳香性,热力学稳定,其结构为:五、写出萘与下列化合物反应所生成的主要产物的构造式和名称。
1,CrO3, CH3COOH 2,O2,V2O5 3, Na,C2H5OHOO C O CO O解:具有右式结构,不是平面的(b),π-电子云是离域的。
1,4-萘醌邻苯二甲酸酐 1,2-二氢萘4,浓硫酸,800C 5,HNO3,H2SO4 6,Br2α-萘磺酸α-硝基萘 1-溴萘7,H2,Pd-C加热,加压 8,浓硫酸,1650C四氢萘β-萘磺酸六、用苯、甲苯、萘以及其它必要试剂合成下列化合物:1.CH 2CH 3Cl ,hvCH 2ClAlCl 3CH 2ClCl 2FeCH 2Cl2.(C 6H 5)3CHCH 3Cl ,hvCHCl2AlCl 3(C 6H 5)3CH3.NO 2Br23H 2SO 424.NO 2SO 3HSO 3H NO 2SO 3HH 2SO 4165C3H 2SO 45.C C OOCO O COAlCl 3O 2,V 2O 5450CC COOHO 97%H 2SO 4C C OO七、 写出下列化合物中那些具有芳香性? 解:1.2.3..4.+5.6.7.8.9.10.H HH HHH11.CH 2=CHCH=CHCH=CH 2代表有芳香性代表无芳香性。
第7章多环芳烃和非苯芳烃
按照苯环相互联结方式
1.联苯、多连苯类;
2.多苯取代的脂肪烃;
3.稠环芳烃。
多苯代脂肪烃:
二苯甲烷
1,2-二苯乙烯
联苯、多联苯:
稠环芳烃:
联苯
对联三苯
7.1 联苯及其衍生物
H
+
o
2
乌尔曼反应(Ullmann Reaction)
I
+ 2 Cu
24
5 7.1.1 联苯的制备和命名
22
22次
联苯与苯相似,在两个苯环上均可发生磺化、硝化、卤代等亲电取代反应;若一个环上有活化基团,则取代反应发生在同环上;若一个环上有钝化基团,则取代反应发生在异环;4,4’-二硝基联苯
2,4’-二硝基联苯
7.1.2 联苯的化学性质
苯基(邻对位取代基)取代基,
主要进入苯基的对位。
7.1.3 联苯衍生物的立体异构
由于两个环的邻位有取代基存在时,由于取代基的空间阻碍联苯分子的自由旋转。
产生异构体。
2
7.2 稠环芳烃
7.2.1
萘及其衍生物
(一) 萘的结构
β
β
β
α'
β
'
2
3
4
5
6
7
•萘分子结构的共振结构式:
萘分子C原子的编号:
(二) 萘的命名
3
2
1-氯萘(α-氯萘)
2-氯萘(β-氯萘)
1,5-二硝基萘
4-甲基-1-萘磺酸
对甲基萘磺酸
24
6
76
726
732
(三) 萘的性质
3傅-克酰基化反应:
热力学控制
NH4HSO3
H2O, 150 o C
NH
2
NaHSO3
布赫雷尔(Bucherer)反应
是一个可逆的反应
*(2) 萘环二取代的定位规则:
v 1-位上有活化基,第二取代基进入4-位:
v 2-位有活化基,苯二取代基进入1位:
3(主要产物
)
3
3
24
v 环上有致钝基,第二取代基进入另一环α-位。
NO
24
2
+
2
+
NO 2
NO 2
实际上影响萘环取代的因素比较复杂,许多二取代反应的定位并不完全符合上述规律
(3) 萘的还原
加氢反应(加成)
1,2-二氢化萘
(4) 萘的氧化反应
1,4-萘醌
7.2.2 蒽及其衍生物
1.370 Å
1.408 Å
1.436 Å
蒽的所有原子处于同一平面
2356
710αα
α
αβββ
βγγ
(一) 蒽的结构
(二)
蒽的性质
共振能kJ/mol: 152 255 351单个环共振能kJ/mol: 152 128 117
化学反应性
能
(1) 加成反应—蒽易在9,10位(γ位)
上起加成反应
二氢化蒽
+
24
2
SO4
(2) 氧化反应—重铬酸钾加硫酸可使蒽氧化成蒽醌
7.2.3
菲
1
2
378
2
菲比蒽稳定,化学反应易发生在
9,10-3
9,10-菲醌
7.2.4
其它稠环芳烃
苊
芴
芘3,4-苯并芘
H3
3
1,2-甲基-5,10-亚甲基-1,2-苯并蒽10-亚甲基-1,2-
苯并蒽
1,2-苯并菲
(显著致癌性)(高度致癌性)
苯并芘
有机化合物与环境
污染
具有芳香性化合物在性质上的标志是:
1.不饱和度高,具有平面或者接近平面的环状结构,键
长平均化;
2.与苯类似,一般不具备不饱和化合物的性质,难氧
化,难加成,易亲电取代,反应中尽量保持其芳核不变;
3.氢化热和燃烧热比相应的非环体系低,而显示出特殊
的稳定性。
是不是具有芳香性的化合物一定要
有苯环
7.3 非苯芳烃
1931年Hückel在研究通式为C x H x环多烯时,假定分子中所有原子都在一个平面内,每个碳原子上都有一个p 电子组成x个分子轨道。
用简化的分子轨道法计算这些能级后发现:
当分子中有2n+1个成键或非键轨道时,若有4n+2个电子恰好能填满成键或非键轨道而使分子具有类似惰性气体的电子排布,使分子具有最大的稳定性——芳香性。
因此,有机分子不一定要有苯环,只要满足
(1)整个分子共平面;
(2)具有闭环连续共轭体系;
(3)p电子数符合Hückel规则(4n+2个p电子)。
就具有芳性。
环丙烯正离子2个p 电子
环丁二烯4个p 电子
环戊二烯负离子6个p
电子
苯6个p 电子
环庚三烯正离子6个p 电子
环辛四烯8个p
电子
有机分子是否具有芳香性的判别依据:
(1)整个分子共平面;
(2)具有闭环连续共轭体系;
(3)p电子数符合Hückel规则(4n+2个p电子)。
对于稠环烃判别是否具有芳香性,则是计算成环原
子外围p电子
数
10个p电子有芳香性14个p电子
有芳香性
14个p电子
有芳香性
下列化√
轮烯——通常将n ≥10的环多烯烃C n H n 叫做轮烯
[10] 轮烯
不具有芳香性,非平面结构
[18]轮烯
具有芳香
习题:
1.(1) (2) (5)
2.
3.
5. (5) (6) (7) (8)
6. (1) (3) (5)
7.。