第二章电化学热力学ppt课件
- 格式:ppt
- 大小:1.19 MB
- 文档页数:54
![[理学]第二章电化学热力学2](https://uimg.taocdn.com/38fc3a6afe4733687f21aa0c.webp)







第二章电化学反应热力学第一节电化学体系一、两类电化学装置镀锐是重要电化学工业之一,其装置示意图如图2.1所示镀锐溶液(主要成分为NiS04,还有缓冲剂、添加剂等)电解槽或电解池:把两个电极与直流电源连结,使电流通过体系的装置原电池或化学电源:在两电极与外电路中的负载接通后自发地将电能送到外电路的装置。
上述两类电化学装置,也称为电化学体系。
® 2.1镀锐装置示意原电泡与电解池的两个电极之间存在着电位差,电位较高的电极称为正极,电位较低的电极称为负极。
在自发电池中,电流(习惯上指正电荷)自正极经外电路流向负极。
电解池的正、负极分别与外电源的正、负极相连。
事实上,在外电路传送的电荷都是电子,电子流动方向与习惯上认为的电流方向相反。
人为规定使正电荷由电极进入溶液的电极称为阳极,使正电荷由溶液进入电极的电极称为阴极,在阳极上进行氧化反应,在阴极上进行还原反应。
在电解时,正极是阳极,负极是阴极。
在原电池中负极是阳极,正极是阴极。
用正、负极名称是按电位高低来区分,用阴、阳极名称是按电极进行还原或氧化反应来区分。
也有用氧化极、还原极来称呼电极的,前者即阳极、后者为阴极。
电流通过电化学体系,必须有两类导体:电子导体和离子导体,以及在这两类导体的界面上进行电化学反应。
因此,电化学的研究对象应当包括三部分:电子导体、离子导体、两类导体的界面及其上发生的一切变化。
电子导体届丁物理研究的范围,在电化学中一般只引用它们所得的结论。
离子导体包括电解质溶液、熔融盐和固体电解质。
经典电化学的主要内容:电解质溶液理论。
近代电化学的主要内容:两类导体的界面性质及界面上所发生的变化,涉及化学热力学和化学动力学的许多问题。
电化学包括的基本内容为电解质溶液理论,电化学平■衡和电极对程动力学能量的转换:电解池,把电能转变为化学能;化学电源,使化学能转变为电能。
电化学主要是研究化学能和电能之间相互转化以及和这过程有关的定律和规则的科学。

第2章电化学热力学2.1 相间电位和电极电位2.1.1 相间电位两相接触时,荷电粒子〔含偶极子〕在界面层中的非均匀分布使两相界面层中存在电位差,这种电位差称为相间电位。
引起相间电位的可能有以下四种情形:(a)带电粒子在两相间的转移或利用外电源向界面两侧充电使两相中出现剩余电荷,形成“双电层〞。
(b)阴、阳离子在界面层中吸附量不同,使界面与相本体中出现等值反号电荷.在界面的溶液一侧形成吸附双电层。
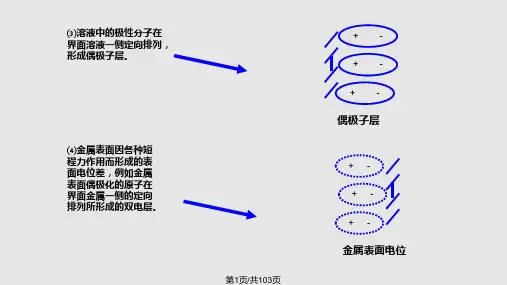
(c)溶液中极性分子在界面溶液一侧定向排列,形成偶极子层。
(d)金属表面因各种短程力作用而形成的表面电位差。
在电化学体系,离子双电层是相间电位的主要来源,同一种粒子在不同相中所具有的能量状态是不同的,当两相接触时,该粒子就会自发地从高能态相向低能态相转移。
对于不带电的粒子i相间稳态分布的条件是△G i A→B=μi B−μi A=0即该粒子在两相中的化学位相等,μi B−μi A对于带电粒子来说,在两相间转移时,除了引起化学能的变化外,还有随电荷转移所引起的电能变化。
假设孤立相M是一个由良导体组成的球体,因而球体所带的电荷全部均匀分布在球面上。
(1)将单位正电荷e从无穷远处移至离良导体球M 104~10-5cm处时所做的功W1,电荷与球体之间只有长程力〔库仑力〕作用,称为M相(球体)的外电位,用ψ表示,有:W1=ψ(2)从10-4 ~ 10-5cm处越过表面层到达M相内界面短程力做电功称为M的表面电位χ:W2=χ(3)克服物相M与试验电荷之间短程力所作的化学功:W=μ化对于单位正电荷情况:任一相的表面层中,由于界面上的短程力场(X德瓦耳斯力、共价键力等)引起原子或分子偶极化并定向排列,使表面层成为一层偶极子层。
单位正电荷穿越该偶极子层所作的电功称为M相的表面电位χ。
所以将一个单位正电荷从无穷远处移入M相所作的电功是外电位ψ与表面电位χ之和,即Φ=ψ+χФ称为M相的内电位。
如果进入M相的不是单位正电荷,而是1摩尔的带电粒子,则其化学功等于该粒子在M相中的化学位μ。