化工热力学第二章5
- 格式:ppt
- 大小:1.99 MB
- 文档页数:24

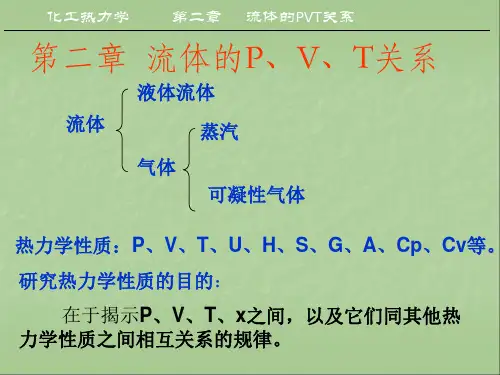
授课内容第二章p-V-T关系和状态方程§2-1 引言1 流体最基本的性质有两大类,一类是p、V、T、组成和热容数据,另一类是热数据(如标准生成焓和标准生成熵等)。
本章重点讨论p-V-T关系和状态方程2 推算流体p-V-T行为的途径1)状态方程(EOS)p-V-T关系的解析式。
2)对应态原理(CSP)一种特别的状态方程,以对比参数来表达方程,使流体性质在对比状态下便于比较,并统一到较好的程度。
3 p-V-T关系和状态方程的重要性在计算热力学性质时需要输入流体最基本的性质以及表达系统特征的模型。
状态方程不仅本身是重要的p-V-T关系式,而且从p-V-T的角度反映了系统的特征,是经典热力学中推算其它性质不可缺少的模型之一。
4 本章主要内容1)纯物质的p-V-T行为2)常见的状态方程3)常用的对应态原理4)混合法则§2-2 p-V-T 相图该图是表示纯物质在平衡状态下压力、摩尔体积与温度关系的p-V-T 曲面。
包括: 1 单相区:S 、L 和V (G )分别表示固相、液相和蒸汽(气相); 2 两相共存区:S/L 、V/S 和V/L 分别代表固/液、汽/固、汽/液两相平衡区3 临界点C :汽/液共存的最高温度或压力点,该点的温度、压力和摩尔体积分别称为临界温度Tc 、临界压力Pc 和临界体积Vc 。
数学上表示为:(在C 点) 流体在临界的特性和临界参数在状态方程研究中有重要作用。
在T >T c 和p >pc 的区域内,气体和液体变得不可区分,称为超临界流体。
在临界点附近,流体的许多性质有突变的趋势,如密度、溶解其它物质的能力等,已开发的工业过程有超临界分离技术、超临界化学反应等 。
4 饱和线:ACB 是汽/液两相共存区的边界线。
AC 为饱和液体线也称为泡点线,BC 为饱和蒸汽线也称为露点线。
5 三相线:通过A 、B 的直线,是三个两相平衡区的交界线。
在三相线上有固定的温度、压力,此状态下的纯物质处于气-液-固三相平衡 。






【精品】化工热力学第二章习题解答化工热力学第二章习题解答1.一个理想气体在恒定温度下,其压强与体积的关系如下所示:P = A / V^2其中P是压强,V是体积,A是常数。
求该气体的热力学过程方程。
解答:根据热力学第一定律,对于恒温过程,有dU = dq + dw = dq - PdV,其中U是内能,q是热量,w是对外界做的功。
由于该气体是理想气体,可以假设其内能只与温度有关,即dU = Cdt,其中C 是常数,t是温度。
将上式代入热力学第一定律中,得到Cdt = dq - PdV。
根据理想气体状态方程PV = nRT,其中n为物质的量,R为气体常数,T为温度。
将P = A / V^2代入上式,得到Cdt = dq - (A / V^2)dV。
对上式两边同时积分,得到∫Cdt = ∫dq - ∫(A / V^2)dV。
即Ct = q - A / V + B,其中B为常数。
综上所述,该气体的热力学过程方程为Ct = q - A / V + B。
2.一个气体在等体过程中,其压强与温度的关系如下所示:P = A * T^2其中P是压强,T是温度,A是常数。
求该气体的热力学过程方程。
解答:根据热力学第一定律,对于等体过程,有dU = dq + dw = dq - PdV,其中U是内能,q是热量,w是对外界做的功。
由于该气体是理想气体,可以假设其内能只与温度有关,即dU = Cdt,其中C 是常数,t是温度。
将上式代入热力学第一定律中,得到Cdt = dq - PdV。
根据理想气体状态方程PV = nRT,其中n为物质的量,R为气体常数,T为温度。
将P = A * T^2代入上式,得到Cdt = dq - (A * T^2)dV。
对上式两边同时积分,得到∫Cdt = ∫dq - ∫(A * T^2)dV。
即Ct = q - (A / 3)T^3 + B,其中B为常数。
综上所述,该气体的热力学过程方程为Ct = q - (A / 3)T^3 + B。

习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,c s s r p p p =对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。

第二章 流体压力、体积、浓度关系:状态方程式2-1 试分别用下述方法求出400℃、4.053MPa 下甲烷气体摩尔体积。
(1) 理想气体方程;(2) RK 方程;(3)PR 方程;(4) 维里截断式(2-7)。
其中B 用Pitzer 普遍化关联法计算。
[解] (1) 根据理想气体状态方程,可求出甲烷气体在理想情况下摩尔体积id V 为33168.314(400273.15) 1.381104.05310id RT V m mol p --⨯+===⨯⋅⨯ (2) 用RK 方程求摩尔体积将RK 方程稍加变形,可写为0.5()()RT a V b V b p T pV V b -=+-+(E1)其中从附表1查得甲烷临界温度和压力分别为c T =190.6K, c p =4.60MPa ,将它们代入a, b 表达式得2 2.56-20.560.427488.314190.6 3.2217m Pa mol K 4.6010a ⨯⨯==⋅⋅⋅⨯ 53160.086648.314190.6 2.9846104.6010b m mol --⨯⨯==⨯⋅⨯ 以理想气体状态方程求得id V 为初值,代入式(E1)中迭代求解,第一次迭代得到1V 值为5168.314673.15 2.9846104.05310V -⨯=+⨯⨯350.563353.2217(1.38110 2.984610)673.15 4.05310 1.38110(1.38110 2.984610)-----⨯⨯-⨯-⨯⨯⨯⨯⨯⨯+⨯ 3553311.381102.984610 2.1246101.389610m mol -----=⨯+⨯-⨯=⨯⋅ 第二次迭代得2V 为353520.563353553313.2217(1.389610 2.984610)1.381102.984610673.154.05310 1.389610(1.389610 2.984610)1.381102.984610 2.1120101.389710V m mol ------------⨯⨯-⨯=⨯+⨯-⨯⨯⨯⨯⨯⨯+⨯=⨯+⨯-⨯=⨯⋅1V 和2V 已经相差很小,可终止迭代。
第二章习题解答一、问答题:2-1为什么要研究流体的pVT 关系?【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。
(1)流体的PVT 关系可以直接用于设计。
(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。
只要有了p-V-T 关系加上理想气体的id p C ,可以解决化工热力学的大多数问题。
2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。
【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。
2)临界点C 的数学特征:3)饱和液相线是不同压力下产生第一个气泡的那个点的连线;4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。
5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。
6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。
7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。
2-3 要满足什么条件,气体才能液化?【参考答案】:气体只有在低于T c 条件下才能被液化。
2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素?【参考答案】:不同。
真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。
2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?()()()()点在点在C V P C V PTT 0022==∂∂∂【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。
其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。
为了提高计算复杂分子压缩因子的准确度。