酸枣仁饮片内控质量标准
- 格式:docx
- 大小:26.95 KB
- 文档页数:3

中药饮片质量标准一、根、根茎、藤木类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
极薄片:不得超过该品种标准厚度的0.5mm.;薄片、厚片、丝、块:不得超过该标准的1mm;段:不得超过该标准2mm. 检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g+过3号筛/取样量二、果实种子类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于3%检查:取样100g拣选杂质+过二号筛/取样量三、全草类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取50g拣选取异形片/取样量水分:7%----13%检查:取样100g拣选杂质+过二号筛/取样量四、花类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量五、皮类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量六、叶类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取50g拣选取异形片/取样量水分:7%----13%检查:取样50g拣选杂质+过二号筛/取样量七、树脂类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
药屑杂质:小于3%检查:取样100g拣选杂质+过三号筛/取样量八、动物类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。
片形:异性片不得超过10%。
检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于3%检查:取样100g拣选杂质+过二号筛/取样量九、矿物类性状:按《药典》、全国中药炮制规范、各省中药炮制规范。

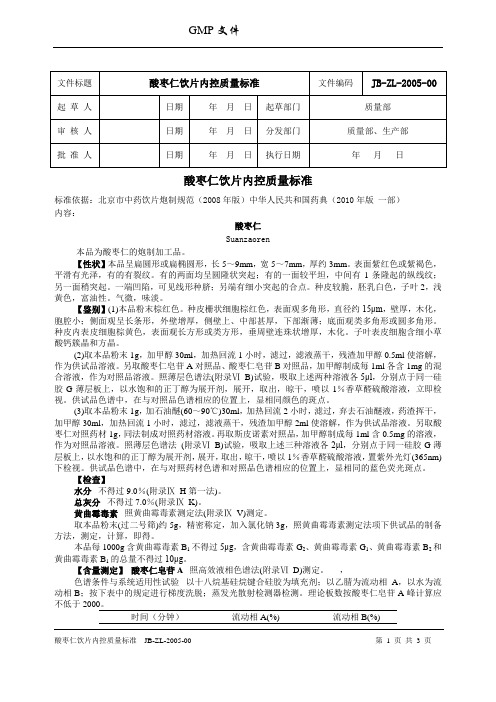
文件标题酸枣仁饮片内控质量标准文件编码JB-ZL-2005-00 起草人日期年月日起草部门质量部审核人日期年月日分发部门质量部、生产部批准人日期年月日执行日期年月日酸枣仁饮片内控质量标准标准依据:北京市中药饮片炮制规范(2008年版)中华人民共和国药典(2010年版一部)内容:酸枣仁Suanzaoren本品为酸枣仁的炮制加工品。
【性状】本品呈扁圆形或扁椭圆形,长5~9mm,宽5~7mm,厚约3mm。
表面紫红色或紫褐色,平滑有光泽,有的有裂纹。
有的两面均呈圆隆状突起;有的一面较平坦,中间有1条隆起的纵线纹;另一面稍突起。
一端凹陷,可见线形种脐;另端有细小突起的合点。
种皮较脆,胚乳白色,子叶2,浅黄色,富油性。
气微,味淡。
【鉴别】(1)本品粉末棕红色。
种皮栅状细胞棕红色,表面观多角形,直径约15μm,壁厚,木化,胞腔小;侧面观呈长条形,外壁增厚,侧壁上、中部甚厚,下部渐薄;底面观类多角形或圆多角形。
种皮内表皮细胞棕黄色,表面观长方形或类方形,垂周壁连珠状增厚,木化。
子叶表皮细胞含细小草酸钙簇晶和方晶。
(2)取本品粉末1g,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇0.5ml使溶解,作为供试品溶液。
另取酸枣仁皂苷A对照品、酸枣仁皂苷B对照品,加甲醇制成每1ml各含1mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(3)取本品粉末1g,加石油醚(60~90℃)30ml,加热回流2小时,滤过,弃去石油醚液,药渣挥干,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
另取酸枣仁对照药材1g,同法制成对照药材溶液。
再取斯皮诺素对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。

酸枣仁免煎颗粒与饮片治疗失眠的临床疗效分析目的分析酸枣仁免煎颗粒与饮片治疗失眠的临床疗效。
方法资料选取我院收治的失眠患者124例,随机分为两组,对照组62例给予酸枣仁免煎颗粒治疗,研究组62例给予酸枣仁饮片治疗,比较两组治疗效果、PSQI分值及预后质量。
结果研究组治疗总有效率96.77%比对照组80.65%高(P<0.05);治疗后研究组PSQI分值显著低于对照组,且生活质量评分高于对照组(P<0.05)。
结论酸枣仁免煎颗粒应用于失眠治疗中疗效更为显著,可有效改善患者睡眠质量,提高其生活质量。
标签:酸枣仁;免煎颗粒;饮片;失眠;疗效分析失眠又被称之为”不得眠”、”不寐”,常表现为睡但易醒,且不易再睡,有时睡而不酣,但易惊醒,甚至出现彻夜难眠,从而导致全身乏力,若不及时予以治疗,极易诱发严重疾病,从而影响其生活质量。
目前临床多用酸枣仁免煎颗粒与其饮片治疗该病,但对两者的临床疗效差异鲜有报道。
为此,本研究针对已选定的124例失眠患者分别予以酸枣仁免煎颗粒及其饮片治疗的临床效果进行对比,现报告如下。
1 资料与方法1.1一般资料资料选取我院收治的失眠患者124例,临床表现为惊悸怔忡,虚烦不眠,健忘、多梦,舌红脉弦细,体虚自汗,按照随机数字表法分为两组,每组62例;对照组男女比例26:36,年龄27~74岁,平均(54.53±6.23)岁,病程3个月~5年,平均(3.52±2.41)年。
研究组男女比例28:34,年龄28~75岁,平均(55.38±7.14)岁,病程4个月~5年,平均(4.21±3.02)年。
两组基线资料无明显差异(P>0.05),具可比性。
1.2方法对照组给予酸枣仁饮片治疗,将15g酸枣仁饮片炒香,然后捣成碎末,加入开水浸泡,时间至少为3h,于每晚睡前1h顿服。
研究组给予酸枣仁免煎颗粒,将相当于酸枣仁饮片的15g免煎颗粒,于每晚睡前1h冲服。
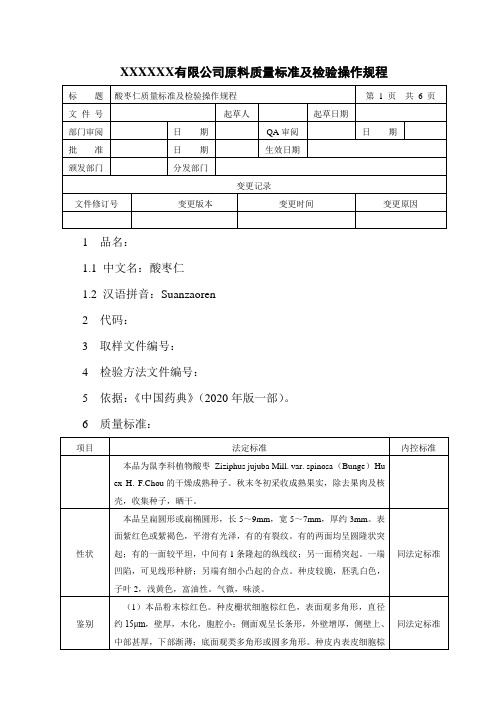
XXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:酸枣仁1.2 汉语拼音:Suanzaoren2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:甲醇、酸枣仁皂苷A对照品、酸枣仁皂苷B对照品、水饱和的正丁醇、1%香草醛硫酸溶液、石油醚(60~90℃)、酸枣仁对照药材、斯皮诺素对照品、氯化钠、乙腈、乙醇。
7.2 仪器与用具:电子天平、回流装置、索氏提取器、烘箱、马福炉、水浴锅、硅胶G薄层板、紫外光灯、高效液相色谱仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
7.4.2取本品粉末1g,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇0.5ml使溶解,作为供试品溶液。
另取酸枣仁皂苷A对照品、酸枣仁皂苷B对照品,加甲醇制成每1ml各含1mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
取本品粉末1g,加石油醚(60~90℃)30ml,加热回流2小时,滤过,弃去石油醚液,药渣挥干,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
另取酸枣仁对照药材1 g,同法制成对照药材溶液。
再取斯皮诺素对照品,加甲醇制成每1ml各含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各2μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同的蓝色荧光斑点。

中药炮制品品质控制要求现代科学技术的发展,为中药炮制品质量的检测与评价提高了科学依据.从传统的经典检测方法到现代检测技术的应用,从饮片的形、色、气、味等外观指标到内含成分的质量,从定性鉴别到定量测定,中药炮制品的质量要求,更趋于客观化、合理化、科学化.一、净度净度系指炮制品的纯净度,以与炮制品中所含杂质与非药用部位的限度.炮制品应有一定的净度标准,以保证调配剂量的准确.饮片的"质"与"量"是影响临床疗效的主要因素.炮制品中不应夹带泥砂、灰屑、杂质、霉烂品、虫蛀品.应该剔除非药用部位如壳、核、芦头、栓皮、头足、翅等.饮片中所含的杂质,必须符合有关规定.国家中医药管理局关于《中药饮片质量标准通则〈试行〉》的通知规定:根、根茎、藤木类:含药屑、杂质不得超过2%;果实、种子类:含药屑、杂质不得超过3%;全草类:含药屑、杂质不得超过3%;叶类:含药屑、杂质不得超过2%;花类:含药屑、杂质不得超过2%;皮类:含药屑、杂质不得超过2%;树脂类:含杂质不得超过3%;动物类:含杂质,不得超过2%;矿物类:含杂质,不得超过2%;菌藻类:含药屑、杂质不得超过2%;炒制品:其中,炒黄品、米炒品:含药屑、杂质不得超过1%;炒焦品、麸炒品:含药屑、杂质不得超过2%;炒炭品、土炒品:含药屑、杂质不得超过1%;药汁煮品、豆腐煮品:含药屑、杂质不得超过2%;煨制品:含药屑、杂质不得超过3%;煅制品:含药屑、杂质不得超过2%;发芽制品、发酵制品:含药屑、杂质不得超过1%.检查方法:取定量样品,拣出杂质,草类、细小种子类过三号筛,其他类过二号筛.药屑、杂质合并称量计算.二、片型与粉碎粒度经挑选整理或经水处理后的药材,根据药物特征和炮制要求用手工或机械切制成一定规格的片型,使之便于调剂、炮炙、干燥和贮藏.经切制成的饮片破碎后的碎屑多少也是检验饮片质量的标准之一,各种片型破碎后残留的碎屑都应有一定的限量规定.1.片型要符合《中华人民共和国药典》,或《全国中药炮制规范》的规定.切制后的饮片应均匀、整齐、色泽鲜明,表面光洁,片面无机油污染,无整体,无长梗,无连刀片、掉刀片、边缘卷曲等不合规格的饮片.《饮片标准通则〔试行〕》规定,异形片不得超过10%;极薄片:不得超过该品种标准厚度的0.5mm;薄片、厚片、丝、块:不得超过该标准的1 mm;段:不得超过该标准的2mm.切制后的饮片或经加工炮制后的饮片,其破碎后的药屑与经加工炮制造成的药屑或残留的辅料有一定的限量标准〔详细规定见净度项内〕.2.粉碎粒度一些不宜切制的药物或医疗上有特殊需要的药物,经挑选整理或水处理后,用手工或机器粉碎成颗粒或粉末,便于煎煮或调剂.粉碎后的药物应粉粒均匀,无杂质,粉末的分等应符合药典要求.三、色泽〔含光泽〕中药炮制对制品的色泽有特殊的要求.它的意义在于:其一,药材经炮制后应显其固有色泽,如黄芪饮片,表面显黄白色,内层有棕色环纹与放射状纹理〔习称"菊花心"〕.其二,通常在炮制操作中常以饮片表面或端面的色泽变化作为控制炮制程度的直观指标,如甘草,片面黄白色,经蜜炙后要求表面呈老黄色等.其三,饮片的色泽是反应其质量要求的一项指标,如熟地黄要求切面乌黑发亮,血余炭、棕榈炭要求表面乌黑而富有光泽,都是以色泽变化作为评价要求的.其四,炮制品色泽的不正常变化说明其内在质量的变异,白芍变红,红花变黄等,均说明药物内在成分已发生变化.故色泽的变异,不仅影响其外观,而且是内在质量变化的标志之一.对于炮制品色泽的要求,《饮片标准通则<试行>》规定:各种炮制品其色泽应符合该品种规定外,还规定各炮制品的色泽均匀,炒黄品、麸炒品、土炒品、蜜炙品、酒炙品、醋炙品、盐炙品、油炙品、姜汁炙品、米泔水炙品、烫制品等:含生片、糊片不得超过2%;炒焦品:含生片、糊片不得超过3%;炒炭品:含生片,和完全炭化者不得超过5%;蒸制品:色泽黑润,内无生心,未蒸透者不得超过3%;煮制品:未煮透者不得超过2%,有毒药材应煮透;煨制品:未煨透者与糊片不得超过5%;煅制品:未煅透与灰化者不得超过3%.四、气味炮制品原有的气和味,与炮制品内在质量有着密切的关系,因此药物的气和味与治疗作用有一定的关系,往往也是鉴别品质的重要依据,如檀香的清香气,阿魏的浊臭气,桂枝的辛辣味等.炮制品虽经切制或炮制,但应具有原有的气和味,不应带异味,或气味散失变淡;另一方面由于炮制过程中加热和加辅料的作用,外源性因素能导致药物气和味的改变.炮制品若是用酒、醋、盐、姜、蜜等辅料炮制,除具原有的气和味,还应带有所用辅料的气和味.如醋制品,应带有醋香气味;酒制品,应带有酒香气;盐制品,应带有咸味;麸炒品应带有麦麸皮的焦香气等等.五、水分检查炮制品中水分的含量,是一项重要的必不可少的内容,药物制成饮片,有的须经水处理,有的要加入一定量的液体辅料,如操作不当,可使药材"伤水",或部分药物吸水过多,倘若又未能充分干燥,则炮制品极易霉烂变质;部分经过蒸、煮的药物,如熟地黄、制黄精、制肉苁蓉等,其质地柔润,含糖类与粘性成分较多,内部不易干燥,更应防止其含水量过高;少数胶类药物,如阿胶、鹿角胶等,含水量直接影响其品质和硬度,同样还会影响其炮制操作和炮制品的质量.炮制品中含有多量水分,不仅在贮存保管过程中易生虫、霉变,使有效成分分解、酶解变质,且在配方称量时相对减少了实际用量,影响应有的治疗效果.另一方面某些炮制品含水量过少又会影响其质量,如胶类药物易出现龟裂.因此,控制炮制品的水分含量,对保证炮制品质量有重要意义.按炮制方法与各药物具体性状,一般炮制品的水分含量宜控制在7%~13%.对于各类炮制法其炮制品含水量的要求,《饮片标准通则〔试行〕》规定:蜜炙品类,含水分不得超过15%;酒炙品类、醋炙品类、盐炙品类、姜汁炙品、米泔水炙品、蒸制品、煮制品、发芽制品、发酵制品,含水分均不得超过13%;烫制后醋淬制品,含水分不得超过10%等.六、灰分将干净而又无任何杂质的炮制品加高热灰化,所得之灰分称"生理灰分".而同一品种之生理灰分往往在一定的范围内.所以测定炮制品之灰分的意义,在于通过对不挥发性无机盐的测试来鉴定和评价炮制品的质量和净度.同一炮制品,其灰分量应该相近,灰分超过正常值,说明其无机盐杂质的含量多,其原因可能是渗杂或有外源性杂质,说明炮制品净度不符合要求.灰分低于正常值,应考虑炮制品的质量问题,是否有伪品或劣质品之嫌.因此,总灰分、酸不溶性灰分的测定,为炮制品的质量评价提供了有力的佐证.常见的无机物质为泥土、砂石等.值得注意的是炮制方法中有砂炒〔烫〕、蛤粉炒、土炒、滑石粉炒等,难免在成品中粘附有少量的无机物质,会造成灰分含量高于生品的结果,因此可以通过反复测试和比较,客观地制定各类炮制品的灰分限量,这对炮制工艺和饮片质量都有一定意义.七、浸出物炮制品加入一定的溶媒后,经过浸润、渗透——解吸、溶解——扩散、置换等作用,炮制品中的某些成分〔总体〕,包括有效成分会被提取出来,因此,测定浸出物的含量是表示其质量的一项指标.对于那些有效成分尚不完全清楚或尚无精确定量方法的炮制品,具有重要意义.根据炮制品中主要成分的性质和特点,通常选用不同性质的浸出溶媒,因此,浸出物的测定,主要分为二类,即水溶性浸出物与醇溶性浸出物.水溶性浸出物的测定和限量,对炮制工艺、方法与炮制品质量都具有重要的指导意义.例如,绝大多数中药在切制前均需经过水处理,使药材软化.当药材在水中浸漂时间过长,以致"伤水",其水溶性成分就有所流失;又如蒸法、煮法等,某些药物按操作规程,液体辅料或固体辅料的煎液,在蒸或煮制过程中应被药物吸尽为度,若不按操作规程,草率处置,其质量势必欠佳.因此,水溶性浸出物的测定也是对炮制工艺的检验.辅料加入的作用,能对炮制品浸出量产生影响.如醋制延胡索的水溶性浸出物的量,远比生品高.此外,炒、烫、煅、煅淬等加热处理,使质地坚硬的药物因受热膨胀而导致组织疏松,从而也使浸出率提高,浸出量增加.所以,浸出物的测定和定量,对检验炮制工艺、方法与炮制品质量具有重要的意义.八、显微与理化鉴别显微与理化鉴别是利用显微镜、化学方法或仪器来观察、分析鉴定炮制品的真伪、纯度或质量.1.显微鉴别显微鉴别系指利用显微镜来观察炮制品的组织结构或粉末中的组织、细胞,内含物等特征,鉴别炮制品的真伪、纯度,甚至质量.显微鉴别的方法主要分组织鉴别与粉末鉴别二个方面.〔1〕组织鉴别:炮制后的饮片,由于已进行了净选和切制处理,如分离不同的药用部位,或除去非药用部位,故植物药的部分组织已不在某些药物的特殊炮制工艺中,经长时间的蒸制后,又常经"整形"处理,故其切片后的组织结构、细胞特征与其排列已非正常,如天麻、熟地等,应与生药饮片作相应的对照而鉴别之.〔2〕粉末:由于加水、加热〔蒸、煮等〕存在于细胞内的淀粉粒、糊粉粒、菊糖、粘液质等均已受到不同程度的影响,与生药粉末差异较大,因此,显微鉴别,不仅可以鉴别炮制品的真伪、优劣,也可鉴别饮片的生熟与炮制的程度等.例如,生熟炮制品的组织结构、纤维、石细胞、导管、毛茸、淀粉粒、草酸钙结晶、花粉粒等在数量与形态方面均会发生一定程度的变化,像淀粉粒常因炮制过程中加水、加热而糊化或结成团块等.研究它,可作鉴别炮制品质量的佐证.2.理化鉴别理化鉴别系指用化学与物理的方法对炮制品中所含某些化学成分进行的鉴别试验.通常只作定性试验,少数可作限量试验.理化鉴别主要包括:显色反应与沉淀反应、荧光鉴别、升华物鉴别与薄层色谱鉴别等.〔1〕显色反应与沉淀反应:利用某些试剂、试液与炮制品或其提取液发生显色反应或沉淀反应,进行鉴别的方法.试验时常可用生品药物作阳性对照,观察不同炮制品的颜色变化〔色泽深浅〕和沉淀物的多少.应考虑,注意辅料成分对反应的影响,如醋制品的pH值,胆汁制品的胆酸、蜜炙制品中的糖类、氨基酸类成分都可能对显色反应、沉淀反应产生影响.〔2〕荧光鉴别:与生药一样,炮制品中的某些成分,在紫外光下,呈现出一定色泽的荧光,从而提供了鉴别特征.常见的荧光有天蓝色、亮黄色、淡紫色、暗褐色等.如秦皮的水溶液显淡蓝色荧光,黄连与酒黄连、姜黄连、萸黄连在紫外光下呈金黄色荧光等.荧光试验可以直接在炮制饮片的切面观察,但多数是将饮片粉碎后,以溶剂提取,滴于滤纸上观察,也有作薄层色谱后在色谱板上观察其荧光性成分,以此鉴别真伪.《中华人民共和国药典》1990年版收载了48种中药具有不同的荧光反应,可作为炮制品的对照加入检测.〔3〕升华物鉴别:取炮制品的粉末,按升华法试验,视其有无升华物凝集,并用放大镜或显微镜观察升华物的晶形、色泽,如酒大黄、醋大黄粉末少量,进行微量升华,可见浅黄色菱状针晶或羽状结晶;牡丹皮粉末,进行微量升华,可见长柱形结晶或针状与羽状簇晶,但在牡丹皮炭末中,此现象已不复存在.〔4〕薄层色谱〔薄层层析〕:作为对炮制品质量的鉴定,薄层色谱法具有较高的专属性和准确性,因而为人们所重视和关注.也越来越多地被广泛应用.《中华人民共和国药典》1990年版,以薄层色谱法鉴别的品种多达78种,除作一般定性鉴别外,也有仅以薄层色谱行为作为限量检查的,如制附子〔黑顺片、白附片、淡附片〕.用薄层色谱法作生药的鉴别,同样也可用在炮制品的鉴别,但要注意在炮制过程中,药物大多经过加热,或加辅料处理,势必会导致炮制品中的化学成分有不同程度的变化,辅料成分也会对色谱行为产生影响,因此,在作炮制品的色谱时,对吸附剂、展开剂的选择特别重要,不能盲目搬用生药方法和条件,对色谱结论的判断也应慎重,最后以标准品、对照品和标准药材,同时作阳性对照.九、有效成分测定炮制品中有效成分的含量,是评价炮制品质量的最可靠、最准确的方法.对于有效成分明确的中药炮制品,一定要对有效成分的含量有所规定,凡是一药有多种有效成分的亦应建立多个指标,并制定相应的检测方法.炮制品的含量测定工作,一般要比生药更加复杂和困难,不只是因为炮制品的品种多〔一种生药通常制成多种不同规格的饮片〕,更重要的是由于辅料的加入或长时间的加热处理,势必对原生药的某些成分产生影响,因而对提取、分离、色谱等定量条件产生了干扰,增加了测定的难度.然而,有效成分的含量测定项目必然成为炮制品评价中不可缺少的内容,因为这关系到饮片在临床应用的疗效.同时,也是控制药物在炮制过程中有效成分的流失、检查炮制方法与工艺是否合理、科学的评判,可为工艺的改进提供准确的实验依据与指标.十、有毒成分药物的毒副作用是由于药物中所含的毒性成分引起的,对于这类有毒的药物,建立有毒成分限量指标是必不可少的.这个限量指标的建立,可以保证临床用药安全.有毒成分的限量指标一般应包括:毒副作用成分、重金属的含量、砷盐含量、农药残留量等,因为这类成分直接威胁着人体健康.某些中药其有毒成分亦即是其有效成分,《中华人民共和国药典》1990年版收载了80个品种的含量测定方法和限量,其中包括了有毒药物与炮制品的含量和限量,如川乌炮制品、制川乌:含酯型生物碱以乌头碱〔C34H47NO11〕计,不得高于0.15%,含生物碱以乌头碱〔C34H47NO11〕计,不得少于0.20%;马钱子:含士的宁〔C21H22N2O2〕应为1.20%~2.20%,其炮制品马钱子粉:含士的宁〔C21H22N2O2〕应为0.78%~0.82%;巴豆炮制品巴豆霜:含脂肪油量应为18%~20%等.十一、卫生学检查鉴于中医临床用药的传统习惯,某些炮制品常被研成粉末,直接供患者冲服〔如人参末、三七末、珍珠末等〕,有些为烊化冲服〔如阿胶、鹿角胶、龟板胶等〕,又有些是泡服〔如肉桂末、菊花、胖大海、千层纸等〕;更多的炮制品被直接粉碎成细末后,制成散剂、丸剂供人们服用.中药饮片,由于药物在采收、加工、贮运等条件的影响,往往造成细菌对饮片的严重污染,含菌数可高达1万至数万.因此,对炮制品作卫生学检查也是必不可少的.应该对饮片中可能含有的致病菌、大肠杆菌、细菌总数、霉菌总数与活螨等作必要的检查,并客观地作限量要求.十二、包装的检查包装的目的是为了保护药物,便于贮存、运输和装卸.包装不仅可以保护药物的完整性和清洁,有些包装容器,尤其是目前迅速发展起来的无菌包装,尚能防止微生物、害虫等的侵蚀以与避免外界温度、湿度和有害气体、阳光的影响.因此检查炮制品的包装是否完好无损,这对炮制品在贮存、保管与运输过程中起着保质、保量的重要作用.11 / 11。
测定空白值的标准偏差;S:标准曲线的斜率)。
得Pb、Cu、As、Cd、Hg的检测限分别为0.02 mg·kg-1、0.02 mg·kg-1、0.002 mg·kg-1、0.001 mg·kg-1和0.05 mg·kg-1,定量限分别为0.07 mg·kg-1、0.07 mg·kg-1、0.006 mg·kg-1、0.003 mg·kg-1和0.17 mg·kg-1。
表3 各元素的线性关系元素线性方程r线性范围/(ng·mL-1)Pb y=15.998x+30.9870.999 60~20As y=0.400 1x+0.9120.999 60~20Cd y=0.320 1x+0.060 60.999 70~10Hg y=0.121 2x+0.001 40.999 80~5Cu y=5.230 4x+470.999 50~2002.3 精密度测定取3种不同浓度的酸枣仁样品,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价,计算每个元素的RSD,考察其重复性。
结果测得Pb、As、Cd、Cu、Hg各元素重复性RSD分别为1.8%、1.9%、2.1%、2.2%、1.3%。
由不同日期、不同分析人员进行日间精密度测定,得Pb、As、Cd、Cu、Hg各元素的RSD值分别为2.1%、1.6%、2.1%、1.8%、1.9%,满足验证要求。
精密度试验结果见表4。
2.4 回收率测定取已测定的样品9份,精密加入高(0.3 mg·kg-1)、中(0.2 mg·kg-1)、低(0.1 mg·kg-1)3个不同元素浓度的混合标准品溶液(每种浓度分别制备3份供试品溶液进行测定),进样测定,用实测值与供试品中含有量之差,除以加入对照品量计算回收率。
由表5可知,Pb、As、Cd、Cu、Hg各元素的平均回收率分别为80.6%、83.1%、82.2%、81.1%和85.9%,RSD≤3.6%,符合分析要求。
1 目的:明确酸枣仁质量标准,确定质量、生产、采供质控依据。
2 范围:酸枣仁。
3 责任者:质量部、生产部、采供部。
4 内容 4.1基本信息4.1.1 物料代码:原药材Y120-1;饮片:Y120-2。
4.1.2 供应商:亳州市远光中药饮片厂甘肃渭源颜裕药业有限公司4.1.3 标准依据:《中国药典》2010年版第一增补本P124。
4.2 取样、检验方法或相关操作规程编号 4.2.1 取样管理规程SOP-QA-1005-00。
4.2.2 检验方法或相关操作规程编号4.2.2.1 酸枣仁检验操作规程SOP-QC-6120-00。
4.2.2.2 检验方法药材及成方制剂显微鉴别法SOP-QC-5007-00;薄层色谱法SOP-QC-5010-00; 杂质检查法 SOP-QC-5018-00;水分测定法 SOP-QC-5024-00; 灰分测定法 SOP-QC-5025-00;黄曲霉毒素测定法SOP-QC-5054-00; 高效液相色谱法SOP-QC-5011-00。
4.3 标准内容 4.3.1 药材:酸枣仁本品为鼠李科植物酸枣Z iziphus jujuba Mill.var.spinosa (Bunge)Hu ex文件编号 酸枣仁质量标准颁发部门QS-QC-0120-00GMP 办公室 版本号 生效日期1.0编制人/修订人审核人 批准人 日期审核日期批准日期 会签(分发)质量部、生产部、采供部总页数5页标准文件酸枣仁质量标准文件编号QS-QC-0120-00 版本号 1.0 第 2 页共 5 页H.F.Chou干燥成熟种子。
秋末冬初采收成熟果实,除去果肉和核壳,收集种子,晒干。
4.3.1.1 性状:本品呈扁圆形或扁椭圆形,长5~9mm,宽5~7mm,厚约3mm。
表面紫红色或紫褐色,平滑有光泽,有的有裂纹。
有的两面均呈圆隆状突起,有的一面较平坦,中间有1条隆起的总线纹;另一面稍突起。
一端凹陷,可见线形种脐;另端有细小突起的合点。
中药饮片质量控制中药饮片质量控制引言中药饮片是指经过炮制制成的中药材,通常被用于煎服和药物制剂制备。
饮片质量的好坏直接影响中药制剂的疗效和安全性。
因此,中药饮片的质量控制非常重要。
本文将介绍中药饮片质量控制的一些主要内容。
1. 质量标准中药饮片的质量标准是通过制定和执行一系列技术规范和标准,来保证产品的质量稳定和安全性。
质量标准通常包括以下几个方面:- 外观特征:包括颜色、形状、气味等。
- 成分含量:各种有效成分的含量要符合规定的范围。
- 杂质含量:如无害微生物、重金属、农药残留等。
- 质量控制指标:如过氧化值、水分含量、酸度等。
质量标准的制定应参考国家相关药典、规范和标准,以及企业自身的技术要求。
2. 制剂工艺中药饮片的制剂工艺包括原料选择、制粉、炒制、炒制工艺、制片等环节。
制剂工艺对饮片的质量有着直接影响。
制剂工艺应考虑以下几个方面:- 原料选择:选择质量良好、来源可靠的中药材。
- 制粉:要求粉末细腻、均匀,不得有杂质。
- 炒制工艺:应根据不同中药材的特性和要求,进行适当的炒制处理。
- 制片:应采用符合规范的制片工艺,如湿法制片、干法制片等。
制剂工艺中的每个环节都应严格控制,确保每一批饮片的质量稳定。
3. 质量控制方法为了对中药饮片的质量进行有效控制,需采用一系列质量控制方法。
主要包括以下几种:- 外观检查:通过目视观察饮片的颜色、形状、气味等,判断是否符合要求。
- pH值测试:用pH试纸或pH计检测饮片的酸碱度,判断是否符合规定范围。
- 成分含量测定:采用色谱法、紫外分光光度法、高效液相色谱法等测定各种有效成分的含量。
- 杂质检测:利用显微镜、电子显微镜等检测方法,检测饮片中的杂质是否超标。
质量控制方法的选择应根据质量标准的要求和实际情况进行合理选择,并建立有效的检验方法和设备。
4. 不合格品处理在质量控制过程中,可能会出现不合格的中药饮片。
不合格品的处理应根据具体情况进行,一般包括以下几种方式:- 重新加工:对不符合规定要求的饮片,可以通过重新加工、炒制等工艺,使其符合要求。
文件标题酸枣仁饮片内控质量标准文件编码JB-ZL-2005-00 起草人日期年月日起草部门质量部审核人日期年月日分发部门质量部、生产部批准人日期年月日执行日期年月日酸枣仁饮片内控质量标准标准依据:北京市中药饮片炮制规范(2008年版)中华人民共和国药典(2010年版一部)内容:酸枣仁Suanzaoren本品为酸枣仁的炮制加工品。
【性状】本品呈扁圆形或扁椭圆形,长5~9mm,宽5~7mm,厚约3mm。
表面紫红色或紫褐色,平滑有光泽,有的有裂纹。
有的两面均呈圆隆状突起;有的一面较平坦,中间有1条隆起的纵线纹;另一面稍突起。
一端凹陷,可见线形种脐;另端有细小突起的合点。
种皮较脆,胚乳白色,子叶2,浅黄色,富油性。
气微,味淡。
【鉴别】(1)本品粉末棕红色。
种皮栅状细胞棕红色,表面观多角形,直径约15μm,壁厚,木化,胞腔小;侧面观呈长条形,外壁增厚,侧壁上、中部甚厚,下部渐薄;底面观类多角形或圆多角形。
种皮内表皮细胞棕黄色,表面观长方形或类方形,垂周壁连珠状增厚,木化。
子叶表皮细胞含细小草酸钙簇晶和方晶。
(2)取本品粉末1g,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇0.5ml使溶解,作为供试品溶液。
另取酸枣仁皂苷A对照品、酸枣仁皂苷B对照品,加甲醇制成每1ml各含1mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(3)取本品粉末1g,加石油醚(60~90℃)30ml,加热回流2小时,滤过,弃去石油醚液,药渣挥干,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
另取酸枣仁对照药材1g,同法制成对照药材溶液。
再取斯皮诺素对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各2μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同的蓝色荧光斑点。
【检查】水分不得过9.0%(附录ⅨH第一法)。
总灰分不得过7.0%(附录ⅨK)。
黄曲霉毒素照黄曲霉毒素测定法(附录ⅨV)测定。
取本品粉末(过二号筛)约5g,精密称定,加入氯化钠3g,照黄曲霉毒素测定法项下供试品的制备方法,测定,计算,即得。
本品每1000g含黄曲霉毒素B1不得过5μg,含黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1的总量不得过10μg。
【含量测定】酸枣仁皂苷A 照高效液相色谱法(附录ⅥD)测定。
,色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B;按下表中的规定进行梯度洗脱;蒸发光散射检测器检测。
理论板数按酸枣仁皂苷A峰计算应不低于2000。
时间(分钟)流动相A(%) 流动相B(%)0~15 15~28 28~30 30~32 20→404040→7070→10080→606060→3030→0对照品溶液的制备取酸枣仁皂苷A对照品适量,精密称定,加甲醇制成每1ml含0.1mg的溶液,即得。
供试品溶液的制备取本品粉末(过四号筛)约1g,精密称定,置索氏提取器中,加石油醚(60~90℃)适量,加热回流4小时,弃去石油醚液,药渣挥去溶剂,转移至锥形瓶中,加入70%乙醇20ml,加热回流2小时,滤过,滤渣用70%乙醇5ml洗涤,合并洗液与滤液,回收溶剂至干,残渣加甲醇溶解,转移至5ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液5μl、20μl,供试品溶液10μl,注入液相色谱仪,测定,用外标两点法对数方程计算,即得。
本品按干燥品计算,含酸枣仁皂苷A(C58H94O26)不得少于0.030%。
斯皮诺素照高效液相色谱法(附录ⅥD)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的规定进行梯度洗脱;检测波长为335nm。
理论板数按斯皮诺素峰计算应不低于2000。
时间(分钟)流动相A(%) 流动相B(%)0~10 10~16 16~22 22~30 12→1919→2020→10010088→8181→8080→0对照品溶液的制备取斯皮诺素对照品适量,精密称定,加甲醇制成每1ml含0.2mg的溶液,即得。
供试品溶液的制备取酸枣仁皂苷A[含量测定]项下的续滤液,作为供试品溶液。
测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,含斯皮诺素(C28H32O15)不得少于0.080%。
【贮藏】置阴凉干燥处,防蛀。
炒酸枣仁Chaosuanzaoren本品为酸枣仁的炮制加工品。
【性状】本品形如酸枣仁。
表面微鼓起,微具焦斑。
略有焦香气,味淡。
【鉴别】(1)本品粉末棕红色。
种皮栅状细胞棕红色,表面观多角形,直径约15μm,壁厚,木化,胞腔小;侧面观呈长条形,外壁增厚,侧壁上、中部甚厚,下部渐薄;底面观类多角形或圆多角形。
种皮内表皮细胞棕黄色,表面观长方形或类方形,垂周壁连珠状增厚,木化。
子叶表皮细胞含细小草酸钙簇晶和方晶。
(2)取本品粉末1g,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇0.5ml使溶解,作为供试品溶液。
另取酸枣仁皂苷A对照品、酸枣仁皂苷B对照品,加甲醇制成每1ml各含1mg的混合溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,立即检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(3)取本品粉末1g,加石油醚(60~90℃)30ml,加热回流2小时,滤过,弃去石油醚液,药渣挥干,加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
另取酸枣仁对照药材1g,同法制成对照药材溶液。
再取斯皮诺素对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取上述三种溶液各2μl,分别点于同一硅胶G薄层板上,以水饱和的正丁醇为展开剂,展开,取出,晾干,喷以1%香草醛硫酸溶液,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同的蓝色荧光斑点。
【检查】水分不得过9.0%(附录ⅨH第一法)。
总灰分不得过7.0%(附录ⅨK)。
黄曲霉毒素照黄曲霉毒素测定法(附录ⅨV)测定。
取本品粉末(过二号筛)约5g,精密称定,加入氯化钠3g,照黄曲霉毒素测定法项下供试品的制备方法,测定,计算,即得。
本品每1000g含黄曲霉毒素B1不得过5μg,含黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1的总量不得过10μg。
【含量测定】酸枣仁皂苷A 照高效液相色谱法(附录ⅥD)测定。
,色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B;按下表中的规定进行梯度洗脱;蒸发光散射检测器检测。
理论板数按酸枣仁皂苷A峰计算应不低于2000。
时间(分钟)流动相A(%) 流动相B(%)0~15 15~28 28~30 30~32 20→404040→7070→10080→606060→3030→0对照品溶液的制备取酸枣仁皂苷A对照品适量,精密称定,加甲醇制成每1ml含0.1mg的溶液,即得。
供试品溶液的制备取本品粉末(过四号筛)约1g,精密称定,置索氏提取器中,加石油醚(60~90℃)适量,加热回流4小时,弃去石油醚液,药渣挥去溶剂,转移至锥形瓶中,加入70%乙醇20ml,加热回流2小时,滤过,滤渣用70%乙醇5ml洗涤,合并洗液与滤液,回收溶剂至干,残渣加甲醇溶解,转移至5ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液5μl、20μl,供试品溶液10μl,注入液相色谱仪,测定,用外标两点法对数方程计算,即得。
本品按干燥品计算,含酸枣仁皂苷A(C58H94O26)不得少于0.030%。
斯皮诺素照高效液相色谱法(附录ⅥD)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的规定进行梯度洗脱;检测波长为335nm。
理论板数按斯皮诺素峰计算应不低于2000。
时间(分钟)流动相A(%) 流动相B(%)0~10 10~16 16~22 22~30 12→1919→2020→10010088→8181→8080→0对照品溶液的制备取斯皮诺素对照品适量,精密称定,加甲醇制成每1ml含0.2mg的溶液,即得。
供试品溶液的制备取酸枣仁皂苷A[含量测定]项下的续滤液,作为供试品溶液。
测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,含斯皮诺素(C28H32O15)不得少于0.080%。
【贮藏】置阴凉干燥处,防蛀。
————————————————。