12/11/2021
第九页,共四十二页。
[归纳(guīnà)总结]
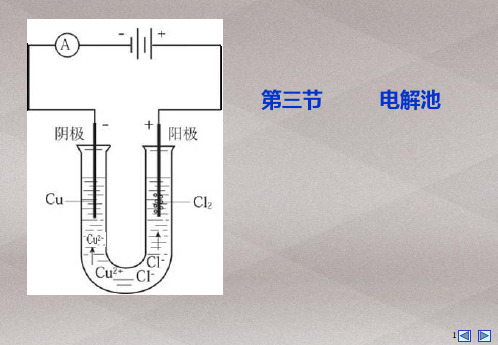
1.解决电解问题的基本思路 哪些离子——通电前电解质溶液中含有的离子种类(包括水电离出的H+和OH-) 谁优先放电(fàng diàn)——通电时,阴离子移向阳极,阳离子移向阴极,结合放电顺 序分析放电物质 分析电解结果——写电极反应式,结合要求分析,如两极现象、水的电离平衡移动、 离子浓度的变化、pH的变化等 2.做到“三看”,正确书写电极反应式 (1)一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定失电子(注:Fe生成Fe2+)。
()
B
2、Cl2、Cl2
2、O2、O2
解析:溶液中的离子有 Cu2+、K+、H+及 Cl-、OH-五种离子,得电子能力 Cu2+>H+>K+, 失电子能力:Cl->OH-,所以电解初期,阴极:Cu2++2e- Cu,阳极:2Cl--2eCl2↑。
12/11/2021
第二十一页,共四十二页。
6.(2018·河南镇平一中月考)对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯
一可行的工业方法。下列有关说法中正确(zhèngquè)的是(
)
D
A.电解熔融NaOH可生成金属钠、O2以及H2
B.电解熔融CaCl2时,金属钙在阳极生成
C.可用电解饱和MgCl2溶液的方法获得金属镁
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解
解析:制取金属钠的方法是电解熔融的氯化钠,A错误;电解熔融CaCl2时,钙离子在 阴极(yīnjí)得到电子变为金属钙,B错误;电解饱和MgCl2溶液时得不到金属镁,只有电 解熔融的氯化镁时才会得到金属镁,C错误;D正确。