§4-4EDTA滴定曲线
- 格式:ppt
- 大小:785.50 KB
- 文档页数:27


edta络合滴定法介绍edta络合滴定法是一种常用的化学分析方法,用于测定金属离子的浓度和种类。
edta(乙二胺四乙酸)是一种强螯合剂,可以与金属离子形成稳定的络合物。
在滴定过程中,通过滴加已知浓度的edta溶液,可以确定待测溶液中金属离子的浓度。
仪器和试剂•滴定仪:包括滴定管、滴定架等。
•edta溶液:已知浓度的edta溶液。
•指示剂:常用的指示剂有eriochrome黑T(Eri-T)和印度洋粉(xylenol orange)。
操作步骤1.准备样品:将待测溶液准确地取出一定体积,转移到滴定瓶中。
2.加入指示剂:根据待测金属离子的性质选择合适的指示剂,加入到滴定瓶中。
指示剂会与金属离子形成有色络合物,当溶液中金属离子被edta络合完全时,指示剂的颜色会发生明显变化。
3.滴定:使用滴定管滴加已知浓度的edta溶液到滴定瓶中,直到指示剂颜色发生变化。
记录下滴定所需的edta溶液体积。
4.计算结果:根据滴定所需的edta溶液体积和其浓度,可以计算出待测溶液中金属离子的浓度。
影响滴定结果的因素1.pH值:edta络合滴定法对溶液的pH值比较敏感,一般要求在特定的pH范围内进行滴定。
pH值的变化会影响金属离子和edta络合的平衡,从而影响滴定结果的准确性。
2.温度:温度的变化也会对滴定结果产生影响。
一般情况下,滴定过程应在恒定的温度下进行,以保证结果的准确性。
3.指示剂的选择:不同的金属离子需要选择不同的指示剂,以保证滴定的准确性和灵敏度。
优点和应用•优点:edta络合滴定法具有操作简便、结果准确、灵敏度高等优点,广泛应用于环境监测、食品检测、药物分析等领域。
•应用:edta络合滴定法常用于测定水中金属离子的浓度,例如测定自来水中的钙、镁离子浓度,或者测定土壤中重金属离子(如铅、镉等)的含量。
注意事项•滴定过程中要注意滴定管的使用,确保滴定液滴加均匀。
•选择合适的滴定指示剂,以确保滴定结果的准确性。
•仪器和试剂要保持干净,避免杂质的干扰。


edta络合滴定法EDTA络合滴定法是一种常用的分析化学方法,它广泛应用于金属离子的定量分析以及环境、食品、医药等多个领域。
该方法基于金属离子和EDTA(乙二胺四乙酸)之间的络合反应,通过滴定过程中络合物的形成与断裂,确定金属离子的含量。
本文将介绍EDTA络合滴定方法的原理、步骤、影响因素以及其应用。
1. 原理EDTA是一种能与金属离子形成稳定络合物的配体,它的酸碱性介于中性范围,独特的配位骨架使得它能与多种金属离子形成络合物。
在络合滴定过程中,首先将含有待测金属离子的溶液加入容器中,然后加入EDTA溶液作为滴定剂,滴定剂的浓度和体积是已知的。
加入滴定剂后,金属离子和EDTA之间发生络合反应,形成可溶的络合物,这个过程称为络合滴定反应。
2. 步骤(1)制备标准溶液:测量一定量的含有待测金属离子的溶液,加入稳定剂,稀释到一定体积。
这个溶液被称为标准溶液,用于滴定分析。
(2)准备滴定溶液:称取适量的EDTA盐固体,溶解在适量的盐酸中,并经过稀释得到EDTA滴定溶液。
(3)滴定:使用滴定管取一定量的标准溶液,加入适量的pH 缓冲液和指示剂,使其达到最适的pH条件。
然后滴定EDTA溶液,直到金属离子与EDTA发生定量的络合反应。
进一步加入指示剂,根据指示剂的颜色变化来确定终点。
(4)计算:根据滴定剂的浓度和体积,以及标准溶液的体积,计算出待测溶液中金属离子的浓度。
3. 影响因素EDTA络合滴定法的准确性和精确度受到多种因素的影响,包括pH值、温度、金属离子的选择、络合剂和指示剂的选择等。
确保滴定过程中的pH值恒定可以提高滴定的准确性。
温度的控制可以提高滴定反应的速率和反应的稳定性。
选择合适的金属离子、络合剂和指示剂可以使络合反应达到最佳效果,提高分析结果的准确性。
4. 应用EDTA络合滴定法广泛应用于金属离子的定量分析和质量控制。
它可以用于分析环境样品中的重金属含量,例如水中的铜、铁和锌。
在食品行业,EDTA络合滴定法可以用于测定食品样品中的钙、镁和锰等元素的含量。

edta试验标准曲线画法EDTA试验标准曲线画法EDTA(乙二胺四乙酸)试验是化学分析中常用的一种定量分析方法,用于测定金属离子的浓度。
在进行EDTA试验时,绘制标准曲线是非常重要的步骤之一,它可以帮助我们准确地计算待测溶液中金属离子的浓度。
本文将详细介绍EDTA试验的标准曲线画法。
一、实验原理EDTA试验是通过EDTA与金属离子形成络合物,利用络合反应进行定量分析的方法。
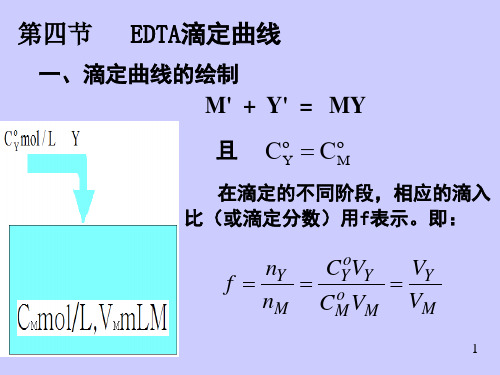
在EDTA试验中,溶液中的金属离子与EDTA配位形成稳定的络合物,络合反应的进程满足化学平衡:M2+ + Y4- ⇌ MY2-其中,M2+表示金属离子,Y4-表示EDTA,MY2-表示络合物。
根据化学平衡原理,可得到络合反应的平衡常数表达式:K = [MY2-] / ([M2+][Y4-])其中,K为平衡常数,[M2+]、[Y4-]和[MY2-]分别表示金属离子、EDTA和络合物的浓度。
二、实验步骤1. 准备一系列含有不同浓度金属离子的标准溶液。
2. 分别向每个标准溶液中加入相同量的EDTA试剂。
3. 加入适量的NH3-NH4Cl缓冲溶液,使溶液中的pH维持在7-10的范围内,以提供最适合络合反应进行的条件。
4. 使用指示剂,如Erichrome Black T指示剂,使反应液呈现特定的颜色。
5. 利用紫外-可见分光光度计,测量不同标准溶液中反应液的吸光度。
6. 绘制吸光度与金属离子浓度之间的标准曲线。
三、标准曲线画法1. 在纵坐标上标注吸光度值,横坐标上标注金属离子的浓度。
2. 将实验测得的吸光度值按照一定的比例缩小,以便在有限的纸张空间内画出整个曲线。
3. 使用直尺或软尺,根据不同金属离子浓度对应的吸光度值,在坐标平面上点出若干个坐标点。
4. 连接相邻的坐标点,画出平滑的曲线。
5. 为了更好地表示实验测量的准确性,通常会画出实验数据的误差棒,即在每个坐标点上方和下方标注出误差范围。
6. 添加适当的图例,包括标准曲线的名称,单位等。